玉米和大豆根尖和非根尖部位對Mn(II)的吸附研究①
陸海龍,徐仁扣
玉米和大豆根尖和非根尖部位對Mn(II)的吸附研究①
陸海龍1,2,徐仁扣1*
(1 土壤與農業可持續發展國家重點實驗室(中國科學院南京土壤研究所),南京 210008;2 中國科學院大學,北京 100049)
為了探索玉米和大豆根系根尖部位和非根尖部位對Mn(II) 吸附的差異及其機制,用砂培試驗獲取兩種植物的新鮮根,將根系分為根尖部位和非根尖部位2部分,用流動電位法和紅外光譜法(ATR-FTIR)分別表征了它們根表的zeta電位和官能團;將根系與Mn(II) 反應,然后用KNO3、EDTA-2Na和HCl連續提取的方法確定吸附在植物根表Mn(II) 的結合形態和吸附量。研究結果表明:吸附在植物根表的Mn(II) 主要以交換態存在,根尖部位的交換態Mn(II) 和吸附Mn(II) 的總量要明顯大于非根尖部位。根尖部位所帶負電荷和官能團的數量多于非根尖部位,是前者對Mn(II) 具有更高吸附容量的主要原因。因此,植物根系的表面電荷特征和官能團數量在根系及根尖部位吸附Mn的過程中起著重要的作用。
根尖部位;zeta電位;表面電荷;Mn(II) 吸附;官能團
大豆和玉米是主要的經濟作物和糧食作物[1]。錳(Mn)是植物生長必需的微量營養元素[2],不僅參與調節植物的光合作用,而且在活性氧自由基清除中作為Mn超氧化物歧化酶的成分也發揮重要作用[3]。Mn對污染物遷移、氧化還原反應和土壤有機物質的分解起著重要作用[4-5]。但土壤中活性Mn含量超過一定范圍會對植物產生毒害。植物吸收的Mn先積累于葉,過量的Mn對植物的葉片和根均產生不利影響[6]。植物受Mn毒害表現出很多癥狀,包括葉脈失綠[7]、棕色斑點形成[8]、皺葉[9]、葉子發育遲緩、僵硬和葉尖壞死等[10]。
植物主要通過根系來吸附和吸收土壤中的養分元素和有毒金屬離子[11-13]。植物根系表面是各種離子進入植物體的第一道屏障,而根尖是植物感受有利(水、養分等)和不利(干旱、重金屬等)環境條件的重要部位,能快速響應環境變化,因此根尖對植物的生長和發育至關重要[14]。楊野等[15]研究發現,鋁脅迫導致植物根尖尤其是伸長區細胞的細胞壁組成物質含量、比例及結構發生改變,造成細胞壁彈性降低,從而抑制根尖伸長細胞的生長。鐵、銅和鎘等重金屬元素對植物根尖邊緣細胞也具有毒害作用[16]。
根尖是植物吸收養分的主要部位[17-18]。根尖部位和非根尖部位的表面化學性質不同,從而對養分和有毒物質的吸附和吸收也不同。為了探索這種差異,本文以徐豆14和蘇玉20兩種作物為研究對象,用流動電位法和衰減全反射紅外光譜(ATR-FTIR)技術研究了根系根尖部位和非根尖部位表面電荷的差異及原因,考察了Mn(II) 在根尖部位和非根尖部位吸附的差異及其與根表電荷性質的關系。研究結果可為進一步理解植物根尖在吸收養分和緩解有毒金屬毒害中的作用提供參考。
1 材料與方法
1.1 試驗材料
本研究選用的大豆(cv.)和玉米(L.)品種分別為徐豆14和蘇玉20。選擇飽滿一致的種子,首先用10% 的雙氧水消毒15 min,再用蒸餾水清洗干凈后,于蒸餾水中浸泡6 h;然后分別把大豆和玉米種子置于滅菌的砂子中25 ℃避光催芽,砂子覆蓋厚度約為2 cm。待種子露芽時,放置在人工生長室(14 h光照,28 ℃;10 h黑暗,20 ℃;光照強度375 μmol/(m2·s);相對濕度70%)中進行培養。2 d后用去離子水洗凈植物鮮根進行試驗。
1.2 根不同部位流動電位的測定
將植物的根與莖分離,用蒸餾水清洗根系3次后,小心吸干表面水分,用實驗室自制的流動電位裝置測定植物根系根尖部位和非根尖部位的zeta電位[19]。植物根尖一般指從根系最先端開始0.4 ~ 0.6 cm的幼嫩部分。由于測定條件的限制,在測定根系流動電位時根系的長度不能太短,因此,本研究中以根系的最先端為起點,將新鮮的植物根系剪成0 ~ 3 cm和3 ~ 6 cm兩段,分別代表根尖部位和非根尖部位。每一部分混合均勻后填滿樣品池,向電解質溶液箱中加入1.5 L電導率為80 μS/cm的NaCl溶液,平衡2 h后棄去電解質溶液并更換1.5 L新鮮的同樣濃度的電解質溶液,再平衡10 min。通過一對固定于樣品池兩端的Ag/AgCl電極測定樣品的流動電勢(Δ),而通過一對固定于樣品池兩端的Pt電極測定整個樣品池總電導率()。通過恒流泵將電解質溶液泵入樣品池,并通過閥門改變驅動力獲得不同液壓差(Δ)時的流動電位。根據Helmholtz-Smoluchowski方程,由測定的流動電位計算根尖部位和非根尖部位的zeta電位[20]。
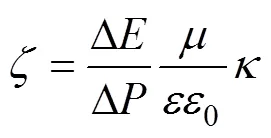
式中:是zeta電位(mV);Δ是流動電位(mV);Δ是液體壓力差(Pa);是溶液的黏滯系數(Pa S);是電解質溶液的介電常數(F/m);0是真空介質的介電常數(F/m);是溶液電導率(S/m)。
1.3 根不同部位對Mn的吸附/解吸
取自根尖開始6 cm長的新鮮根,吸附試驗前將根放置于去離子水中浸泡12 h以清除根表多余的營養離子。用MnCl2配置Mn(II) 溶液,稱3 g新鮮根于60 目尼龍網袋中,磁力攪拌條件下與500 ml 50 μmol/L的Mn(II) 溶液反應2 h。吸附完成后,將根從溶液中取出并用去離子水沖洗3次,小心吸干水分。將每條根分成2段,每段長3 cm(0 ~ 3、3 ~ 6 cm),稱重,然后依次放入0.1 mol/L KNO3、0.05 mol/L EDTA-2Na和0.01 mol/L HCl的200 ml溶液中提取根表吸附的交換態、絡合態和沉淀態Mn(II)[21]。提取完成后,用原子吸收分光光度法(Nov AA350,Analytikjena AG,Jena,Germany)測定3種提取液中Mn(II) 的含量。將3種形態的Mn(II) 加和作為根表吸附的Mn(II) 總量。
我國土壤Mn含量有很大的變異范圍,通常在10 ~ 5 532 mg/kg,平均含量為710 mg/kg。表層土壤中Mn的含量主要與降水和風化程度等因素有關[22]。Mn在土壤中主要以Mn(III) 和Mn(IV) 的氧化物存在于土壤固相部分,Mn(III) 和Mn(IV) 離子很難在土壤溶液中長期穩定存在,僅作為一些反應的中間產物而短暫存在[23]。由于Mn(II) 的還原能力弱,Mn(II) 在酸性土壤中能穩定存在,這也是酸性土壤中容易產生Mn對植物毒害的主要原因。因此,本文選用Mn(II) 進行吸附/解吸試驗。
1.4 根不同部位衰減全反射紅外光譜(ATR-FTIR)測定
將根系的根尖部位(0 ~ 3 cm)和非根尖部位(3 ~ 6 cm)樣品用去離子水洗凈并風干后,用裝配有金剛石探頭(ATR探頭)的Nicolet iS10紅外光譜儀(Nicolet Analytical Instruments,Madison,Wisconsin,USA)測定根表的紅外光譜。光譜的掃描范圍是650 ~ 4 000 cm–1,掃描分辨率是4 cm–1,每個樣品的光譜采集掃描32次的數據。
1.5 統計分析
使用SPSS 20.0(SPSS Inc., Chicago, USA)軟件進行數據處理和統計分析。使用t檢驗檢測處理之間的差異在<0.05水平上的顯著性。
2 結果與討論
2.1 根尖部位和非根尖部位的表面電化學性質
zeta電位的結果表明,在所測定的pH 4 ~ 7.5范圍內,兩種植物根系的根尖部位和非根尖部位的zeta電位均為負值(圖1),表明根系表面帶凈負電荷,與之前的研究報道一致[24-25]。隨著電解質溶液pH的升高,兩種植物根系的根尖部位和非根尖部位的zeta電位均逐漸變的更負,說明根系表面所帶負電荷隨pH升高而增加。根系表面負電荷主要來自含氧官能團的解離,隨著pH升高,官能團解離程度增加,負電荷增多。
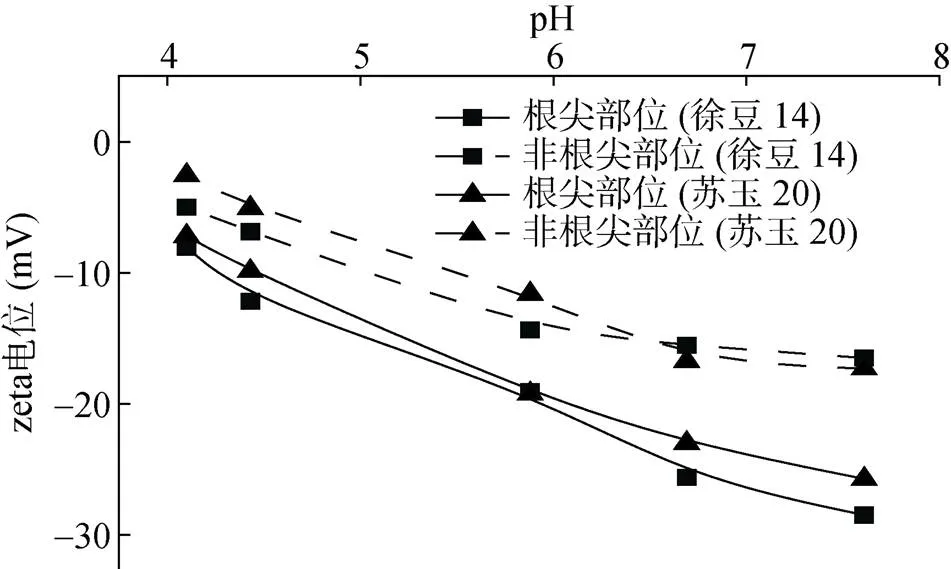
圖1 不同pH條件下玉米和大豆根尖部位和非根尖部位的zeta電位
從圖1中可以看出,兩種植物根系的根尖部位zeta電位比非根尖部位的zeta電位更負,且隨著溶液pH升高,根尖部位和非根尖部位zeta電位的差值變大。如pH 4.5時玉米根系的根尖部位和非根尖部位zeta電位差值為4.8 mV,pH 6.7時相應差值為6.3 mV;pH 4.5時大豆根系的根尖部位和非根尖部位zeta電位差值為5.3 mV,pH 6.7時相應差值為10.1 mV。這些結果表明,植物根系的根尖部位比非根尖部位帶有更多的負電荷。
2.2 根尖部位和非根尖部位的紅外光譜
由于植物根表含有大量的官能團(–COOH、–OH等),這些官能團解離以后,使得植物根表帶負電荷并且為金屬陽離子提供結合位點。兩種植物根尖部位和非根尖部位的紅外光譜見圖2。位于1 633、1 544和1 243 cm–1處的吸收峰分別代表酰胺Ⅰ(蛋白質中C=O的伸縮振動和N–H的彎曲振動),酰胺Ⅱ(N–H的彎曲振動)和酰胺III(N–H的彎曲振動和C–N的伸縮振動)[26];1 397 cm?1處的吸收峰是–COO–的對稱振動[27];位于1 369 cm–1和1 028 cm–1處的吸收峰分別歸屬于纖維素中的C–H伸縮振動和糖類的C–OH彎曲振動[28-29]。根尖部位和非根尖部位各吸收峰位置沒有明顯差異,表明它們根表含有相似的官能團。但是,根尖部位各吸收峰強度均高于非根尖部位(圖2),表明根尖部位官能團的含量多于非根尖部位。這是根尖部位比非根尖部位帶有更多負電荷的主要原因。
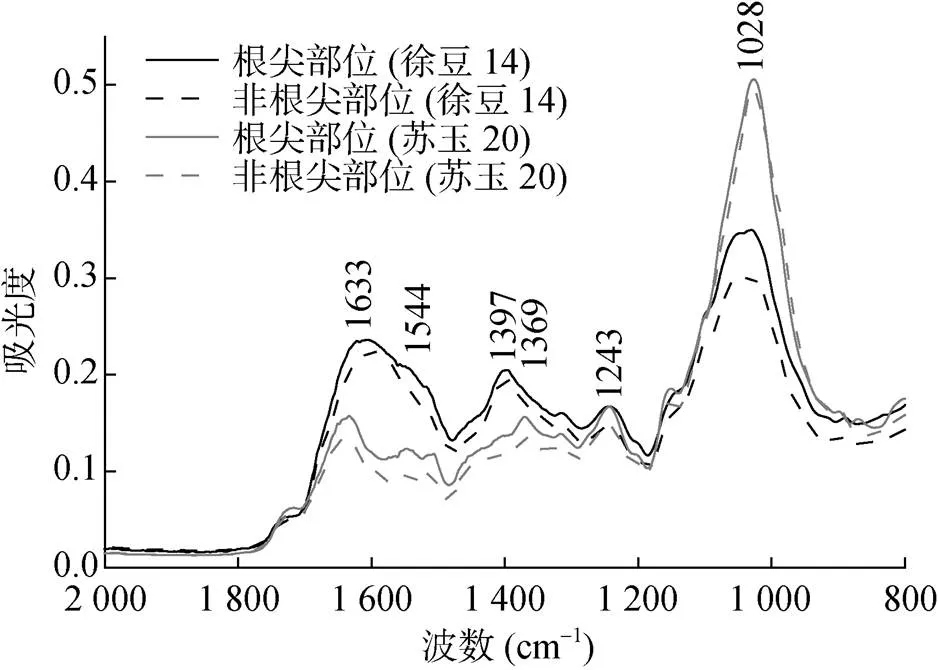
圖2 玉米和大豆根系根尖部位和非根尖部位的ATR-FTIR光譜圖
2.3 根尖部位與非根尖部位對Mn(II) 的吸附及其與根系電荷性質的關系
當根系與Mn(II) 溶液相互作用后,根表吸附的Mn(II) 可區分為交換態、絡合態和沉淀態3種形態[30]。交換態Mn(II) 在根表吸附的Mn(II) 總量中占比最大,其次是絡合態Mn(II) 和沉淀態Mn(II)(圖3),因此Mn(II) 離子在根表主要以交換態存在。當Mn(II) 的初始濃度為50 μmol/L時,玉米根尖部位吸附的3種形態Mn(II) 的量要明顯高于非根尖部位(<0.05)。大豆根尖部位吸附交換態Mn(II) 的量顯著高于非根尖部位(<0.05);吸附絡合態和沉淀態Mn(II) 的量也高于非根尖部位,但差異不顯著。將3種形態Mn(II) 求和獲得Mn(II) 在根表的吸附總量,結果表明,兩種植物根系根尖部位吸附的Mn(II) 總量也顯著高于非根尖部位,與交換態Mn(II) 具有相似的變化趨勢(圖3)。根尖部位吸附Mn(II) 的量高于非根尖部位,表明根尖部位比非根尖部位具有更強的吸附能力。
交換態Mn(II) 主要通過帶負電荷的根表與金屬陽離子之間的靜電引力作用而吸附在植物根表,其數量主要決定于根系表面的電荷性質。根表所帶負電荷數量越多,對Mn(II) 的吸附能力越強。由于兩種植物根系的根尖部位帶有更多的負電荷,因此能吸附更多的交換態Mn(II)。吸附于根表的交換態陽離子具有很高的活性,容易被植物吸收利用。因此,根尖部位對Mn(II) 有更大的靜電吸附量可能是根尖部位能夠吸收和積累更多Mn(II) 的主要原因。Liu和Xu等[21]研究發現,交換態鋁在根尖部位的吸附量高于其他部位,并且隨著離根尖距離的增加,交換態鋁的含量逐漸降低。Delhaize等[31]也證明鋁在根尖部位的吸附總量顯著大于其他部位,距離根尖越遠,吸附量越少。這些研究結果與本文觀察的現象一致,說明植物根尖部位帶較多負電荷,導致根尖部位對陽離子有較大的吸附容量是普遍存在的現象。
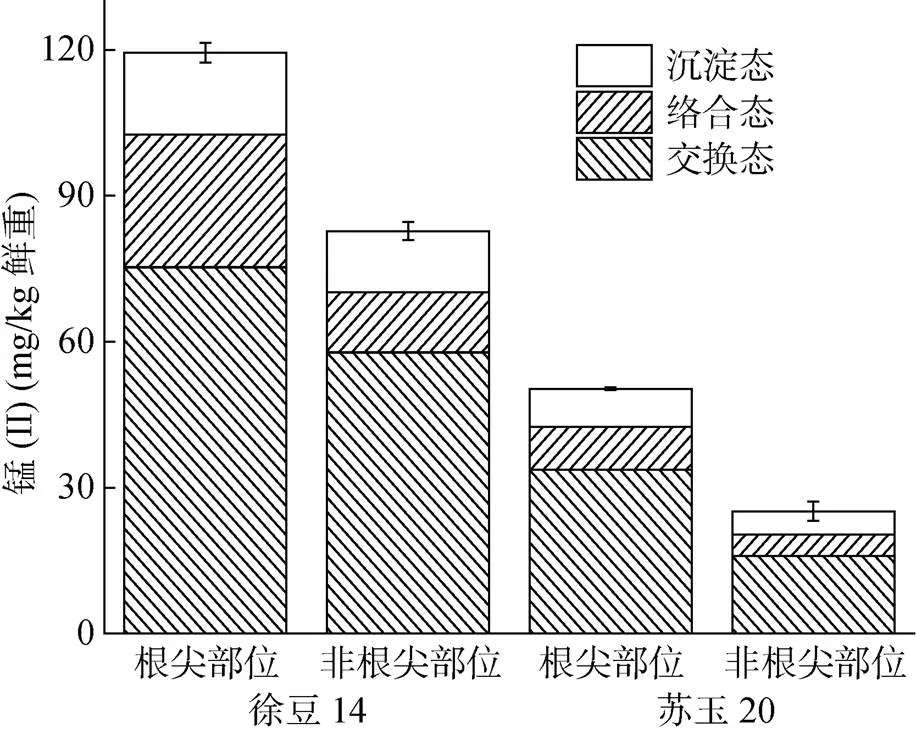
圖3 吸附于兩種植物根尖部位和非根尖部位Mn(II) 的化學形態分布(Mn(II) 初始濃度為50 μmol/L)
由于根細胞壁或原生質膜表面含有大量的–COOH、–OH和–H2PO4等官能團,它們通過質子的解離和締合作用使根表帶電,且以負電為主[32]。因此,植物根表的官能團是負電荷的主要來源,也是植物根表對Mn(II) 和其他金屬陽離子產生靜電吸附的主要原因。另外,根表的這些官能團也能與金屬陽離子形成表面絡合物,是金屬陽離子的主要結合位點,是根表能吸附絡合態Mn(II) 的主要原因。根尖作為根系最活躍的部分,其表面比根系其他部位存在更豐富的–COOH和–OH等官能團[33-34]。因此,植物根系的根尖部位能夠吸附更多的交換態Mn(II) 和絡合態Mn(II)。
3 結論
玉米和大豆根系根尖部位和非根尖部位的電化學性質存在明顯差異,因而根尖部位和非根尖部位對Mn(II) 的吸附能力不同。與非根尖部位相比,根尖部位帶有更多的官能團和負電荷,導致根尖部位吸附的交換態Mn(II)、絡合態Mn(II) 以及Mn(II) 總吸附量均高于非根尖部位。根尖部位帶有更多的官能團和負電荷以及吸附更多的Mn(II) 是根尖部位吸收積累更多Mn(II) 的原因之一。
[1] Oerke E C, Dehne H W. Safeguarding production—losses in major crops and the role of crop protection[J]. Crop Protection, 2004, 23(4): 275–285.
[2] 王玉軍, 歐名豪. 徐州農田土壤養分和重金屬含量與分布研究[J]. 土壤學報, 2017, 54(6): 1438–1450.
[3] Broadley M, Brown P, Cakmak I, et al. Function of nutrients[M]//Marschner’s Mineral Nutrition of Higher Plants. Amsterdam: Elsevier, 2012: 191–248.
[4] Berg B, Steffen K T, McClaugherty C. Litter decompo-sition rate is dependent on litter Mn concentrations[J]. Biogeochemistry, 2007, 82(1): 29–39.
[5] 陳衛平, 楊陽, 謝天, 等. 中國農田土壤重金屬污染防治挑戰與對策[J]. 土壤學報, 2018, 55(2): 261–272.
[6] Wissemeier A H, Diening A, Hergenr?der A, et al. Callose formation as parameter for assessing genotypical plant tolerance of aluminium and manganese[J]. Plant and Soil, 1992, 146(1/2): 67–75.
[7] Foy C D. Physiological effects of hydrogen, aluminum, and manganese toxicities in acid soil[M]//Agronomy Mono-graphs. Madison, WI, USA: American Society of Agronomy, Crop Science Society of America, Soil Science Society of America, 2015: 57–97.
[8] Arnold N, Binns M. Fe, Mn and the grey effect in hydroponically-cultured flue-cured tobacco[J]. Plant and Soil, 1987, 101(1): 39–43.
[9] Keisling T C, Thompson L F, Slabaugh W R. Visual symptoms and tissue manganese concentrations associated with manganese toxicity in wheat[J]. Communications in Soil Science and Plant Analysis, 1984, 15(5): 537–540.
[10] Ohki K. Manganese deficiency and toxicity effects on growth, development, and nutrient composition in wheat1[J]. Agronomy Journal, 1984, 76(2): 213–218.
[11] Sanità di Toppi L, Gabbrielli R. Response to cadmium in higher plants[J]. Environmental and Experimental Botany, 1999, 41(2):105–130.
[12] 曾文號, 黃春燕, 李真, 等. 風化煤對農田土壤重金屬汞的鈍化修復[J]. 土壤, 2018, 50(5): 981–988.
[13] 朱廣龍, 陳許兵, Irshad Ahmad, 等. 酸棗根系導管結構的可塑性對自然梯度干旱生境的適應機制[J]. 土壤學報, 2018, 55(3): 764–773.
[14] Alemayehu A, Zelinová V, Bo?ová B, et al. Enhanced nitric oxide generation in root transition zone during the early stage of cadmium stress is required for maintaining root growth in barley[J]. Plant and Soil, 2015, 390(1/2): 213–222.
[15] 楊野, 王巧蘭, 趙磊峰, 等. 鋁脅迫下植物根尖細胞壁組成物質變化抑制根伸長的生理機制研究[J]. 植物營養與肥料學報, 2013, 19(2): 498–509.
[16] 肖夢茹, 黃碧捷, 張霞, 等. 重金屬對植物根尖邊緣細胞的毒性效應[J]. 綠色科技, 2014(12): 140–142.
[17] Klug B, Specht A, Horst W J. Aluminium localization in root tips of the aluminium-accumulating plant species buckwheat (Moench)[J]. Journal of Experimental Botany, 2011, 62(15): 5453–5462.
[18] Williams P N, Santner J, Larsen M, et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice[J]. Environmental Science & Technology, 2014, 48(15): 8498–8506.
[19] Li Z Y, Liu Y, Zheng Y Y, et al. Zeta potential at the root surfaces of rice characterized by streaming potential measurements[J]. Plant and Soil, 2015, 386(1/2): 237–250.
[20] Childress A E, Elimelech M. Effect of solution chemistry on the surface charge of polymeric reverse osmosis and nanofiltration membranes[J]. Journal of Membrane Science, 1996, 119(2):253–268.
[21] Liu Y, Xu R K. The forms and distribution of aluminum adsorbed onto maize and soybean roots[J]. Journal of Soils and Sediments, 2015, 15(3): 491–502.
[22] 張晗, 靳青文, 黃仁龍, 等. 大寶山礦區農田土壤重金屬污染及其植物累積特征[J]. 土壤, 2017, 49(1): 141– 149.
[23] Snyder G H, Jones D B, Coale F J. Occurrence and correction of manganese deficiency in histosol-grown rice[J]. Soil Science Society of America Journal, 1990, 54(6): 1634–1638.
[24] Lu H L, Liu Z D, Zhou Q, et al. Zeta potential of roots determined by the streaming potential method in relation to their Mn(II) sorption in 17 crops[J]. Plant and Soil, 2018, 428(1/2): 241–251.
[25] Zhou Q, Liu Z D, Liu Y, et al. Relative abundance of chemical forms of Cu(II) and Cd(II) on soybean roots as influenced by pH, cations and organic acids[J]. Scientific Reports, 6(1): 36373.
[26] Sharifi M, Khoshgoftarmanesh A H, Hadadzadeh H. Changes in the chemical properties and swelling coefficient of alfalfa root cell walls in the presence of toluene as a toxic agent[J]. Environmental Science and Pollution Research, 2016, 23(7): 7022–7031.
[27] Wang J, Evangelou B P, Nielsen M T. Surface chemical properties of purified root cell walls from two tobacco genotypes exhibiting different tolerance to manganese toxicity[J]. Plant Physiology, 1992, 100(1): 496–501.
[28] Cai X, Chen T, Zhou Q Y, et al. Development of Casparian strip in rice cultivars[J]. Plant Signaling & Behavior, 2011, 6(1): 59–65.
[29] Singh J, Lee B K. Influence of nano-TiO2particles on the bioaccumulation of Cd in soybean plants (Glycine max): A possible mechanism for the removal of Cd from the contaminated soil[J]. Journal of Environmental Manage-ment, 2016, 170:88–96.
[30] Liu Z D, Zhou Q, Hong Z N, et al. Effects of surface charge and functional groups on the adsorption and binding forms of Cu and Cd on roots of indica and japonica rice cultivars[J]. Frontiers in Plant Science, 2017, 8: 1489. DOI:10.3389/fpls.2017.01489.
[31] Delhaize E, Craig S, Beaton C D, et al. Aluminum tolerance in wheat (L.) (I. uptake and distribution of aluminum in root apices)[J]. Plant Physiology, 1993, 103(3): 685–693.
[32] Wu Y H, Hendershot W H. Cation exchange capacity and proton binding properties of pea (L.) roots[J]. Water, Air, and Soil Pollution, 2009, 200(1/2/3/4): 353–369.
[33] Inbar Y, Chen Y, Hadar Y. Solid-state carbon-13 nuclear magnetic resonance and infrared spectroscopy of composted organic matter[J]. Soil Science Society of America Journal, 1989, 53(6): 1695–1701.
[34] Lin Y H, Chen J H. Aluminum resistance and cell-wall characteristics of pineapple root apices[J]. Journal of Plant Nutrition and Soil Science, 2013, 176(5): 795–800.
Study on Sorption of Mn(II) on Root Tips and Non Root Tips of Maize and Soybean
LU Hailong1,2, XU Renkou1*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
To examine the differences in surface charge and functional groups of root tips and non root tips of plants and their effects on Mn(II) sorption onto plant roots, the fresh roots of maize and soybean were obtained by sand culture experiment and were divided into root tips and non root tips, and then their zeta potentials and functional groups were determined by streaming potential and ATR-FTIR, respectively. The roots were reacted with Mn(II) solution, and then exchangeable, complexed, and precipitated forms of Mn(II) sorbed on plant roots were extracted with KNO3, EDTA-2Na and HCl sequentially. The results showed that zeta potentials of root tips of the two crops were more negative than those of the non root tips, and the root tips of the two crops carried more functional groups than the non root tips. Mn(II) sorbed on the root surfaces of two crops mainly existed as exchangeable form, and the amounts of exchangeable Mn(II) and total sorbed Mn(II) on the root tips were signi?cantly greater than these on the non root tips. The higher negative charge and the larger number of functional groups on the root tips were responsible for their higher adsorption capacity and greater binding strength for Mn(II) than the non root tips. Therefore, surface charges and functional groups play an important role in the sorption of Mn on crop roots.
Root tip; Zeta potential; Surface charges; Mn(II) sorption; Functional groups
S153.2
A
10.13758/j.cnki.tr.2020.05.023
陸海龍, 徐仁扣. 玉米和大豆根尖和非根尖部位對Mn(II) 的吸附研究. 土壤, 2020, 52(5): 1038–1042.
國家自然科學基金項目(41230855)和國家重點研發計劃項目(2016YFD0200302)資助。
陸海龍(1988—),男,安徽亳州人,博士研究生,主要從事植物根系表面電荷性質研究。E-mail: hllu@issas.ac.cn

