IGF-1受體基因rs2229765與絕經后骨質疏松患者骨代謝標志物相關性*
蘇 保 彭曉華 羅小輯 唐 可
重慶醫科大學附屬第一醫院 1 骨科 2 康復醫學科,重慶市 400016
絕經是女性走向衰老的一個重要特征,其潛在機制為雌激素水平急劇降低進而導致全身各系統發生病理改變[1],其中絕經后骨質疏松癥(Postmenopausal osteoporosis, PMO)是老年女性常見的一種全身性骨代謝疾病[2]。據流行病學調查顯示,約40%的50歲以上女性會罹患PMO,而骨折是PMO最為嚴重的并發癥,因其高發病率、高致殘率以及由此帶來的高額醫療花費,逐漸成為一個嚴重的公共健康問題[2]。
近年來,越來越多的證據表明PMO不僅僅與雌激素水平下降有關,基因的作用同樣至關重要[3]。一項基于家系及孿生同胞的研究表明,50%~80%的骨密度受到基因調控[4]。其中胰島素樣生長因子1(Insulin-like growth factor 1,IGF-1)作為一個重要的骨代謝調控因子,逐漸成為骨質疏松領域的一個研究熱點。目前研究發現IGF-1主要通過結合IGF-1受體(IGF-1R)發揮調解骨代謝的作用,其受體rs2229765位點已被證實與PMO發生密切相關,但其具體機制尚不清楚[5]。本研究將探討rs2229765位點等位基因頻率和基因型頻率在PMO患者中的分布特點,并探討該基因位點多樣性與骨代謝標志的相關性,有助于我們從基因水平揭示PMO的發病機制。
1 資料與方法
1.1 一般資料 前瞻性納入2016年1月—2019年1月間來我院骨科、老年科、婦科門診就診的骨質疏松患者180例,列為骨質疏松組;按年齡匹配在體檢中心門診中納入骨量正常的健康絕經后婦女180例,列為對照組。診斷標準為行雙能X線骨密度儀進行腰椎和雙髖關節的骨密度測定,其中T值≤-2.5診斷為骨質疏松;T值≥-1.0則表示為骨量正常。(1)納入標準:①女性年齡≥55歲,且絕經時間≥1年;②無合并其他器官系統疾病;③患者自愿加入本項研究,簽署知情同意。(2)排除標準:①絕經年齡過早≤40歲;②繼發性骨質疏松,或合并其他影響骨代謝相關疾病,如甲狀旁腺功能亢進、庫欣綜合征、強直性脊柱炎等;③長期服用影響骨代謝的藥物如鈣、激素、精神類藥物等;④臨床資料不完整等。
1.2 方法
1.2.1 骨代謝標志物測定:采取空腹靜脈血5ml,離心后吸取上清液立即上機檢測。采用羅氏全自動化學發光免疫分析儀及相關試劑盒分別檢測血清I型前膠原羧基端前肽(Procollagen I N-terminal propeptide,PINP)、I型膠原羧基端β特殊序列(β-crosslaps of collagen cross-linked C-telopeptide,β-CTX)、骨鈣素(Osteocalcin,OC)、甲狀旁腺激素(Parathyroid hormone,PTH)及25-羥維生素D[25-hydroxyvitamin D,25(OH)D]。
1.2.2 基因多態性分析:空腹抽取靜脈血5ml,加入紅細胞裂解液離心后棄去上清,留取白細胞沉淀。采用DNA提取試劑盒提取基因組DNA后(Sna)分析基因型。參考既往文獻,IGF-1R基因rs2229765位點引物:上游5’-CAGGGGTCGTTTGGGATGGTC-3’,下游 5’-CCTGTGCTGCATTTTGGCTTTTC-3’。PCR反應體系如下:2×PCR Master Mix 12.5μl,ddH2O 9.5μl,DNA1μl,引物各1μl。反應條件如下:94℃預變性4min;94℃變性30s,60℃退火30s,72℃延伸30s,共行30個循環,每一個循環退火溫度降低0.5℃;再接著行30個循環:94℃變性30s,45℃退火30s,72℃延伸30s;最后72℃延伸7min。取5μl擴增產物,加酶Mnl 1μl,10×NEB緩沖液5μl,ddH2O 29μl,置于37℃水浴過夜。將反應產物用Gold View染色的瓊脂糖(40g/L)中電泳,凝膠成像儀中拍照觀察。其中GG純合子顯示3條條帶(103bp、84bp、20bp),AA純合子顯示2條帶(123bp、84bp),GA雜合子顯示4條帶(123bp、103bp、84bp、20bp)。

2 結果
2.1 患者基線資料 最終有330名受試者納入本項研究,其中PMO組170例,對照組160例。兩組人群在年齡、絕經時間、體重指數方面無顯著差異(P>0.05)。但PMO組受試者骨密度明顯降低,且PINP和β-CTX的血清水平影響高于對照組(P<0.05),而IGF-1水平則明顯下降(P<0.05),提示IGF-1與骨代謝水平密切相關。但其他骨代謝相關指標OC、25(OH)D和PTH兩組間比較沒有差異性,見表1。
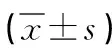
表1 兩組基線資料比較
2.2 基因型及等位基因分布 結果顯示兩組rs2229765基因分布均符合Hardy-Weinberg遺傳平衡,具有群體代表性。但兩組基因型和等位基因分布均存在顯著差異,其中PMO組中基因型AA及等位基因A分布明顯高于對照組(P<0.05);而與GG型相比,基因型GA在兩組間的分布沒有顯著差異(P>0.05),見表2。
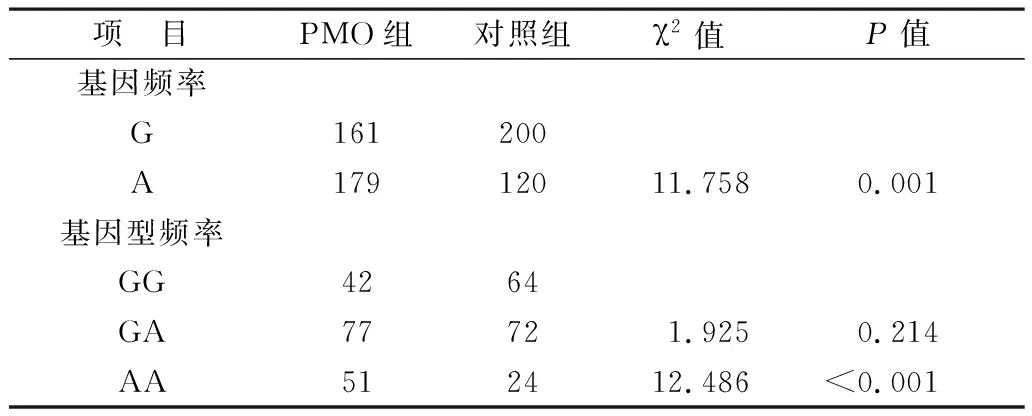
表2 兩組基因型及等位基因比較(n)
2.3 骨代謝標志物在不同基因型間比較 血清骨代謝標志物在三種基因型間的比較結果顯示,血清OC、25(OH)D及PTH濃度在AA、GG和GA三種基因型間無統計學差異(P>0.05);但血清PINP和β-CTX濃度在GA、AA基因型中均高于GG基因型,且在AA基因型中其濃度最高,差異具有統計學意義(P<0.05),見表3。
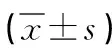
表3 基因型與骨代謝標志物組間比較
2.4 不同基因型與骨密度和骨代謝標志物相關性 進一步運用多因素Logistics回歸分析評估rs2229765位點基因型與骨密度和骨代謝標志物的相關性,在調整年齡、絕經時間、體重指數后,結果顯示與GG基因型相比,AA基因型婦女股骨頸骨密度降低的風險顯著增加(OR=2.13,95%CI:1.65~3.56,P<0.001);而AA基因型腰椎骨密度雖然也有降低,但差異無統計學意義(OR=1.25,95%CI:0.72~1.97,P=0.071);而在兩個重要骨代謝標志物的分析中發現,AA基因型與β-CTX升高顯著相關(OR=2.46,95%CI: 1.65~3.56,P=0.007),但與PINP升高無顯著相關性(OR=1.14,95%CI:0.93~1.22,P=0.169)。這一結果表明在絕經后婦女中,rs2229765與股骨頸骨密度降低和β-CTX升高有著密切聯系。
3 討論
除了年齡相關的骨量流失和雌激素缺乏外,PMO的發病機制亦由基因和環境因素共同決定。胰島素樣生長因子是骨基質中最豐富的生長因子,是一類既能促細胞分化、增殖,又具有胰島素樣作用的多肽物質[6]。在骨組織中,IGF-1主要由成骨細胞分泌,其在生理劑量范圍內,可與成骨細胞表面的特異性受體IGF-1R相結合,增加膠原蛋白合成,酸化骨基質有利于成骨;同時可以通過穩定β-連環蛋白減少成骨細胞的凋亡[7]。本項研究同樣發現IGF-1血清濃度在PMO組中較對照組顯著降低,初步揭示了IGF-1對于骨代謝的重要影響。
IGF-1主要通過其受體發揮對骨代謝的調控作用,近年研究已證實IGF-1R是一種跨膜四聚體糖蛋白,其已發現多種多態性,其中位于第16號外顯子的基因位點rs2229765被認為與PMO密切相關[8]。本研究結果同樣表明在年齡匹配的PMO和骨量正常受試者中,rs2229765的基因型及等位基因分布評論存在明顯差異。進一步相關性分析表明在AA基因型髖關節骨密度顯著降低,但腰椎骨密度雖較其他兩者有所降低,但未見統計學差異。分析原因隨著年齡增長,脊柱退變往往更為明顯,容易出現小關節聚集增生,韌帶鈣化,椎體形態改變、邊緣骨質增生等,因此在老年群體中髖關節骨密度更能反映真實的骨質疏松狀態[9]。但rs2229765多樣性對骨代謝影響的潛在機制值得進一步探討。
骨代謝標志物可實時反映骨轉換狀態,靈敏度高、特異性強,可用于抗骨質疏松療效評價、骨折風險預測等[10]。機體90%的骨基質由Ⅰ型膠原質組成,PINP是Ⅰ型前膠原氨基端的延伸段,其血清含量主要反映Ⅰ型膠原的合成率,是骨形成的主要指標[11];β-CTX是Ⅰ型膠原分解的產物,是骨吸收的特異性指標[12]。本研究初步結果表明PMO組受試者PINP和β-CTX的血清水平高于對照組,與PMO“高轉化”骨代謝特征相符。而對骨代謝物濃度在不同基因型間分析發現,AA基因型中的β-CTX血清濃度顯著高于其他基因型。β-CTX在血清中的含量升高反映骨吸收活性增強,提示骨量丟失越嚴重。最新的薈萃分析結果表明對于PMO婦女,β-CTX較PINP能更好地預測發生骨質疏松骨折的風險。而AA基因型中的β-CTX血清濃度升高也與本項研究中AA基因型髖關節骨密度降低相吻合。
本項研究亦存在一些不足之處,首先該課題是一項橫斷面研究,單中心且樣本量較小,尤其在進行多因素回歸分析時容易造成分析偏倚,導致其臨床循證學意義較弱;其次由于既往臨床資料的局限,所納入的分析骨生化標志物有限,并不能充分反映出患者的骨代謝狀態。
綜上所述,本研究初步證明了IGF-1R基因rs2229765多態性與PMO發生密切相關,其潛在機制是升高破骨活性,導致骨流失,從而降低骨密度,為揭示PMO發病機制,在基因水平對PMO進行診療提供了新的思考方向。

