小鼠下丘腦和海馬組織神經干細胞的蛋白質組學分析
賈雪冰, 孫孟菲, 姚 莉, 劉 暢, 董 茵, 黃日祥, 柏 亮, 唐 晨, 申延琴, 崔 春
(1.江南大學無錫醫學院實驗中心,江蘇 無錫 214122;2.江南大學無錫醫學院神經退行和損傷研究室,江蘇 無錫 214122)
神經干細胞(neural stem cells, NSCs) 具有自我更新和分化成神經元和膠質細胞的能力[1]。因NSCs 在維持腦內穩態和修復腦內損傷細胞的過程中發揮重要作用,使得NSCs 移植對于治療中樞神經系統疾病具有良好前景。研究[2-3]表明:NSCs移植可以延緩衰老,治療帕金森病、阿爾茲海默癥和多發硬化等疾病。成年人NSCs 主要分布于大腦海馬齒狀回顆粒下層(subgranular zone,SGZ) 和側 腦 室 室 下 區(subventricular zone, SVZ)[4]。 最近的研究[5]表明:下丘腦作為調節機體生理狀態的中心,同樣存在著NSCs。LEE 等[6]研究新出生和成年小鼠下丘腦區域發現:下丘腦存在可以持續增殖的細胞,并且增殖的細胞表達NSCs 的標記物Nestin 和Sox2,進一步研究發現這些新生細胞與機體新陳代謝有關聯。研究[7-8]表明:大腦不同區域的神經發生具有特定分化傾向和功能特異性,海馬SGZ 區NSCs 分化形成的神經元主要遷移至齒狀回的顆粒細胞層成為齒狀顆粒細胞,發揮學習、記憶和情緒調節等功能,而SVZ 區NSCs 分化形成的神經元則進行長距離的遷移,到嗅球區域形成顆粒細胞層的顆粒細胞和小球層的小球周細胞,發揮嗅覺和學習等功能[9-10]。SGZ 和SVZ 神經發生的特定分化傾向和功能特異性受到神經遞質、生長因子和細胞內機制的影響[4],但關于下丘腦神經發生的機制尚不明確。
目前干細胞移植治療已經應用于臨床治療,并取得較好的治療效果,研究[11]集中于海馬干細胞的移植。關于下丘腦NSCs 移植治療中樞神經系統疾病的研究鮮有報道,且下丘腦和海馬作為NSCs的來源在蛋白表達方面是否存在差異尚未見研究報道,因此本文作者通過體外培養小鼠原代下丘腦和海馬NSCs,采用蛋白質組學方法研究下丘腦和海馬NSCs 在蛋白表達方面的差異,為下丘腦NSCs研究和NSCs 移植治療神經系統疾病提供更多的思路和理論依據。
1 材料與方法
1.1實驗動物、主要試劑和儀器12 只出生24 h 內的SPF 級雄性C57BL/6J 小鼠(蘇州昭衍新藥研究中心有限公司),動物生產許可證號:SCXK (蘇) 2018-0006。Neurobasal-A 培養基、 磷 酸 鹽 緩 沖 液(phosphate buffered saline,PBS)(pH 7.4)、 TrypLE ? Express 酶、 B-27 Supplement、 D-Hank’s液、 表 皮 生 長 因 子(epidermal growth factor,EGF)、堿性成纖維細胞生長因子(basic fibroblast growth factor,b-FGF)、GlutaMAX 和青霉素-鏈霉素(美國Gibco 公司),Hepes 溶液、 多聚賴氨酸和層黏連蛋白(美國Sigma 公司),PBS 粉(北京索萊寶公司),多聚甲醛和葡萄糖(國產分析純),FITC 羊抗小鼠二抗、Cy3 羊抗兔二抗和DAPI (上海碧云天公司),兔來源Sox2 抗體(美國Millipore 公司),鼠來源Nestin抗體(美國Abcam 公司)。正置顯微鏡(德國蔡司公司),體式顯微鏡(美國Motic 公司),串聯質譜標簽(tandem mass tag,TMT) 標記試劑盒、QExactive 質譜儀和高效液相色譜-串聯質譜(liquid chromatography-tandem mass spectrometry,LCMS/MS)分析系統(美國Thermo Fisher 公司),6 孔培養皿、60 mm 培養皿和100 mm 培養皿(美國Thermo Fisher 公司), 35 mm 共聚焦皿(美國Nunc 公司)。
1.2原代NSCs的提取和培養
將出生24 h 內的乳鼠經75% 酒精消毒后,采用剪刀斷頭處死,在無菌環境中解剖出整腦組織,采用Solution A溶液(D-Hank’s 溶液含30 mmol·L-1葡萄糖、2 mmol·L-1Hepes 溶液和26 mmol·L-1的NaHCO3) 洗滌3 次,將整腦組織置于盛有預冷的Solution A 溶液的培養皿中,在體式顯微鏡下解剖出海馬和下丘腦,將海馬和下丘腦剪切成1 mm×1 mm×1 mm 的小塊,采用TrypLE?Express 酶在37℃環境下消化組織25~30 min,PBS 終止消化,反復吹打消化組織,200 目細胞篩過濾,室溫200 g離 心 5 min 棄 去 上 清, 采 用 IPM 培 養 基(Neurobasal-A 培 養 基 中 含2% B27, 20 μg·L-1EGF,10 μg·L-1b-FGF,0.24% GlutaMAX,1%雙抗) 重懸細胞,細胞計數,以5×105mL-1的細胞密度鋪于6 孔板中,在37℃、5% CO2的培養箱中培養,每隔1 d換去一半IPM培養基繼續培養[12]。
1.3 NSCs的傳代培養
分離培養的原代NSCs 培養5~7 d 后,在顯微鏡下可見大量懸浮的神經球,收集含有神經球的培養液,室溫200 g 離心5 min 收集細胞,37℃環境下TrypLE?Express 酶消化細胞10 min,PBS 終止消化,將神經球吹打成單細胞懸液,室溫200 g 離心5 min 收集細胞,采用IPM 培養基重懸細胞,經細胞計數后以1×105mL-1的細胞密度進行懸浮培養。
1.4免疫熒光法檢測NSCs形成的神經球中Nestin和Sox2的表達
傳代1 次的NSCs (P1 代) 形成神經球后,室溫200 g 離心5 min 收集細胞,IPM 培養基重懸后,接種于預 先 包 被0.1 g·mL-1多 聚 賴 氨 酸 和1 g·mL-1層黏連蛋白包被的35 mm 共聚焦皿中,培養24 h 使神經球貼壁生長, 然后棄去培養液,PBS 洗滌3 次, 4% 多聚甲醛固定神經球20 min,PBS 洗滌3 次,每次2 min,0.l% Triton X-100 通透細胞10 min,PBS 洗滌3 次,每次2 min,5% 山羊血清在37℃封閉細胞30 min,棄去封閉液,加入小鼠抗Nestin (1∶100) 單克隆抗體和兔抗Sox2(1∶250) 單克隆抗體,4℃孵育過夜,棄去抗體,PBS 洗滌3 次,每次2 min,加入FITC 標記的羊抗鼠(1∶1 000) 和Cy3 標記的兔抗羊(1∶1 000)二抗37℃孵育細胞1 h,PBS 洗滌3 次,每次2 min,DAPI (1∶1 000) 室溫 孵 育15 min , PBS 洗 滌3 次, 每次2 min, 熒光顯微鏡下觀察神經球中Nestin 和Sox2 表 達 信 號。
如果在A中?q∈Q,?B∈2AP都有|δ(q,B)|=1,那么A是一個完全的DFA.一個完全的DFA對于每個輸入字σ∈(2AP)ω都存在一個唯一的運行與之對應.
待培養的傳代2 次(P2 代) NSCs 形成神經球后,采用步驟 “1.3” 方法將P2 代神經球經酶消化成單細胞,采用IPM 培養基將單細胞培養在經多聚賴氨酸和層黏連蛋白包被的35 mm 共聚焦皿中,培養24 h 使細胞貼壁,然后依據步驟 “1.4” 采用免疫熒光法檢測NSCs 中Nestin 和Sox2 的表達,同理檢測傳代3 次(P3 代) 和傳代4 次(P4 代)NSCs 中Nestin 和Sox2 的表達。采用熒光顯微鏡采集NSCs 中Nestin 和Sox2 表 達 信 號 后, 計 算Sox2+/DPAI 和Nestin+/DPAI,以此代表Nestin 和Sox2 的陽性表達率。
1.5蛋白質組學法分析下丘腦和海馬組織NSCs中蛋白表達
1.5.1 下丘腦和海馬組織中NSCs 總蛋白的提取P4 代 海 馬 的NSCs 設3 個 重 復 樣, 分 別 為HI1、HI2 和HI3, P4 代 下 丘 腦 的NSCs 設3 個 重 復 樣,分別為HY1、HY2 和HY3,收集培養的P4 代海馬和下丘腦組織中NSCs,室溫200 g 離心5 min 收集NSCs,加 入4℃預 冷 的PBS , 重 懸 細 胞, 4℃、200 g 離心5 min,棄去上清,加入預冷的SDT 裂解液,超聲裂解,25℃、14 000 g 離心40 min 收集沉淀,采用BCA 法進行蛋白質定量,將樣品保存于-80℃。
1.5.2 TMT 標記實驗 將 “1.5.1” 步驟提取的6 組NSCs 總蛋白采用FASP 法用胰蛋白酶酶解成肽段,經酶標儀于280 nm 處進行定量檢測肽段吸光 度(A) 值, 每 組 分 別 取100 μg 肽 段, 采 用TMT 試劑進行標記。
1.5.3 高pH 反相肽段分級的檢測 將每組標記后的肽段等量混合后通過高反相分級,具體方法:采用乙腈和0.1% 三氟乙酸進行柱平衡,將標記后的肽段樣品上樣,加入純水后低速離心進行脫鹽處理,采用梯度濃度的高pH 乙腈溶液對柱結合肽進行梯度洗脫, 洗脫的肽段樣品真空干燥后采用12 μL 0.1% 三氟乙酸復溶凍干樣品,測定肽段濃度后備用。
1.5.4 高效液相色譜- 串聯質譜(liquid chromatography-tandem mass spectrometry ,LC-MS/MS)分析 分級后的肽段樣品采用納升流速的HPLC 液相系統Easy nLC 進行分離。色譜柱以95% 的緩沖液(0.1% 甲酸水溶液) 平衡,樣品由自動進樣器上樣到上樣柱,以300 nL·min-1的流速經過分析柱分離。
樣品經色譜分離后采用Q-Exactive 質譜儀進行質譜分析。檢測方式為正離子母離子,掃描范圍為300~1 800 m·z-1, 一 級 質 譜 分 辨 率 為70 000(200 m·z-1),最大離子注入時間為50 ms,動態排除時間為60 s。每次全掃描后采集20 個碎片圖譜(MS2 scan), MS2 激 活 類 型 為HCD , 隔 離窗 口 為2 m·z-1, 二 級 質 譜 分 辨 率 為17 500(200 m·z-1),共進行15 個1 h 的LC-MS 分析,得出原始質譜數據。
1.5.5 蛋白質信息的匯總 采用Moscot 2.2 和Proteome Discoverer 1.4 統計軟件對原始質譜數據進行數據庫檢索和定量分析, 按照過濾參數FDR <0.01 合并所有定量和定性蛋白質分析結果。以P<0.05 為差異有統計學意義。
1.5.6 生物信息學分析 對倍數變化>1.2 倍且P<0.05 的差異蛋白質進行生物信息學分析,包括基因本體(Gene Ontology,GO) 分析和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG) 分析。
1.6統計學分析
采用SPSS 22.0 統計軟件對數據進行統計學分析。下丘腦和海馬組織NSCs 中Nestin 和Sox2 陽性表達率、下丘腦和海馬組織NSCs 中差異蛋白質的表達水平均符合正態分布,以x±s表示,組間比較采用t檢驗。 以P<0.05 為差異有統計學意義。
2 結 果
2.1 NSCs的形態表現NSCs 在體外懸浮培養時,由于NSCs 增殖會形成神經球,從乳鼠下丘腦和海馬中提取的細胞在體外懸浮培養5 d 后,在顯微鏡下可觀察到球狀的細胞團,即為NSCs 形成的神經球,顯微鏡下下丘腦組織中NSCs 和海馬組織中NSCs 形成的神經球不透明, 具有較高的折光率,球的邊緣有微絲,表明神經球具有較好的狀態。見圖1。
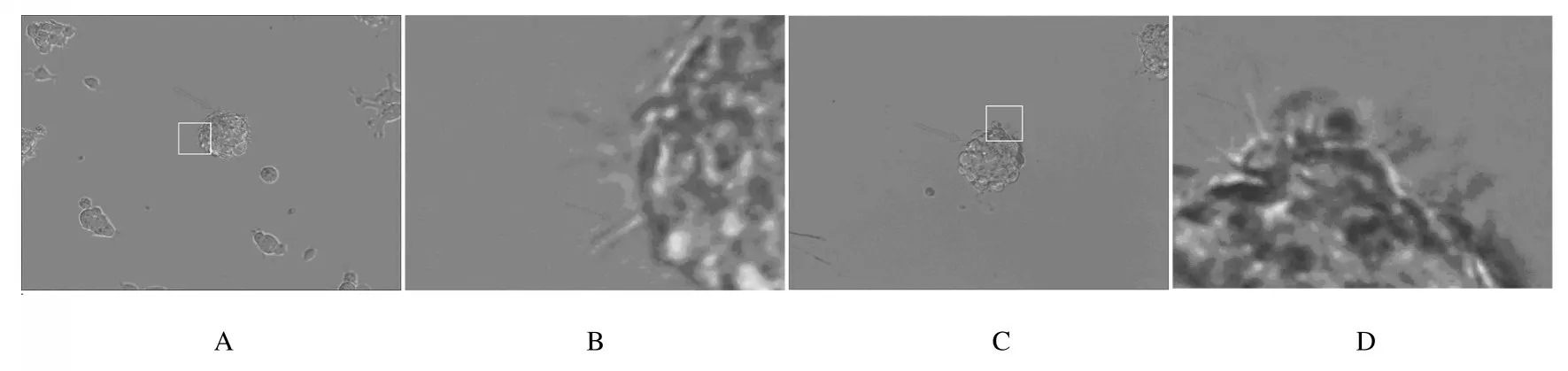
圖1 小鼠來源的P0 代下丘腦和海馬組織中NSCs 形態表現(Bar=200 μm)Fig.1 Morphology of mouse-derived P0 generation NSCs in hypothalamic and hippocampal tissues(Bar=200 μm)
2.2 NSCs的鑒定P2 代下丘腦神經球和海馬神經球均呈現Nestin 表達陽性和Sox2 陽性,表明懸浮培養的神經球為NSCs。見圖2 (插頁二)。
2.3傳代培養后下丘腦和海馬組織中NSCs的純化率P2~P4 代下丘腦和海馬組織中NSCs 中Nestin 和Sox2 的陽性表達率隨著代數的增加而增加,但下丘腦和海馬組織NSCs 中Nestin 和Sox2 的表達陽性率比較差異無統計學意義(P>0.05)。當傳代培養到P2 代,下丘腦組織NSCs 中Sox2 陽性 表 達 率 為(76.87±5.65) % (Sox2+/DPAI),海馬組織NSCs 中Sox2 陽性表達率為(80.75±10.76) %; 下丘腦組織NSCs 中Nestin 陽性表達率 為(74.66±9.40) % (Nestin+/DPAI), 海 馬組織NSCs 中Nestin 陽性表達率為(80.72±12.71) %,見圖3。當傳代培養到P4 代,下丘腦組織NSCs 中Sox2 陽性表達率為(98.35±2.58) %, 海馬組織NSCs 中Sox2 陽性表達率為(99.48±1.06) %;下丘腦組織NSCs 中Nestin 陽性表達率為(98.73±1.81) %, 海馬組織NSCs中Nestin 陽性表達率為(99.48±1.06) %,見圖4(插頁三) 和圖5,即傳代培養可以提升下丘腦和海馬組織NSCs 的純化率,因此,本課題組選擇具有較高純度的P4 代下丘腦和海馬組織的NSCs 用于后續研究,較高的NSCs 比例為蛋白質組學的分析提供了保證。
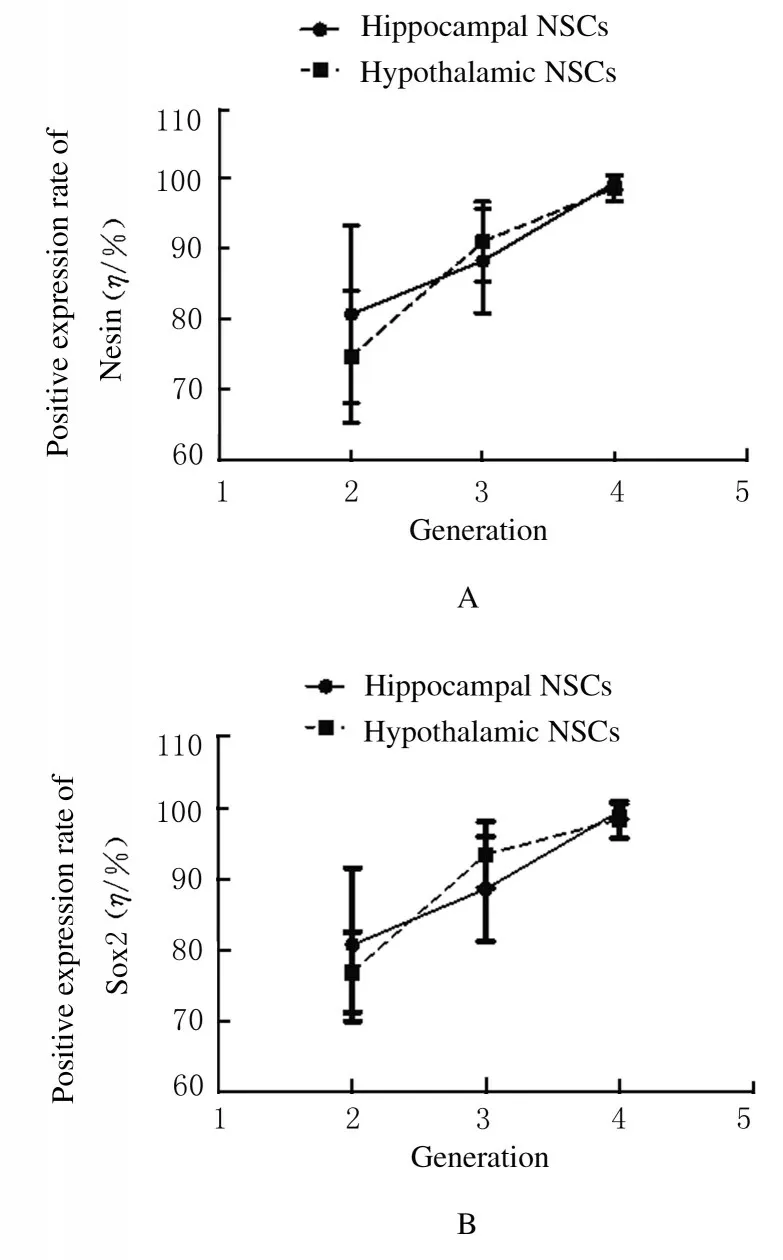
圖3 下丘腦和海馬組織P2~P4 代NSCs 中的Nesin 和Sox2陽性表達率Fig.3 Positive expression rates of Nesin and Sox2 in P2-P4 NSCs in hypothalamic and hippocampal tissues
2.4下丘腦和海馬組織中NSCs質譜分析通過TMT 標記聯合LC-MS/MS分析共匹配到131 016個質譜圖,鑒定到42 456 個肽段,38 195 個特異性肽段和5 593 種蛋白,對鑒定到的蛋白質進行統計學分析顯示:在下丘腦和海馬組織NSCs 中最終得到10 種差異蛋白,其中相對于海馬NSCs 上調的蛋白有6 種, 相對于海馬NSCs 下調的蛋白有4 種。見表1。
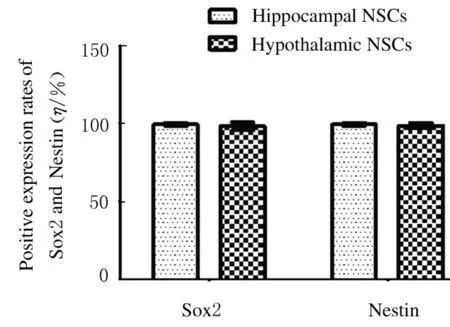
圖5 P4 代下丘腦和海馬組織NSCs 中Nestin 和Sox2 陽性表達率Fig.5 Positive expression rates of Nestin and Sox2 of P4 generation NSCs in hypothalamic and hippocampal tissues
2.5差異蛋白質的GO和KEEG通路分析GO 功能富集分析結果表明:下丘腦組織NSCs 在某些生物 過 程(Biological processes, BP)、分 子 功 能(molecular functions, MF) 和細胞組分(cellular components,CC) 方面與海馬組織NSCs 存在明顯差異。其中,存在差異的BP 有響應銅離子、參與突觸傳遞中多巴胺攝取的負調控、去甲腎上腺素攝取的負調控、谷胱甘肽過氧化物酶活性的正調控、谷胱甘肽過氧化物酶活性的調節和兒茶酚胺攝取的負調控等;存在差異的MF 包括銅離子結合、γ 谷酰 基 羧 化 酶 活 性、 β -1, 3- 半 乳 糖-0- 糖 基- 糖 蛋白β -1,3-N-乙酰氨基葡萄糖轉移酶活性、花生四烯酸的結合、二十醛的結合和rRNA 甲基轉移酶活性;存在差異的CC 有高爾基體膜、血小板顆粒膜和核內膜-內質網膜網絡等方面, 見圖6A (插頁三)。KEGG 通路富集分析結果表明:與海馬組織NSCs 中比較,下丘腦組織NSCs 在可溶性N-乙基馬來酰亞胺敏感性因子附著蛋白受體(SNARE)相關囊泡運動、腎素分泌、甘露糖型0-糖基生物合成、先天免疫缺陷、泛醌和其他萜烯類醌的生物合成、礦物質吸收和皮質醇合成與分泌通路上發生明顯變化,見圖6B (插頁三)。
3 討 論
NSCs 具有多向分化潛能、較低的免疫源性和較好的組織融合性,因此在針對神經退行性疾病如帕金森病及阿爾茲海默病等的治療中,NSCs 移植治療受到關注[13-14]。針對NSCs 的研究集中于海馬的SGZ 和 側 腦 室 的SVZ[4], 最 近 的 研 究[6,15]顯示:下丘腦同樣存在NSCs。下丘腦是機體代謝、內分泌和心血管的調控中心,對于維持機體的穩態發揮重要作用[16]。 美國愛因斯坦醫學院的研究者[17] 發現:下丘腦組織NSCs 可以延緩衰老,提示下丘腦組織NSCs 在治療衰老相關疾病中的潛在作用。下丘腦組織NSCs 和海馬組織NSCs 雖同為腦內NSCs,但關于這2 種分布不同的NSCs 的功能差異尚無相關研究報道,因此本課題組通過蛋白質組學對下丘腦組織NSCs 和海馬組織NSCs 進行蛋白表達的分析。

表1 下丘腦和海馬組織NSCs 中蛋白變化情況Tab.1 Changes of proteins in NSCs in hypothalamic and hippocampal tissues
Nestin 在胚胎發育早期大量表達于神經上皮干細胞中,但在成熟的神經細胞中并不表達,因此常被用于鑒定NSCs[18]。研究[4]表明:Sox2 陽性細胞可以進行自我更新,單個Sox2 陽性細胞可以分化為神經元和膠質細胞。本研究將Nestin 和Sox2作為篩選NSCs 的標志物,并通過Nestin 和Sox2 陽性表達率對比體外培養下丘腦組織NSCs 和海馬組織NSCs 的差異,結果表明對下丘腦組織NSCs 和海馬組織NSCs 進行傳代培養可以增加NSCs 的純度,但下丘腦組織NSCs 和海馬組織NSCs 在傳代培養過程中的純度比較差異并無統計學意義,說明下丘腦組織NSCs 和海馬組織NSCs 在相同培養體系下表現出相似的增殖和分化特性。
本文作者共發現10 種蛋白出現了變化, 其中6 種蛋白在下丘腦組織NSCs 中表達上調,4 種蛋白在下丘腦NSCs 中表達下降,通過生物信息學GO 功能分析和KEGG 通路注釋發現這些差異蛋白主要在突觸傳遞及代謝等方面發揮作用。進一步對蛋白的研究顯示:許多蛋白在維持細胞功能發面發揮重要作用, 如視網膜母細胞瘤樣蛋白2(retinoblastoma-like protein 2,P130),其具有抑制E2F 轉錄激活因子的功能,在調節神經元死亡和存活中起關鍵作用[19]。主要表達于內質網的突觸融合蛋白18 (Syntaxin-18),參與內質網和高爾基體之間的轉運[20]。Syntaxin-18 基因敲除可以導致內質網膜結構的變化,造成平滑內質網膜和粗糙內質網膜的分離[21],表明Syntaxin-18 在細胞生成的蛋白轉運中不可或缺,但關于這些蛋白具體的作用機制尚需進一步研究。
綜上所述,本研究體外培養小鼠原代下丘腦和海馬組織NSCs,通過蛋白質組學鑒定了不同來源NSCs 在蛋白質表達方面的差異,這些差異蛋白對于研究不同類型NSCs 的特性、下丘腦和海馬組織NSCs 移植治療中樞神經系統疾病具有重要意義。

