自噬對粒細胞樣髓源性抑制細胞生存與功能的影響
郭紅葉,朱棟煒,芮棵,田潔,王勝軍
(1.江蘇大學醫學院,江蘇 鎮江 212013;2.江蘇大學附屬醫院檢驗科,江蘇 鎮江 212001)
在機體免疫系統內,髓系細胞是造血細胞中最豐富的類型,在多種生理和病理情況下發揮作用[1]。正常的情況下,造血干細胞分化為髓系前體細胞然后進一步分化為未成熟髓系細胞(不具備免疫抑制功能),這群細胞會遷移到不同外周器官后進行分化。然而,在急慢性感染、創傷、敗血癥以及在腫瘤微環境下,這群未成熟髓系細胞在局部大量聚集,正常途徑的成熟分化過程發生阻滯,并發生活化,成為了一群具有免疫抑制功能的髓源性抑制細胞(myeloid derived suppressor cells,MDSCs),其在許多病理條件下發揮免疫調節功能[2]。MDSCs由兩大類細胞組成:粒細胞樣MDSCs(granulocytic MDSCs,G-MDSCs)和單核細胞樣MDSCs(monocytic MDSCs,M-MDSCs)。在形態上,G-MDSCs與中性粒細胞相似,而M-MDSCs則像單核細胞[1];在表型上,小鼠體內總MDSCs的表型為CD11b+Gr-1+,G-MDSCs表型為CD11b+Ly-6G+Ly-6Clow,M-MDSCs表型為CD11b+Ly-6GlowLy-6Chigh[3]。
在病理情況下,髓樣細胞前體中的可溶性腫瘤壞死因子通過結合腫瘤壞死因子受體1激活STAT3信號通路,導致正常髓系前體增殖并分化為MDSCs[4]。MDSCs是腫瘤微環境中重要的組成部分,可以通過介導免疫抑制來促進腫瘤的發展[5]。MDSCs可以促進調節性T細胞的形成[5],然而調節性T細胞是適應性免疫應答的重要參與者,能夠促進免疫耐受;MDSCs通常分化為免疫抑制性腫瘤相關巨噬細胞[6],并且可以促進成纖維細胞分化為癌癥相關成纖維細胞[7]。MDSCs不僅參與調控腫瘤免疫應答,還可以通過促進腫瘤血管生成、腫瘤細胞侵襲以及轉移前微環境的形成來促進腫瘤發展[8]。
腫瘤晚期患者體內大量存在的MDSCs,往往意味著較差的生存率[9]。自噬途徑是在缺氧條件下誘導的,然而缺氧是大多數腫瘤的主要特征,在腫瘤的發展、轉移和對治療的反應中發揮重要作用[10]。自噬是細胞內一種保守的自降解系統,屬于溶酶體分解代謝途徑[11],參與胞質中長壽命蛋白、蛋白聚集物以及受損傷細胞器降解后再循環利用,在維持組織、器官穩定性及抗腫瘤免疫中發揮至關重要的作用[12]。
雖然大多數研究集中于自噬在腫瘤細胞中的作用[13],但是在腫瘤微環境中自噬如何影響免疫應答特別是MDSCs的作用仍需要進一步的探討。有研究間接表明自噬在調節MDSCs功能方面發揮重要作用,能夠調節缺氧誘導因子1α促進MDSCs向腫瘤相關巨噬細胞分化[14-16]。本研究擬通過檢測自噬對小鼠G-MDSCs存活以及功能的影響,初步探討自噬是否為影響G-MDSCs在腫瘤中大量聚集的原因之一,為臨床上針對免疫抑制細胞的免疫療法提供一定的理論依據。
1 材料與方法
1.1 主要材料
雄性,6~8周齡,體重(20±2)g,SPF級C57BL/6小鼠20只購自揚州大學比較醫學動物中心。Lewis肺癌細胞系為本課題組保存;髓源性抑制細胞分離試劑盒(德國Miltenyi Biotec公司);PE標記抗小鼠Ly-6G抗體、FITC標記抗小鼠Ly-6C抗體、PE/Cy5標記抗小鼠CD11b抗體(美國Biolegend公司);LC3B抗體(美國CST公司);雷帕霉素、氯喹、3-甲基腺嘌呤(美國Sigma公司);FlowCellectTM自噬LC3抗體檢測試劑盒(德國MERK公司);QuantiChromTM精氨酸酶測定試劑盒(美國BioAssay Systems公司)。
1.2 模型構建、細胞分離
小鼠Lewis肺癌細胞系用含10%小牛血清DMEM培養,皮下注射至C57BL/6小鼠。移植后第30 d摘取脾臟,獲得的細胞懸液4℃、500×g離心5 min,棄上清液;加5 mL ACK紅細胞裂解液,靜置5 min;加RPMI 1640培養液,混勻,500×g離心5 min,棄上清液;計數。加PBE緩沖液(PBS中加入EDTA和小牛血清)后加入FcR封閉液,冰上孵育10 min;加入抗-Ly-6G生物素孵育30 min;加PBE,離心5 min,棄上清液;加抗-Ly-6G-生物素磁珠,30 min;加入PBE,4 ℃、500×g離心5 min,棄上清液;加入500 μL PBE,將分選柱置于分選器上,加入細胞懸液用PBE洗滌3次;將分選柱懸于離心管中,加入PBE,推動柱栓得到細胞懸液,即G-MDSCs。
1.3 G-MDSCs純度鑒定
收集1×106個G-MDSCs于EP管中,加1 mL PBS將細胞重懸,離心5 min,棄部分上清液后余約100 μL;重懸后加抗Ly-6G、抗Ly-6C、抗CD11b,4 ℃孵育30 min;加1 mL PBS,4 ℃、500×g離心5 min,棄上清液。加200 μL PBS重懸,上機檢測。
1.4 G-MDSCs形態鑒定
將1×106個G-MDSCs細胞懸液加入到1.5 mL EP管中,加入PBS,混勻,4℃、500×g離心5 min,棄掉部分上清液后余大約100 μL,混勻細胞;取10 μL涂片,待涂片自然干燥,滴加試劑A(瑞氏-吉姆薩復合染液),室溫放置,染色1~2 min;加入等量的試劑B(PBS),混勻,室溫靜置3~10 min。流水沖洗,至液體無色,大約30 s。干燥后,先低倍鏡觀察,然后油鏡下觀察并拍照保存。
1.5 蛋白質印跡法檢測雷帕霉素對G-MDSCs自噬的影響
1.5.1 細胞培養 將含有G-MDSCs的細胞懸液加入24孔板中,每孔細胞數為2×106個,在含有10%胎牛血清的RPMI 1640培養液中進行培養,體系為1 mL,加入1 μL氯喹(原液10 mmol/L,終濃度10 μmol/L)作為對照組。在上述體系中加入20 μL雷帕霉素(原液500 nmol/L,終濃度10 nmol/L)作為雷帕霉素處理組。培養12 h,4℃、500×g離心5 min,棄上清液。
1.5.2 蛋白提取 加入1 mL PBS,離心5 min,棄上清液。細胞沉淀中加50 μL RIPA,每10 min振蕩1次,每次2 min,共3次;4 ℃、14 000×g離心5 min,收集上清液,測定蛋白濃度。加入5×上樣緩沖液于樣品中,沸水浴10 min后置冰上。14 000×g離心10 min,收集上清液備用。
1.5.3 蛋白電泳及顯色 配制濃縮膠(5%)和分離膠(12%),每個上樣孔加80 μg蛋白樣品。80 V電泳,待溴酚藍染料進入分離膠時,電壓調為100 V繼續電泳至結束,取出膠,浸泡在轉膜緩沖液中。確定目的蛋白的大致位置,組裝電轉移裝置,350 mA、2 h后關閉電源,取出PVDF膜。室溫下封閉1 h,加入稀釋抗β-肌動蛋白抗體(1 ∶3 000)、抗LC3B抗體(1 ∶1 000),將PVDF膜浸在一抗中4 ℃孵育過夜,將PVDF膜用1×TBST洗滌3次。加入羊抗鼠HRP-IgG抗體(1 ∶5 000)、羊抗兔HRP-IgG抗體(1 ∶8 000),室溫孵育1 h。取出PVDF膜,1×TBST洗滌3次。顯色,凝膠成像系統及分析儀掃描保存圖像。
1.6 流式細胞術檢測雷帕霉素對G-MDSCs自噬的影響
1.6.1 細胞培養 G-MDSCs處理方法同“1.5.1”。
1.6.2 熒光抗體標記及檢測 加入1 mL PBS重懸細胞,4℃、500×g離心5 min,棄上清液。加100 μL 1×自噬試劑A,4 ℃、500×g離心5 min,棄上清液。加100 μL 1×自噬試劑B,4 ℃、500×g離心5 min,棄上清液。加95 μL分析緩沖液和5 μL 20×抗LC3/FITC抗體,避光孵育30 min。加500 μL分析緩沖液,4℃、500×g離心5 min,棄上清液。加200 μL分析緩沖液重懸,上機檢測。
1.7 流式細胞術檢測自噬對G-MDSCs存活的影響
1.7.1 細胞培養 將G-MDSCs加入24孔板中,每孔2×106個細胞,在含有10%胎牛血清的RPMI 1640培養液中培養,體系為1 mL,加入10 μL雷帕霉素(原液1 μmol/L,終濃度10 nmol/L),此為雷帕霉素組;另一組加入雷帕霉素,同時加入3-甲基腺嘌呤(3-MA,原液200 mmol/L,終濃度5 mmol/L),此為雷帕霉素+3-MA組。培養12 h,混勻,將細胞加入到1.5 mL EP管中,4 ℃、500×g離心5 min,棄上清液。
1.7.2 標記及檢測 加入1 mL PBS后混勻細胞,4℃、500×g離心5 min,棄上清液。加入500 μL結合緩沖液和2 μL 7-AAD,室溫避光孵育10 min,上機檢測。
1.8 ELISA檢測自噬對G-MDSCs效應分子精氨酸酶的影響
1.8.1 細胞培養 G-MDSC處理方法同“1.7.1”。
1.8.2 檢測與計算 加入哺乳動物蛋白抽提試劑,4 ℃、14 000×g離心10 min,取上清液。按照說明書加樣后37 ℃孵育1.5 h。每孔加200 μL尿素制劑,加入10 μL 5×底物緩沖液到樣本空白孔中,室溫避光下放置15 min,選擇波長520 nm測各個樣本光密度(D)值;根據說明書計算精氨酸酶活性。
1.9 統計學處理
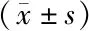
2 結果
2.1 G-MDSCs純度的鑒定
分離純化G-MDSCs細胞,小鼠體內G-MDSCs表型為CD11b+Ly-6G+Ly-6Clow,對細胞進行熒光抗體染色標記后通過流式細胞術檢測磁珠分選獲得的G-MDSCs純度,結果顯示G-MDSCs純度達95%以上(圖1)。
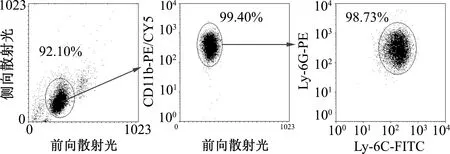
圖1 流式細胞術分析G-MDSCs的細胞純度
2.2 G-MDSCs形態的鑒定
獲得G-MDSCs之后,采用瑞士-吉姆薩染色對其形態進行鑒定(圖2)。結果顯示涂片染色良好,細胞完整,細胞核呈環狀或分葉狀,與文獻中所描述的G-MDSCs形態一致[3]。
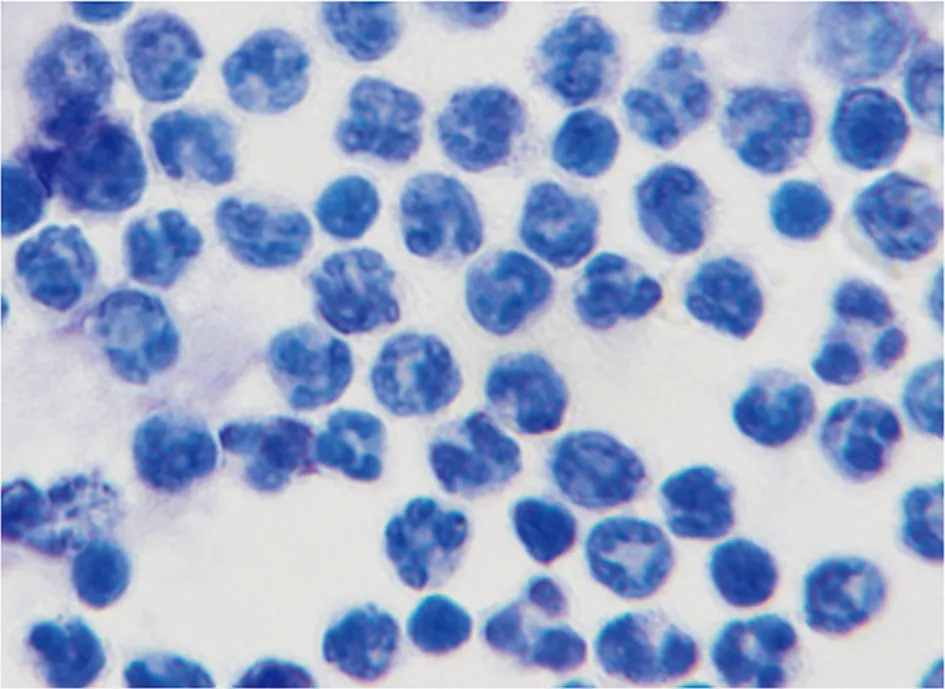
圖2 油鏡下G-MDSCs的細胞形態(瑞吉染色,×1 000)
2.3 雷帕霉素促進G-MDSCs自噬
對獲得的G-MDSCs純度和形態鑒定后,在體外,首先觀察雷帕霉素這種常用的自噬誘導劑是否能誘導G-MDSCs發生自噬。結果顯示,與對照組相比,雷帕霉素處理組LC3-Ⅱ的水平顯著升高而LC3-Ⅰ水平降低,表明大量LC3-Ⅰ轉變為LC3-Ⅱ,提示雷帕霉素上調了G-MDSCs自噬的水平(圖3)。
為了進一步驗證雷帕霉素對G-MDSCs細胞自噬的作用,采用流式細胞術檢測細胞內LC3-Ⅱ。結果顯示,雷帕霉素處理后,增強了細胞內LC3-Ⅱ的熒光強度,表明雷帕霉素上調了G-MDSCs自噬的水平(圖3)。
圖3 雷帕霉素對G-MDSCs自噬的影響
2.4 自噬有利于G-MDSCs存活
加入自噬抑制劑3-MA后,觀察自噬對G-MDSCs體外存活的影響。結果顯示,處理細胞12 h后,雷帕霉素+3-MA組與雷帕霉素組相比,活細胞比例明顯降低(t=3.075,P<0.05),表明自噬對G-MDSCs體外存活發揮了一定的促進作用。見圖4。
2.5 自噬上調G-MDSCs 中精氨酸酶的活性
結果顯示,處理細胞12 h后,雷帕霉素+3-MA組精氨酸酶活性(6.967±0.848)U/106個細胞與雷帕霉素組(11.250±0.635)U/106個細胞相比顯著降低(t=4.046,P<0.05),提示抑制細胞內自噬水平后,細胞免疫抑制功能有所下降,這很可能將利于機體更好地與腫瘤細胞進行對抗。
3 討論
自噬發生的標志分子LC3存在兩種形式,即LC3-Ⅰ和LC3-Ⅱ。細胞中的LC3蛋白合成后在Atg4蛋白酶的作用下形成LC3-Ⅰ。當細胞內發生自噬時,自噬小體分隔膜開始形成,可溶性的LC3-Ⅰ分子與磷脂酰乙醇胺結合形成LC3-Ⅱ,并且始終定位于自噬小體的外膜和內膜上直至與溶酶體融合。在本研究中,在對細胞體外培養時加入氯喹以抑制自噬小體與溶酶體融合,使得自噬小體無法降解,從而保留了LC3-Ⅱ,作為自噬小體的標記,利于結果觀察并判斷細胞內生成自噬小體的水平,來反映發生自噬的水平;在采用流式細胞術展開實驗時,由于在培養時也加入了氯喹,自噬小體以及內容物無法降解,并且通過自噬試劑B作用后,使得染色過的細胞內只保留了存在于自噬小體膜上的LC3-Ⅱ,這樣就可以通過LC3-Ⅱ-FITC的熒光強度的變化來分析判斷細胞內自噬發生的水平。
很多研究已經證實腫瘤發生時,機體內會有大量的MDSCs聚集,然而對于其數量增多的原因,絕大多數研究的關注點在MDSCs的增殖和分化方面。為了探究細胞自噬是否參與了腫瘤患者體內MDSCs大量聚集,首先需要解決的問題就是如何檢測G-MDSCs這群特殊的免疫抑制性細胞其細胞內自噬水平。有研究表明,荷瘤小鼠來源的M-MDSCs胞內mTOR通路下調[17]。所以本研究選擇了通過下調mTOR通路來上調細胞自噬的雷帕霉素,這種常用來在其他細胞中誘導自噬的誘導劑開展研究。結果顯示,檢測細胞自噬的兩種經典方法(蛋白質印跡法和流式細胞術)都可以用來反映這一特殊細胞群體的自噬水平,并且在培養體系中加入自噬抑制劑后,活細胞比例降低,同時細胞內效應分子精氨酸酶水平下調。精氨酸酶是MDSCs用來抑制T細胞活化和功能的經典分子之一,能夠大量消耗精氨酸,然而精氨酸是T細胞活化和發揮免疫功能所必需的氨基酸,G-MDSCs細胞內高表達的精氨酸酶將環境中的精氨酸耗竭后,導致T細胞無法活化,從而抗腫瘤活性下降[18]。本研究結果表明,自噬不僅有利于G-MDSCs細胞體外存活,還可能通過上調效應分子精氨酸酶來抑制T細胞功能,從而提示自噬參與了MDSCs促進腫瘤發展的這一過程。由此表明,可以通過調控細胞自噬減少腫瘤患者體內這群發揮抑制腫瘤免疫的細胞,進而促進機體抗腫瘤免疫,提高免疫治療的效果。盡管很多研究均表明可能自噬與MDSCs功能的相關,但是該途徑的直接作用以及與自噬在MDSCs介導的抗腫瘤抑制中發揮作用的具體分子機制并不十分明確,需要進一步研究。
MDSCs于2007年首次被描述為新的治療藥物[3],直到2016年,人們才意識到MDSCs在免疫療法中的重要作用[3],學者開始研究消除MDSCs的方法。這種消除MDSCs的免疫治療手段已經在患者身上發揮一定療效[19]。
多種病理條件下,MDSCs在負向調節免疫應答中發揮重要作用。與調節性T細胞不同,MDSCs在機體的生理條件下并不存在,這有可能靶向這群細胞進行治療的同時避免一些不良反應。對調控MDSCs聚集以及功能的機制進行深入研究,可以促進更加精確地進行靶向治療。自噬很可能是一個很好的減少MDSCs聚集的切入點,隨著對這個領域研究的不斷深入,作為一種潛在的新的細胞治療手段,MDSCs在腫瘤以及免疫相關疾病治療中將會得到越來越廣泛的應用。

