強化谷氨酰胺及合生元的腸內營養對結腸炎新生小鼠Treg/Th17免疫平衡的影響①
豐 暖 朱 艷 霍圓圓 王建新 滕 倩
(青島市婦女兒童醫院營養科,青島 266000)
常見于消化科的炎癥性腸病(inflammatory bowel disease,IBD)是一種累及結腸、直腸,并且容易反復發作的慢性疾病[1]。目前該病的發病機制尚未完全闡明,Li等[2]研究顯示結腸黏膜的免疫功能異常在IBD患者延綿反復的炎癥應激中發揮重要作用。調節性 T 細胞(regulatory T, Treg)是具有獨特免疫調節功能的淋巴細胞,在叉狀頭/翅膀狀螺旋轉錄因子3(forkhead winged-helix transcription factor,Foxp3)的誘導下,分泌TGF-β1、IL-10等因子以減弱、抑制或終止炎癥應激的進展,Th17細胞是具有強烈促炎效應的淋巴細胞,能夠分泌IL-17、IL-23等促炎因子,活化轉錄因子維甲酸相關核孤兒受體γt(retinoic acid-related nuclear orphan receptor γt,RORγt)傳遞炎癥信號,誘導多種慢性炎癥性疾病的發展[3]。張慧儉等[4]研究顯示Treg/Th17免疫失衡與結腸炎癥性損傷關系密切。程序性死亡分子-1(programmed death-1,PD-1)及其主要配體(programmed death-1 ligand,PD-L1)信號通絡是機體內重要的與免疫調節相關的通路。Cassol等[5]研究證實PD-1抑制劑能明顯改善潰瘍性大鼠腸道的炎癥應激。但未見有PD-1/PD-L1信號在結腸炎腸黏膜Treg/Th17免疫平衡中的報道。國內外的諸多專家一致認為強化谷氨酰胺的腸內營養是針對IBD患者恢復免疫調節的首選治療方法[6]。谷氨酰胺是腸黏膜修復的重要營養物質,腸道黏膜修復過程中對谷氨酰胺的需求量加大,若不能及時補充,IBD患者的腸道黏膜結構將難以恢復。本研究通過葡聚糖硫酸鈉(dextran sulfate sodium,DSS)誘導小鼠IBD 模型,從PD-1/PD-L1信號入手,探討強化谷氨酰胺及合生元的腸內營養對IBD小鼠Treg/Th17免疫平衡的調節,為臨床上結腸炎的治療提供新的思路。
1 材料與方法
1.1材料
1.1.1實驗動物 7~8周齡的SPF級BALB/c雄性小鼠共計60只,體質量(18.33±0.63)g,購自北京維通達生物技術有限公司,動物使用許可證號: SYXK(京)2019-0025;實驗動物按照本院動物管理規定適應性喂養1周后進行實驗。
1.1.2主要試劑和儀器 百普素(125 g/袋,德國Milupa GmbH公司,批準文號:H20170170);復方谷氨酰胺腸溶膠囊(24 s/盒,地奧集團成都藥業股份有限公司,國藥準字H51023598);合生元粉劑(5 g/袋,西安力邦臨床營養有限公司);PD-L1 Fc 融合蛋白(1 mg/袋,美國Chimerigen公司);蘇木精-伊紅(hematoxylin eosin,HE)試劑盒購自Sigma公司;免疫組化試劑盒購自美國Selleck公司;Western blot試劑盒購自美國PALL公司;冰凍切片包埋劑購自美國櫻花公司;PBS緩沖液購自美國Abcam公司;蘇凈Airtech超凈工作臺(北京六一儀器廠);LEICAEG1150組織包埋機(德國Leica公司);Nikon Ti-U/Ti-s熒光顯微鏡(日本三菱公司);5810R 型高速離心機(日本島津公司);流式細胞儀(美國Beckma公司)。
1.2方法
1.2.1實驗性結腸炎小鼠模型的構建 適應性喂養1周后,按照隨機數字表法將小鼠分為正常組(Normal,Nor)、模型組(Model,Mod)、對照組(Control,Con)和實驗組(Experiment,Exp)。Nor組小鼠每天自由飲用純凈水,Mod組、Con組、Exp組每天自由飲用含5% DSS的純凈水,連續2周后,模型小鼠出現大便稀軟、黏液血便、腹部腫大以及厭食等現象,視為造模成功[7]。
1.2.2分組喂養 將25 g百普素(短肽型腸內營養制劑)溶于100 ml純凈水,制成百普素混懸液。將1 mg PD-L1 Fc 融合蛋白溶于1 ml無菌超純水。Nor組、Mod組小鼠始終以基礎飼料連續喂養,Con組小鼠以基礎飼料添加1 mg/kg的PD-L1 Fc 融合蛋白,Exp組小鼠以基礎飼料添加100 ml/kg百普素、0.5 g/kg谷氨酰胺和0.5 g/kg合生元,于標準飼養房飼養14 d[8]。
1.2.3各組小鼠在造模過程中疾病活動指數評分 造模開始后每天記錄各組小鼠的一般狀態、體質量以及大便情況,進行疾病活動指數(disease activity index,DAI)評分,評分標準如下:體質量下降情況:無體質量下降記為0分,體質量下降1%~5%記為1分,體質量下降6%~10%記為2分,體質量下降11%~15%記為3分,體質量下降15%以上記為4分;大便情況:正常記為0分,松散記為1分,稀便記為3分;無血便記為0分,隱血便記為2分,肉眼可見血便記為4分;3項目積分的總和除以3即為DAI評分[9]。
1.2.4各組小鼠血清指標的測定 連續喂養7 d后,小鼠經腹靜脈采血5 ml,離心取血清,立即轉入-80℃低溫冰箱保存。在1周內嚴格按照試劑盒要求檢測TGF-β1、IL-17含量。
1.2.5各組小鼠的結腸形態觀察以及形態損傷比較 采血完畢后,處死動物,無菌剝離小鼠的結腸組織,對比各組小鼠的結腸長度,將結腸縱向剖開后,肉眼觀察各組小鼠結腸黏膜增生、糜爛情況。根據結腸黏膜組織損傷(colon macroscopic damage index, CMDI)對各組小鼠的結腸進行評分,標準如下:大體形態無損傷記為0 分;結腸表面光滑但有輕度充血、水腫,無糜爛點記為1 分;結腸黏膜粗糙,充血水腫,多處糜爛或黏連記為2 分;結腸黏膜出現壞死點,多處潰瘍,腸壁增厚以及炎癥明顯,但潰瘍縱徑最大在1 cm以內,充血水腫嚴重,記為3 分;全腸壁壞死嚴重,黏膜壞死,結腸黏膜多處出血點,潰瘍縱徑最大大于1 cm,記為4 分。觀察完畢后將各組小鼠的結腸組織迅速轉移到惰性氣體罐中,-80℃低溫冰箱獨立保存待測[10]。
1.2.6HE染色觀察各組小鼠結腸組織病理改變 取出長度約0.5 cm的結腸組織標本,以多聚甲醛固定,石蠟包埋,切片,HE 染色,觀察各組小鼠結腸組織的病理改變。
1.2.7免疫組化檢測各組小鼠結腸組織中RORγt和Foxp3表達 取出長度約0.5 cm的結腸組織標本,以10%中性甲醛固定,包埋,切片,脫蠟,去除內源性過氧化物酶,PBS修復抗原,加入一抗(1∶100)4℃孵育過夜,次日加入二抗(1∶500)室溫孵育,DAB顯色,蘇木素復染,乙醇梯度脫水,二甲苯浸泡,中性樹膠封片,鏡檢觀察并記錄實驗結果;用圖像分析軟件系統分析RORγt和Foxp3的陽性細胞比例。
1.2.8流式細胞術檢測各組血清中Treg、Th17細胞變化 取出各組小鼠部分血清,采用機械方法獲取單個核細胞懸液并稀釋,流式細胞術測定結腸組織中Treg、Th17的計數變化。
1.2.9Western blot檢測各組小鼠結腸組織中PD-1、PD-L1蛋白表達 取出長度約0.5 cm的結腸組織標本,組織勻漿后,常規提取目標蛋白PD-1、PD-L1,并測定其濃度,準確量取50 μg目的蛋白進行電泳分離,轉膜,封閉,稀釋(1∶1 500),低溫孵育過夜,加入二抗孵育3 h, 顯色,封片后,凝膠成像系統采集圖像(GAPDH作為內參)[11]。

2 結果
2.1各組小鼠造模過程大體觀察以及疾病活動度評分 在實驗過程中,Nor組小鼠的生長狀況良好,飲食積極,活潑機警,皮毛光亮順滑,排泄規律,大便成形,肛周未見明顯的附著物;Mod組小鼠從造模第1天開始出現活動量減少、大便次數增多現象,逐漸出現腹瀉、軟便、精神萎靡等現象,肛周黏便附著明顯,后期小鼠厭食明顯、皮毛粗糙、暗淡無光、喜好蜷縮扎堆,活動量明顯減少。Con組和Exp組小鼠的癥狀較Mod組明顯改善,小鼠肛周較為干凈,皮毛較為規整,光滑度明顯好轉,實驗后期飲食量明顯回升。與Nor組相比,Mod組小鼠DAI評分明顯升高(P<0.05),與Mod組相比,Exp組和Con組的DAI評分明顯降低(P<0.05),Exp組和Con組評分差異無統計學意義(P>0.05),見圖1。
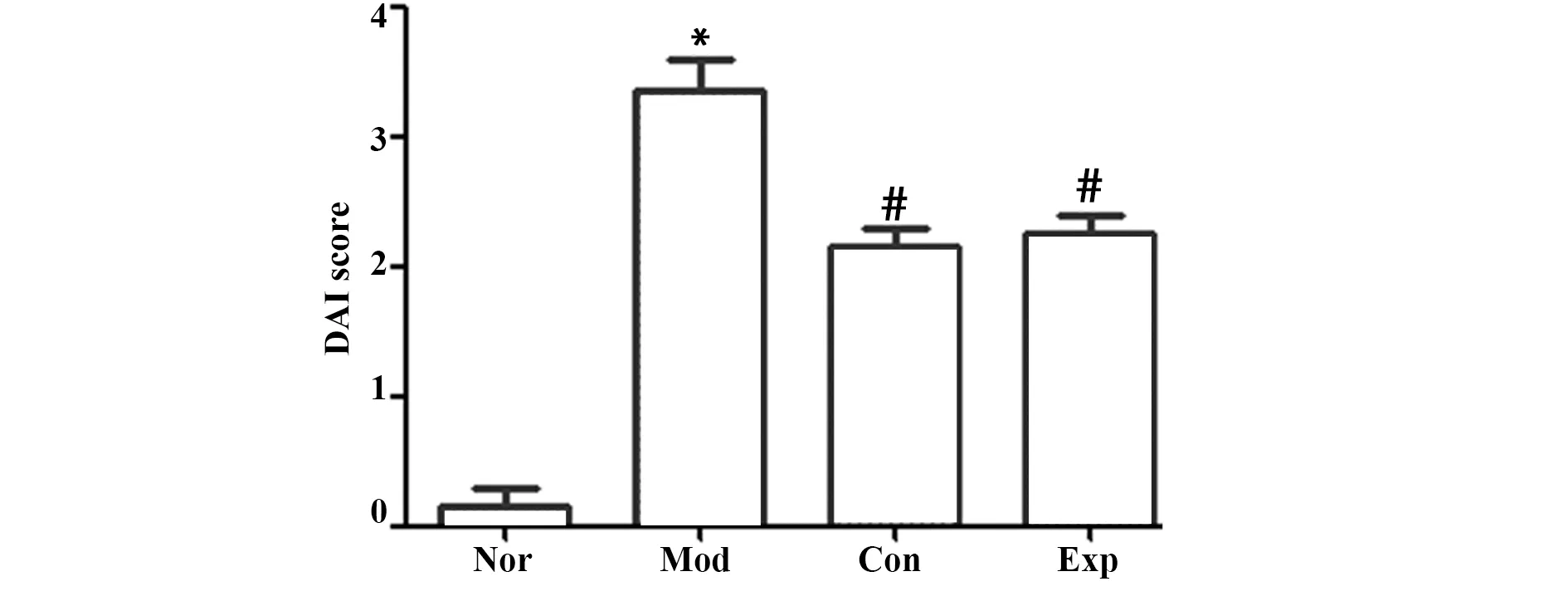
圖1 各組小鼠疾病活動度比較情況Fig.1 Comparison of disease activity of mice in each groupNote:Compared with Nor group,*.P<0.05;compared with Mod group,#.P<0.05.
2.2各組小鼠結腸組織形態比較 Nor組小鼠的結腸細長且彈性良好,未見明顯病變。Mod組小鼠結腸明顯變短,黏膜充血、糜爛明顯,腸壁脆性增加,表面有多個出血點,Exp組和Con組小鼠結腸炎癥較Mod組明顯改善。與Nor組相比,Mod組小鼠CMDI評分明顯升高,結腸長度明顯變短(P<0.05),與Mod組相比,Exp組和Con組CMDI評分明顯降低,結腸長度明顯增長(P<0.05),Exp組和Con組差異無統計學意義(P>0.05),見圖2。

圖2 各組小鼠結腸組織形態、黏膜損傷以及結腸長度比較Fig.2 Comparison of colon tissue morphology,mucosal injury and colon length of mice in each groupNote:Compared with Nor group,*.P<0.05;compared with Mod group,#.P<0.05.
2.3各組小鼠的結腸組織病理學變化 HE 染色結果顯示,Nor組小鼠結腸組織黏膜結構完整,細胞排列規整,杯狀細胞形態正常, 未見潰瘍、炎癥浸潤等現象。Mod組小鼠結腸組織杯狀細胞數量明顯減少,黏膜上皮細胞脫落、壞死明顯,基膜成片裸露,可見潰瘍點,黏膜細胞水腫明顯,大量炎癥細胞浸潤,細胞核明顯增大;Exp組和Con組內結腸組織黏膜上皮病理損傷明顯緩解,杯狀細胞雖有少量變形,但黏膜區域的炎癥細胞浸潤明顯減少,見圖3。
2.4各組小鼠血清學指標 試劑盒檢測結果顯示,與Nor組相比,Mod組小鼠血清中TGF-β1含量明顯降低,IL-17含量明顯升高(P<0.05);與Mod組相比,Exp組和Con組小鼠血清中TGF-β1含量明顯升高, IL-17含量明顯降低(P<0.05),Exp組和Con組差異無統計學意義(P>0.05),見圖4。
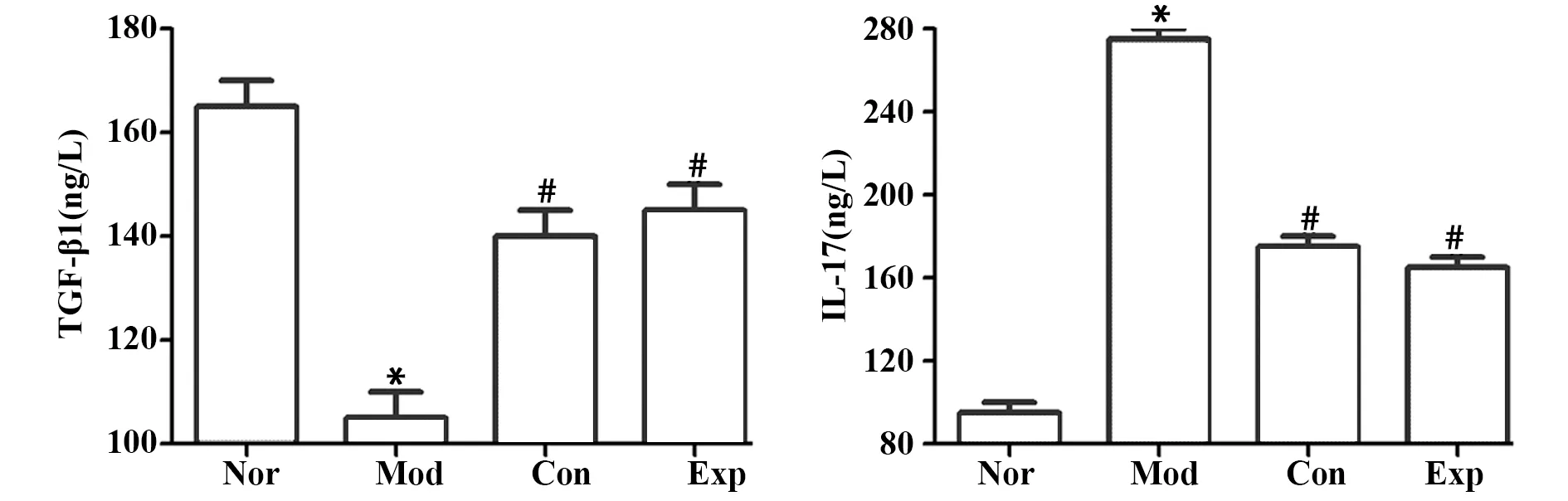
圖4 各組小鼠血清中TGF-β1、IL-17的含量Fig.4 Contents of TGF-β1 and IL-17 in serum of mice in each groupNote:Compared with Nor group,*.P<0.05;compared with Mod group,#.P<0.05.
2.5免疫組化檢測各組小鼠結腸組織中RORγt、Foxp3的表達 免疫組化顯示,與Nor組相比,Mod組小鼠結腸組織中的RORγt陽性細胞比例明顯升高,Foxp3陽性細胞比例明顯降低(P<0.05),與Mod組相比,Exp組和Con組小鼠結腸組織中RORγt陽性細胞比例明顯降低,Foxp3陽性細胞比例明顯升高(P<0.05),Exp組和Con組差異無統計學意義(P>0.05),見圖5。
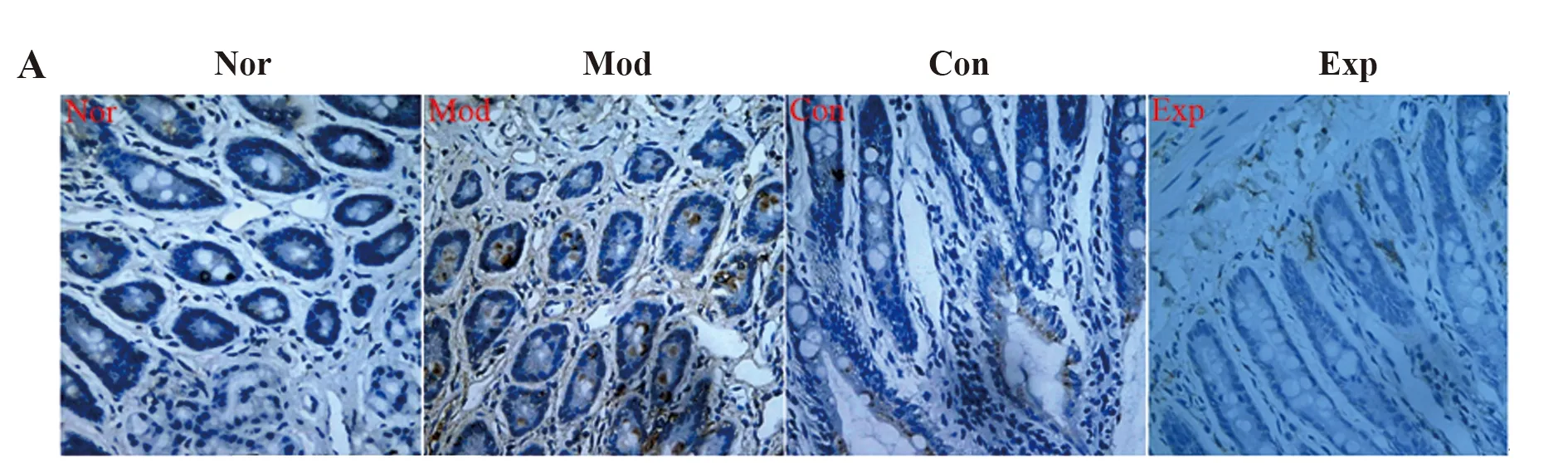
圖5 各組小鼠結腸組織中RORγt和Foxp3的表達(×400)Fig.5 Expressions of RORγt and Foxp3 in colon tissue of each group of mice (×400)Note:A.RORγt;B.Foxp3.Compared with Nor group,*.P<0.05;compared with Mod group,#.P<0.05.
2.6流式細胞術檢測各組小鼠血清中Treg、Th17細胞變化 流式細胞術結果顯示,與Nor組相比,Mod組小鼠外周血中Th17細胞占CD4T細胞的比例明顯升高,Treg細胞比例明顯下降(P<0.05),與Mod組相比,Exp組和Con組小鼠外周血中Th17細胞占CD4T細胞的比例明顯下降, Treg細胞比例明顯升高(P<0.05),Exp組和Con組比例差異無統計學意義(P>0.05),見圖6。
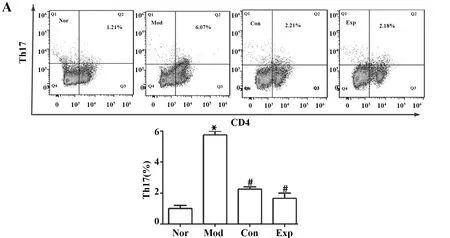
圖6 各組小鼠外周血中Th17及Treg細胞比例的變化Fig.6 Percentage changes of Th17 and Treg cells in peripheral blood of mice in each groupNote:A.Th17;B.Treg.Compared with Nor group,*.P<0.05;compared with Mod group,#.P<0.05.
2.7Western blot檢測各組小鼠結腸組織中PD-1、PD-L1蛋白的表達 Western blot結果顯示,與Nor組相比,Mod組小鼠結腸組織中PD-1、PD-L1蛋白表達均明顯升高(P<0.05), 與Mod組相比, Exp組和Con組小鼠結腸組織中PD-1、PD-L1蛋白表達明顯降低(P<0.05),Exp組和Con組相比,差異無統計學意義(P>0.05),見圖7。

圖7 各組小鼠結腸組織中PD-1、PD-L1蛋白的表達Fig.7 Expressions of PD-1 and PD-L1 protein in colon tissue of each group of miceNote:Compared with Nor group,*.P<0.05;compared with Mod group,#.P<0.05.
3 討論
在臨床上IBD主要表現為腹瀉、腹痛、黏血便、膿血便以及肛周病變,該病主要的并發癥為腸穿孔、腸梗阻、肛瘺以及感染性休克、結腸癌變等,現有的治療手段已陷入瓶頸期,雖能較好地控制IBD的癥狀, 但是未能改善患者的免疫功能,且在服用西藥過程中的不良反應及疾病的反復發作給患者帶來沉重的心理壓力和經濟負擔[12,13]。因此臨床上迫切需要一種既能控制炎癥發展,又能提高患者免疫功能的治療方法。腸內營養支持是臨床上改善IBD患者免疫紊亂的首選治療手段。但單一的腸內營養支持無法阻止患者的腸黏膜萎縮,改善患者腸黏膜的免疫功能[14]。因此在此基礎上探討合適的腸內營養方式,減小病癥對患者腸道黏膜的損傷在臨床上意義重大。
臨床癥狀的改善是衡量IBD治療效果的關鍵指標。Adamina等[15]研究報道強化谷氨酰胺以及合生元的腸內營養支持對IBD治療的安全性以及有效性存在較大的爭議。本研究中Exp組動物經該手段干預14 d后,小鼠日常行為較Mod組明顯改善,疾病活動度明顯降低,結腸黏膜損傷CMDI明顯降低,結腸長度有所恢復,結腸組織損傷明顯改善,證實了該治療方式良好的療效。
Liu等[16]研究指出,Treg/Th17免疫平衡軸異常是腸道黏膜免疫功能紊亂的關鍵因素,同時也是腸黏膜炎癥性應激發生、發展的重要病理基礎。作為一種新型的CD4T細胞亞群,Treg細胞和Th17細胞主要分布在機體的脾臟和外周血中。研究表明Treg和Th17細胞在機體內相互制約,相互抑制,維系腸道黏膜的免疫平衡。特異性表達Foxp3的Treg細胞介導分泌抗炎分子TGF-β1、IL-10等,具有正向的免疫調節功能,增強腸道黏膜的免疫耐受能力[17]。在RORγt的調控下分泌IL-17的Th17細胞主要增強促炎細胞因子、趨化因子和黏附因子的表達,推動炎癥應激的發展。Guo等[18]研究表明上調外周血中Treg百分比,下調Th17細胞百分比,有利于Treg/Th17免疫平衡的穩態,改善IBD大鼠的腸道黏膜損傷。Yao等[19]研究證實調控Treg/Th17的免疫平衡能明顯抑制IBD小鼠的炎癥應激,改善其腸道黏膜功能。本研究中Mod組小鼠的Treg/Th17軸明顯失去穩態,與之相比,Exp組小鼠的血清中TGF-β1含量、結腸組織中Foxp3、外周血中Treg比例明顯升高, 血清中IL-17含量、結腸組織中RORγt、外周血中Th17細胞明顯降低,說明經強化谷氨酰胺以及合生元的腸內營養支持干預后,Exp組小鼠的Treg/Th17趨于平衡。
大量動物及臨床研究表明PD-1/PD-L1信號與IBD的發生、惡性進展關系密切[20]。Zhou等[21]研究表明在急性結腸炎小鼠中,抑制PD-1/PD-L1信號表達能明顯改善實驗動物的結腸黏膜Treg/Th17免疫失衡的狀態,增強實驗動物的免疫耐受能力。Yang等[22]研究證實PD-1/PD-L1信號通路能明顯改善小鼠由DSS誘導的結腸炎癥狀,下調其結腸組織中炎癥因子表達。Phatak等[23]研究指出在兒童結腸炎的診斷中,PD-1/PD-L1免疫抑制劑具有方便、快捷、減少疼痛等諸多優勢,具有良好的臨床應用前景。Song等[24]研究證實PD-L1 Fc融合蛋白能阻斷結腸炎小鼠的PD-1/PD-L1信號,抑制Th17活性,發揮其對結腸黏膜的保護作用。本研究采用PD-L1 Fc融合蛋白作為對照,結果表明Con組小鼠的觀察指標與Exp組小鼠的差異無統計學意義,推測強化谷氨酰胺以及合生元的腸內營養支持可能通過抑制PD-1/PD-L1信號來調控實驗性結腸炎小鼠Treg/Th17的免疫平衡,發揮其對結腸黏膜的保護作用。但是如何將這一治療手段應用到結腸炎的臨床治療中還需更深入、系統的研究。

