副溶血弧菌TDH快速免疫膠體金檢測板的研制①
楊靖亞 方 艷 陸曉帆 張 建 趙 勇
(上海海洋大學食品學院,農業部水產品貯藏保鮮質量安全風險評估實驗室,上海 201306)
副溶血弧菌是革蘭氏陰性嗜鹽菌,存在于沿海棲息地和河口,是導致日本海產品相關胃腸炎的主要原因[1,2]。副溶血弧菌是人類病原體,可引起胃腸炎、傷口感染和敗血癥[3]。毒性副溶血弧菌菌株通常產生熱穩定的直接溶血素(thermostable direct hemolysin,TDH)和/或TDH相關溶血素(TRH),被認為是物種致病性分子標記[4-7]。TDH可引起Wagatsuma瓊脂培養基中稱為神奈川現象(Kanagawa phenomenon,KP)的β型溶血,大部分臨床分離株均為KP陽性[8,9]。
現已開發了副溶血弧菌的多重PCR檢測方法,同時使用物種特異性基因和毒素基因用于毒性特異性檢測和非毒性副溶血菌株檢測,但靈敏度和特異性不高,經常出現假陽性和假陰性結果[10-14]。因此相繼開發了針對TDH的新型檢測方法,如質譜-脈沖電泳-PCR連用技術、斑點ELISA方法、CPA-核酸試紙條法,但具有耗時、成本昂貴等缺陷[15-17]。目前急需一種便捷、經濟、快速的檢測方法以滿足市場需求。向輝等[18]研發了新型納米標記免疫層析技術,但待測樣本的前處理較為繁瑣。
膠體金試紙條檢測法是一項發展迅速的新型檢測手段,使用便捷、檢測速度、靈敏度高、特異性強,但目前國內對于將膠體金技術用于副溶血弧菌TDH的快速檢測鮮有報道[19]。本研究旨在研制針對副溶血弧菌TDH快速檢測的快速免疫膠體金檢測板,以滿足大批量樣品快速高效檢測的需要。
1 材料與方法
1.1材料 副溶血弧菌(ATCC33846)、沙門氏菌、大腸桿菌、單核細胞增多性李斯特菌(上海海洋大學食品安全實驗室惠贈),抗TDH單克隆抗體T6D4、T9H4和毒素TDH(本實驗室純化制備),氯金酸(HAuCl4,Sigma公司),牛血清蛋白、Tween 20 (上海正極生物有限公司),Tris、sucrose (上海生工生物有限公司),Whatman AE99、Pall Vivid 170、Sartorius CN140、Millipore 135 硝酸纖維素膜(上海杰一生物科技有限公司)。
1.2方法
1.2.1制備膠體金溶液 參考文獻[20],將待用玻璃器皿洗凈、浸泡于5%二氯二甲基硅烷的氯仿溶液中,超純水沖凈干燥。100 ml 0.01% HAuCl4置于恒溫磁力攪拌器煮沸,迅速加入1.2 ml新鮮配制的1% 檸檬酸三鈉持續加熱,不斷攪拌至液體顏色轉變為酒紅色并繼續煮沸10 min。待膠體金溶液冷卻至室溫后補充超純水至100 ml,收集于棕色玻璃瓶并置于4℃冰箱中備用。
1.2.2膠體金-抗體復合溶液制備 磁力攪拌器室溫勻速攪拌60 min,使膠體金溶液中的金顆粒與待標記TDH單克隆抗體T6D4充分吸附平衡,加入10% BSA 0.01 mol/L PBS(pH7.4),封閉處理金顆粒上未結合單克隆抗體的結合位點,使復合物溶液中BSA終濃度為1%,室溫勻速繼續攪拌60 min,13 000 r/min 離心60 min,去上清,加入2 ml 0.01 mol/L PBS(pH7.4)保存液重懸沉淀,4℃保存備用。
1.2.3膠體金顆粒與待標記抗體的標記試驗 選擇單克隆抗體T6D4作為捕獲抗體與膠體金顆粒標記,制備膠體金-抗體的復合物溶液。加入0.1 mol/L K2CO3調整膠體金溶液pH值,設置pH為 6.0、6.5、7.0、7.5、8.0、8.5、9.0,每試管膠體金溶液中分別加入0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0 μl 1 mg/ml的待標記單克隆抗體T6D4,充分混勻后室溫靜置30 min,每管添加100 μl 10% NaCl溶液觀察溶液顏色,進行pH和抗體標記量優化。
1.2.4金標溶液最佳釋放條件的優化 設置不同蔗糖濃度的金標溶液稀釋液和不同濃度Tween 20樣品墊預處理液。分別為1%、3%、5%蔗糖的1%BSA 0.01 mol/L PBS(pH7.4);含0.5%、1%、2%Tween 20的0.01 mol/L PBS(pH7.4)。
1.2.5假陽性消減試驗 選用2 mg/ml濃度羊抗小鼠的抗體包被試紙條上的C線作為質控線;選用2 mg/ml的T9H4單抗包被試紙條上的T線,作為檢測線;選用含5% sucrose的1% BSA 0.01 mol/L PBS(pH7.4)溶液以1∶1含稀釋金標抗體溶液包被金標墊。為防止假陽性結果,在洗滌液中加入一定量鹽離子,分別設置含0.1%、0.2%、0.3%、0.4% NaCl的1% Tween 20 0.01 mol/L PBS(pH7.4)洗滌液,檢測空白樣本,得到最佳鹽離子濃度,進一步優化檢測體系。
1.2.6NC膜上檢測抗體T9H4的稀釋緩沖液及檢測濃度的優化 稀釋溶液的pH值會對檢測結果的顯色造成影響,分別選用pH7.0、7.4、8.0的3種0.01 mol/L PBS溶解檢測抗體T9H4,點于NC膜上。選定最佳檢測抗體溶解液后,分別設置0.5、1.0、1.5 mg/ml濃度的檢測抗體T9H4,點于T線,以期尋找出最佳檢測濃度。
1.2.7不同型號NC膜的比較 選擇Whatman AE99、Pall Vivid 170、Sartorius CN140、Millipore 135硝酸纖維素膜4種硝酸纖維素膜進行組裝,檢測結果。
1.2.8快速免疫膠體金檢測板的組裝及使用 試紙條PVC底板用切條機裁剪為8.0 cm×0.5 cm,依次將NC膜、吸水墊、金標結合墊、樣品墊黏附于PVC膠板;其中金標結合墊為單克隆抗體T6H4標記的膠體金溶液,NC膜的檢測線為單克隆抗體T9H4、質控線C線上采用羊抗小鼠抗體,37℃恒溫條件下干燥60 min后組裝。
1.2.9快速免疫膠體金檢測板的靈敏度檢測 在最佳檢測體系下分別檢測不同稀釋度的TDH,分析所制備的快速免疫膠體金檢測板的最低檢測限。
1.2.10快速免疫膠體金檢測板的特異性檢測 37℃、180 r/min下,對副溶血弧菌(含TDH)、沙門氏菌、大腸桿菌、單核細胞增多性李斯特菌和非致病性副溶血弧菌F188菌株進行液體增菌搖床培養24 h,8 000 r/min離心10 min,取上清作為陰性檢測樣本和TDH陽性樣本(2 μg/ml)檢測結果比對,確定所制備的快速免疫膠體金檢測板對TDH檢測的特異性。
2 結果
2.1膠體金溶液質量分析 檸檬酸三鈉還原法制備溶液,紫外可見分光光度法測定400~700 nm處膠體金溶液吸光度,在527 nm處出現最大吸收峰,對應金顆粒大小約為40 nm,吸收曲線平滑、峰值單一、峰谷較窄,由此推斷所制備的40 nm金顆粒大小的膠體金溶液不含雜質,顆粒大小均勻,見圖1。
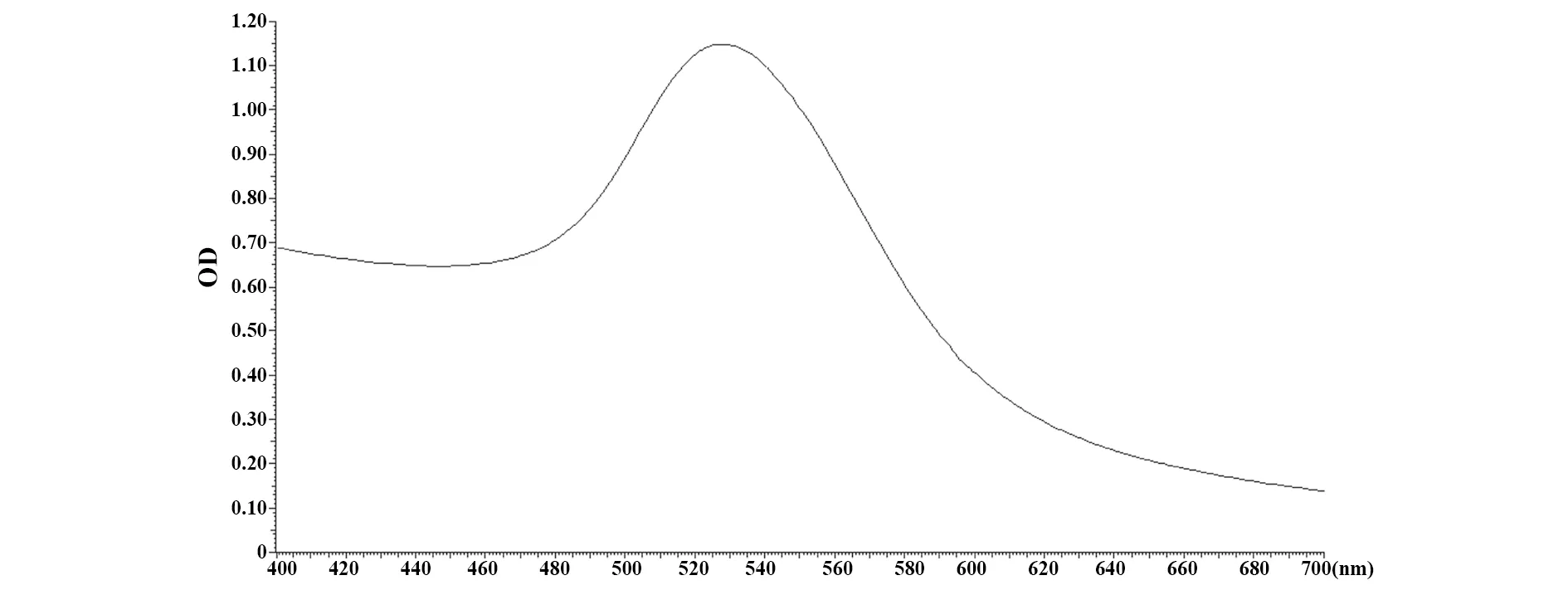
圖1 納米膠體金顆粒的全波長掃描Fig.1 Full wavelength scaning for nanogold
2.2抗體與金顆粒的標記結果 pH=8.0時,抗體T6D4可與40 nm大小的金顆粒穩定結合,即在加入10%NaCl后,溶液平衡不受外界離子破壞,溶液仍保持酒紅色,2 μg/ml的金溶液呈抗體最佳結合量,見圖2。

圖2 最佳抗體標記量分析Fig.2 Analysis of optimal antibody labeling quantity
2.3金標溶液最佳釋放條件 8號試紙條的金標墊完全呈白色,表明金標墊上的金標抗體溶液具有高復溶性及強釋放率,因此選定樣品墊采用含2%Tween 20的0.01 mol/L PBS(pH7.4)處理,金標墊用含3% sucrose 1% BSA 0.01 mol/L PBS(pH7.4)處理,作為初始溶液體系用于后續研究,見圖3。

圖3 金標溶液的最佳釋放條件Fig.3 Best condition on release of gold-labled solutionNote:1.1% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 0.5% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);2.3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 0.5% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);3.5% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 0.5% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);4.1% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 1% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);5.3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 1% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);6.5% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 1% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);7.1% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 2% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);8.3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 2% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);9.5% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 2% Tween 20 0.01 mol/L pH7.4 PBS (sample pad).
2.4假陽性消減試驗分析 NaCl含量為0.1%~0.4%時假陽性結果的消減呈現劑量依賴性。
2.5NC膜上檢測抗體T9H4的稀釋緩沖液及最適檢測濃度的確定 以1 μg/ml的TDH陽性樣本進行檢測,當選用pH7.4時的0.01 mol/L PBS作為T9H4的包被溶液時,顯色性較好。在選定最佳檢測抗體包被液后,以1 μg/ml的TDH陽性樣本進行檢測,當包被濃度達到1 mg/ml后,結果顯色性基本保持不變,均呈現良好的陽性結果,因此最終選定最佳T線抗體包被濃度為1 mg/ml,見圖4。

圖4 快速免疫膠體金檢測板最低檢測限分析Fig.4 Analysis of minimum detection limit of immunochromatographic test strips
2.6NC膜型號的選擇 對于同樣檢測500 ng/ml的TDH陽性樣本,4款膜的陽性結果顯色效果中,Sartorius CN140表現最佳且檢測結果重復性好,雖然Sartorius CN140的跑水速度較慢,但金標抗體溶液在膜上的跑動效果最好。因此,選定Sartorius CN140硝酸纖維素膜作為本次實驗的膠體金檢測板,見圖5。

圖5 快速免疫膠體金檢測板的特異性分析Fig.5 Specificity analysis of immunochromatographic test stripNote:A.E.coli;B.Salmonella;C.Listeria monocytogenes;D.F188;E.ATCC33846(TDH).
3 討論
研究表明TDH具有呈劑量和時間依賴性的肝毒性和非常迅速的致死效應[21,22]。快速便捷地進行TDH檢測對于預防和監控TDH相關疾病具有重要意義。傳統TDH檢測技術包括常規分離培養、電化學法等,但檢測時間較長、特異性較差。PCR檢測需要昂貴的檢測儀器以及專業的操作人員。隨著檢測方法的不斷深入,近年來更多的學者傾向于利用免疫效應開發新型檢測手段[23,24]。
本實驗利用2株TDH單克隆抗體成功地制備了能夠特異性檢測副溶血弧菌TDH的快速免疫膠體金檢測板,樣品墊采用2% Tween 20 0.01 mol/L pH7.4 PBS處理、金標墊采用3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS處理,所得金標抗體溶液復溶性高,釋放率強。選用pH7.4時的0.01 mol/L PBS作為T9H4的包被溶液時,顯色性較好,確定最佳T線抗體包被濃度為1 mg/ml。人工組裝的快速免疫膠體金檢測板檢測限為500 ng/ml,且具有較強特異性。
目前國內對于將膠體金技術用于副溶血弧菌TDH的快速檢測鮮有報道,本實驗所得的快速免疫膠體金檢測板顯著降低了樣品的前處理要求,可在5 min 內完成檢測,顯著縮短了檢測時間,本研究為副溶血弧菌TDH的現場、快速、簡單、無需設備的檢測提供了新的手段。

