β-AR信號通路介導去甲腎上腺素提高HT-29細胞侵襲能力的研究
趙 璐 倪依群 尤建良
慢性心理應激能促進惡性腫瘤的進展,在應激狀態下,機體釋放大量腎上腺素(epinephrine,E)、去甲腎上腺素(norepinephrine,NE)、皮質醇等激素至外周血中。其中,去甲腎上腺素作為一種經典的神經遞質,能提高腫瘤細胞的遷移和侵襲能力,通過β-腎上腺素能受體(β-adrenergic receptor,β-AR)信號通路使腫瘤的生物學行為和腫瘤所處的微環境發生改變[1~3]。一方面促進血管內皮生長因子(vascular endothelial growth factor,VEGF)、白細胞介素-6(interleukin-6,IL-6)和基質金屬蛋白酶(matrix metalloproteinases,MMPs)等物質的生成,提高腫瘤細胞遷移和侵襲能力,另一方面抑制機體的免疫反應,降低自然殺傷細胞(natural killer, NK)及T細胞等免疫細胞活性,最終促進腫瘤的進展。本研究旨在觀察去甲腎上腺素通過β-AR信號通路對人結腸癌細胞株HT-29侵襲能力的影響及可能的作用機制。
材料與方法
1.主要材料與試劑:人結腸癌HT-29細胞株(ATCC);McCoy′s 5A培養基、胎牛血清(美國Gibco公司);去甲腎上腺素標準品、普萘洛爾標準品(美國Sigma公司);CCK-8試劑盒(中國碧云天生物公司);Matrigel基質膠、Transwell(8μm)小室(美國BD公司);鼠抗人MMP-2(ab86607)、MMP-9(ab58803)、VEGF(ab69479)單克隆抗體(美國Abcam公司);ERK1/2(4696)、p-ERK1/2(4370)單克隆抗體(美國CST公司);反轉錄實時熒光定量PCR試劑盒(日本TaKaRa公司);PCR引物由華大基因合成,引物序列詳見表1。

表1 引物序列
2.細胞培養:HT-29細胞用含10%胎牛血清的McCoy′s 5A培養基在37℃、5%CO2培養箱中培養,0.25%胰酶常規消化傳代。
3.細胞增殖能力檢測實驗:采用CCK-8法,收集對數生長期的細胞,以1.0×105個/毫升按每孔100μl 接種于96孔板,培養細胞融合至50%~60%,隨機分為空白組和去甲腎上腺素組(0.1、1、10、100μmol/L),每組設3個復孔。棄去培養基,空白組加入含10%血清培養基200μl,各去甲腎上腺素組加入含相應藥物濃度的含10%血清培養基200μl。37℃、5%CO2、飽和濕度條件下分別培養24及48h后加入CCK-8試劑20μl,繼續避光培養2h。使用酶標儀于450nm波長處測定各孔吸光值,計算細胞存活率:存活率=(空白組平均A值-藥物組平均A值)/空白組平均A值×100%。
4.Transwell侵襲實驗:50mg/L Martigel基質膠以1∶8稀釋包被Transwell小室上室面,4℃風干后吸棄小室中殘余液體,每孔加入50μl含10g/L 牛血清白蛋白(BSA)的無血清培養基,37℃孵育30min。取對數生長期細胞,以無血清培養基饑餓12h后消化制成單細胞懸液,調整細胞濃度為1×105/ml,取200μl接種于包被及水化后的Transwell上室,分別加入無血清培養基、含0.1μmol/L去甲腎上腺素、1μmol/L去甲腎上腺素、10μmol/L去甲腎上腺素的McCoy′s 5A培養基。下室均加入500μl 含10%血清培養基,置于37℃、5%CO2培養箱中培養。48h后取出Transwell小室,用棉簽擦去上室的細胞,PBS液沖洗3次,4%多聚甲醛固定15min,4g/L結晶紫溶液染色。顯微鏡下觀察并計算穿膜細胞數。結果判定:200倍鏡下計算5個視野的穿膜細胞數,取均值,并計算細胞的侵襲率。侵襲率=實驗組細胞數/對照組細胞數×100%。
5.反轉錄實時定量PCR:藥物干預48h后,TRIzol提取各組細胞中的總RNA,采用SYBR GreenERTMqPCR SuperMix Universal檢測細胞中MMP-2、MMP-9和VEGF mRNA的表達情況,以GAPDH作為內參基因。采用SuperScriptTMⅢ First-Strand Synthesis SuperMix for qRT-PCR反轉錄試劑盒合成cDNA,反轉錄條件為:50℃ 30min,85℃ 5min,37℃ 20min,產物-20℃保存備用。以cDNA為模板,進行PCR擴增,擴增條件為:50℃預變性2min,95℃變性10min,1個循環;95℃退火15s,60℃延伸60s,40個循環。根據參考文獻,采用2-△△Ct法表示相對定量結果[4]。
6.蛋白印跡法:藥物干預48h后,以蛋白裂解液裂解細胞并提取蛋白,采用考馬斯亮藍進行蛋白定量。蛋白經SDS-PAGE電泳后,轉移至硝化纖維素膜(0.22μm,88024,美國Pierce公司)上,室溫下脫色搖床上封閉1h。Anti-MMP2 鼠抗體(1∶500)、Anti-MMP9 鼠抗體(1∶500)、Anti-VEGF 鼠抗體(1∶200),4℃孵育過夜,次日以兔抗小鼠 IgG(H+L)二抗(1∶5000,中國Beyotime公司)室溫孵育2h。采用增強化學發光法(enhanced chemil-uminescene,ECL)進行顯影。
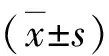
結 果
1.不同濃度去甲腎上腺素對HT-29細胞增殖能力的影響:CCK-8增殖實驗結果顯示,隨著培養時間的延長,細胞活力呈上升趨勢。當分別加入0.1、1、10及100μmol/L去甲腎上腺素時,隨著濃度增加先呈上升趨勢,后又下降,同時100μmol/L去甲腎上腺素可明顯抑制細胞生長,故選擇10μmol/L去甲腎上腺素處理48h進行后期實驗(圖1)。

圖1 不同濃度去甲腎上腺素對HT-29細胞增殖能力的影響A.對照組;B.0.1μmol/L去甲腎上腺素組;C.1μmol/L去甲腎上腺素組;D.10μmol/L去甲腎上腺素組;E.100μmol/L去甲腎上腺素組
2.去甲腎上腺素通過β-AR信號通路對細胞侵襲能力的影響:Transwell侵襲實驗顯示,隨著去甲腎上腺素濃度的增加,HT-29細胞侵襲能力逐漸增強。與空白對照組比較,0.1、1、10μmol/L去甲腎上腺素組HT-29細胞遷移率分別為144.60%±0.58%、215.80%±29.15%、253.00%±16.78%,差異均有統計學意義(P<0.05)。同時將10nmol/L普萘洛爾作用于HT-29細胞。10nmol/L普萘洛爾組與對照組比較,差異無統計學意義。而10nmol/L普萘洛爾聯合10μmol/L去甲腎上腺素組與10μmol/L去甲腎上腺素組比較,Transwell小室下層細胞數顯著減少(P=0.016),提示普萘洛爾可逆轉NE對HT-29的促侵襲作用(圖2)。

圖2 不同藥物處理組對HT-29細胞侵襲能力的影響(結晶紫,×200)A.對照組;B.0.1μmol/L去甲腎上腺素組;C.1μmol/L去甲腎上腺素組;D.10μmol/L去甲腎上腺素組;E.10nmol/L普萘洛爾組;F.10μmol/L去甲腎上腺素+ 10nmol/L普萘洛爾組;與對照組比較,*P<0.05,**P<0.01;與10μmol/L去甲腎上腺素組比較,#P<0.05
3.去甲腎上腺素通過β-AR信號通路對HT-29細胞MMP-2、MMP-9、VEGF mRNA表達的影響:根據Transwell侵襲結果,將10μmol/L去甲腎上腺素作用于HT-29細胞24h后,通過qRT-PCR檢測細胞MMP-2、MMP-9和VEGF mRNA表達水平。與對照組比較,10μmol/L去甲腎上腺能上調HT-29細胞中MMP-2(P=0.051)、MMP-9(P=0.002)和VEGF (P=0.026)mRNA表達水平,其中MMP-9和VEGF mRNA的表達比較,差異有統計學意義。而普萘洛爾聯合去甲腎上腺素組與去甲腎上腺素組比較,MMP-2(P=0.041)、MMP-9(P=0.002)和VEGF(P=0.023)mRNA表達下調,差異有統計學意義(圖3)。

圖3 不同藥物對HT-29細胞MMP-2、MMP-9和VEGF mRNA相對表達的影響A.對照組;B.10nmol/L普萘洛爾組;C.10μmol/L去甲腎上腺素組;D.10μmol/L去甲腎上腺素+10nmol/L普萘洛爾組;與對照組比較,*P<0.05,**P<0.01;與10μmol/L去甲腎上腺素組比較,#P<0.05,##P<0.01
4.去甲腎上腺素通過β-AR信號通路對MMP-2、MMP-9、VEGF蛋白表達的影響:采用Western blot法檢測去甲腎上腺素對MMP-2、MMP-9和VEGF蛋白表達的影響,與對照組比較,10μmol/L去甲腎上腺素作用HT-29細胞24h后MMP-2(P=0.033)、MMP-9(P=0.004)和VEGF(P=0.002)蛋白表達顯著增加,差異有統計學意義。而10nmol/L普萘洛爾聯合去甲腎上腺素組與去甲腎上腺素組比較,MMP-9(P=0.015)和VEGF(P=0.004)的蛋白表達減少,差異有統計學意義(圖4)。

圖4 不同藥物對HT-29細胞MMP-2、MMP-9和VEGF蛋白表達的影響A.對照組;B.10nmol/L普萘洛爾組;C.10μmol/L去甲腎上腺素組;D.10μmol/L去甲腎上腺素+10nmol/L普萘洛爾組;與對照組比較,*P<0.05,**P<0.01;與10μmol/L去甲腎上腺素組比較,#P<0.05,##P<0.01
5.去甲腎上腺素通過β-AR信號通路對HT-29細胞ERK1/2及其磷酸化蛋白表達的影響:采用Western blot法檢測10μmol/L去甲腎上腺素對HT-29細胞ERK1/2及p-ERK1/2蛋白表達的影響。與對照組比較,普萘洛爾作用細胞24h后,ERK1/2和p-ERK1/2蛋白均無明顯變化,而10μmol/L去甲腎上腺素組細胞p-ERK1/2蛋白表達明顯增高(P=0.002)。將10nmol/L普萘洛爾與10μmol/L去甲腎上腺素共同作用于HT-29細胞后,p-ERK1/2蛋白表達較去甲腎上腺素組顯著降低(P=0.012),提示普萘洛爾可減弱NE對HT-29細胞ERK1/2活性影響的作用(圖5)。

圖5 不同藥物對HT-29細胞ERK1/2和pERK1/2蛋白表達的影響A.對照組;B.10nmol/L普萘洛爾組;C.10μmol/L去甲腎上腺素組;D.10μmol/L去甲腎上腺素+10nmol/L普萘洛爾組;與對照組比較,*P<0.01;與10μmol/L去甲腎上腺素組比較,#P<0.05
討 論
由于免疫系統對于調節實體腫瘤生長的不確定性,交感神經系統釋放的應激激素能否直接影響到腫瘤細胞的增殖及轉移潛能是近年來研究的熱點。大量研究發現,在腫瘤進展和轉移的各階段中,機體應激狀態下產生增多的神經肽及神經遞質能夠使腫瘤細胞的生物學行為發生改變[5]。人體交感神經節后纖維釋放的神經遞質主要為去甲腎上腺素,通過作用于α-AR和β-AR而發揮調控作用,研究表明,β-AR信號通路與腫瘤的發生、發展密切相關[6]。去甲腎上腺素與腫瘤細胞表面的β-AR結合,繼而活化Ga蛋白介導的腺苷酸環化酶(adenylate cyclase,AC),AC將三磷酸腺苷(adenosine triphosphate,ATP)轉化為環磷酸腺苷(cyclic adenosine monophosphate,cAMP),cAMP通過下游效應系統進一步調節細胞活動。由于腫瘤類型和腎上腺素能受體亞型的不同,應激激素在促進腫瘤細胞增殖的同時,也出現抑制的現象。如β-AR信號通路激活能促進乳腺癌細胞的增殖[7,8]。但采用吡布特羅激活β2-AR信號通路后,由于阻斷了Raf-1/Mek-1/Erk1/2信號通路,則抑制了乳腺癌細胞MDA-MB-231的增殖,鑒于吡布特羅可以直接阻斷Raf-1/Mek-1/Erk1/2信號通路,同時多數研究認為兒茶酚胺類抑制腫瘤增殖的機制大多是通過作用于細胞的α-AR或多巴胺轉運蛋白[9,10]。因此,兒茶酚胺類物質對腫瘤細胞增殖的抑制作用是否通過β-AR信號通路實現目前仍存在爭議。
研究發現,P物質、多巴胺及去甲腎上腺素能夠提高乳腺癌細胞的遷移能力,其中去甲腎上腺素對乳腺癌細胞的移動具有趨化作用,并且能促進肺癌及前列腺癌細胞的遷移,而β-AR阻斷劑能阻斷這種促進作用[11~14]。本研究首先采用0、0.1、1、10μmol/L濃度的去甲腎上腺素作用于HT-29細胞,觀察其對細胞體外侵襲能力的影響。隨著去甲腎上腺素濃度的提高,HT-29細胞侵襲能力逐漸增強。根據既往研究提示,兒茶酚胺類物質對腫瘤細胞侵襲能力的促進作用主要是通過激活β-AR信號通路來實現的[6]。進一步采用非選擇性β-AR阻斷劑普萘洛爾對HT-29細胞進行預處理后再與去甲腎上腺素共同作用于HT-29細胞,觀察細胞侵襲能力的變化。普萘洛爾能明顯拮抗去甲腎上腺素對HT-29細胞體外侵襲能力的促進作用。
研究發現,兒茶酚胺類物質通過上調MMPs和VEGF的水平,提高口腔、前列腺、胰腺等惡性腫瘤細胞的血管生成及侵襲轉移能力[15~17]。腫瘤細胞分泌的基質金屬蛋白酶(matrix metalloproteinases,MMPs)作為一類具有降解細胞外基質(extracellular matrix, ECM)活性的酶家族,在腫瘤的浸潤轉移過程中起著關鍵的作用。其中,MMP-9作為家族中分子量最大的成員,通過降解ECM和基膜,使腫瘤細胞向周圍組織浸潤,同時通過促進新生血管的形成,從而加速腫瘤的侵襲轉移。VEGF則是腫瘤新生血管形成的重要調控因子,在腫瘤的生長和轉移過程中發揮重要的作用。研究發現,MMP-2和MMP-9能促進卵巢癌細胞株OVCAR3和SKOV3釋放VEGF,提示VEGF和MMPs之間的相互作用可能在卵巢癌進展中發揮重要作用。此外,在研究人頭頸部腫瘤細胞時發現,MMP-9與VEGF的水平呈正相關,并且與血管生成密切相關。在惡性膠質瘤細胞中同樣觀察到,VEGF水平與MT1-MMP、MMP-2和MMP-9均呈正相關。而MT1-MMP是激活MMP-2的重要組織因子,因此也提示MMPs具有調控VEGF的表達及生物學活性的作用。
隨著研究深入,β-AR信號通路被發現在兒茶酚胺類物質促進腫瘤細胞侵襲轉移的過程中扮演著橋梁作用[18,19]。本研究中qRT-PCR及Western blot法檢測結果均證實,去甲腎上腺素作用于HT-29細胞48h后,MMP-2、MMP-9及VEGF的表達均有顯著上調。將普萘洛爾阻斷β-AR信號通路后能逆轉去甲腎上腺素上調HT-29細胞MMP-9及VEGF 表達作用。本實驗同時檢測了去甲腎上腺素對ERK1/2信號通路的作用,結果發現去甲腎上腺素作用于HT-29細胞后,與對照組比較p-ERK1/2蛋白表達顯著增高,而普萘洛爾能拮抗去甲腎上腺素的作用,減弱其對ERK1/2活性的影響。細胞外信號調節激酶(extracellular signal-regulated kinase,ERK)作為絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成員之一,以非磷酸化和磷酸化兩種形態存在于細胞中。其中,磷酸化ERK(phospho-ERK,p-ERK)在腫瘤侵襲轉移過程中扮演重要的角色。p-ERK進入細胞核內,作用于核因子-κB、Ets、Sp1等轉錄因子,進而促進MMPs的轉錄與活化和腫瘤新生血管的形成,提高腫瘤細胞的增殖和侵襲能力[20,21]。本研究內容較為基礎,后續將進一步通過動物實驗或臨床實驗予以完善。
綜上所述,本研究提示去甲腎上腺素通過β-AR信號通路,上調腫瘤轉移相關因子的表達及ERK1/2的活性,進而提高HT-29細胞的體外侵襲能力。

