假單胞菌Pseudomonas sp. AT39反式茴腦氧化酶基因(tao)對產茴香酸的影響
蔣 瓊, 武 波, 黃羅冬, 華燕飛, 申佩弘,2*
1.廣西大學生命科學與技術學院,廣西微生物與酶工程技術研究中心,廣西 南寧 530004;2.亞熱帶農業生物資源保護與利用國家重點實驗室,廣西 南寧 530004;3.廣西民族師范學院,廣西 崇左 532200
茴香酸(anisic acid),化學名為4-甲氧基苯甲酸(4-Methoxybenzoic Acid),是合成香料的主要原料,同時也是防腐、制藥等領域方面的重要原料,是胺碘酮、茴拉西坦等的醫藥中間體,因而被人們關注及合成應用[1-3],反式茴腦可被微生物代謝合成茴香酸及茴香醛。國內外關于微生物利用反式茴腦合成茴香酸和茴香醛的研究報道并不多,已報道的能以反式茴腦為唯一碳源進行生長代謝的菌株主要有:AspergillusnigerZJ-9[2],Pseudomonassp.BT13[2],PseudomonasputidaWGAF10[4],Burkholderiasp. WGB31[5],且關注的是優化發酵條件提高反式茴腦的中間代謝產物茴香醛及茴香酸的產量。對反式茴腦代謝相關基因或途徑進行研究的菌株主要有Arthrobactersp. TA13[6,7]和PseudomonasputidaJYR-1[8-11]。根據研究報道,Arthrobactersp. TA13代謝反式茴腦生成對-茴香醇是通過形成環氧化物或二醇的中間體而實現的,但由于其體內缺乏脫甲氧基酶,因此不能斷裂苯環實現對茴腦的進一步利用。HAN Dongfei等人[9-11]對PseudomonasputidaJYR-1反式茴腦代謝途徑進行了研究,首次克隆出tao基因,并于大腸桿菌體內進行異源性表達,推斷反式茴腦氧化酶(TAO)為黃素蛋白單氧化酶,可將反式茴腦催化氧化成對-甲氧基茴香醛,且反應過程需NAD+和NADP+作為輔助因子。然而HAN Dongfei等人[9-11]對tao基因的功能研究是通過大腸桿菌的異源表達TAO酶來實現的,研究的范圍僅限于該基因,并不能真正了解該基因對反式茴腦整個代謝途徑的影響,以及與其他相關基因的作用關系。本研究擬以Pseudomonassp. AT39為目的菌株,構建tao基因的重組菌和pk18mob插入的突變菌及其互補菌,進行TAO酶比活力測定及反式茴腦代謝產物生成量的檢測,以確定tao基因在Pseudomonassp.AT39反式茴腦代謝過程中的地位及作用,也為工業合成茴香酸奠定基礎。
1 材料與方法
1.1 菌株與質粒
實驗所用的菌株和質粒:E.coliDH5α,菌株Pseudomonassp.AT39為本實驗室分離,克隆載體pMD18-T 購自TaKaRa 公司,質粒pRK2013、pBBR1MCS-5[12]和pK18mob[13]均由實驗室保存。
1.2 培養基和生長條件
大腸桿菌DH5α采用LB培養基,37 ℃培養。野生型Pseudomonassp. AT39菌株采用LM9培養基和種子培養基[14],30 ℃培養,實驗過程根據不同實驗目的需要在LM9培養基中加入不同濃度反式茴腦。實驗過程抗生素使用濃度 (mg/mL)為:氨芐青霉素(Amp)50;卡那霉素(Km)40;羧芐青霉素(Cb)100。
1.3 酶、試劑和引物
2x Taq MasterMix(含染料)和細菌基因組 DNA提取試劑盒購于北京康為世紀生物科技有限公司;Ex-Taq聚合酶和 T4-DNA ligase購自大連 TaKaRa公司;質粒 DNA提取試劑盒、膠回收試以及PCR產物純化試劑盒均購自于西寶生物科技股份有限公司;限制性內切酶及其緩沖液均購于Fermentas公司。實驗所用引物列于表1。

表1 實驗所用的引物
1.4 方法
1.4.1Pseudomonassp. AT39重組表達菌株的構建
以連接在T-載體且測序結果正確的tao基因為模板, 以tao-F、tao-R為引物,PCR擴增tao基因片段,并酶切后連接至以同樣酶切處理的pBBR1MCS-5質粒上,轉化至大腸桿菌DH5α感受態細胞中,構建重組菌DH5α/tao-pBBR1MCS5。以野生型Pseudomonassp. AT39為受體菌,DH5α/tao-pBBR1MCS5為供體菌,DH5α/pRK2013為幫助菌進行菌體量為1∶1∶1的三親本接合實驗[15],將重組質粒tao-pBBR1MCS5導入Pseudomonassp. AT39中,并進行質粒的提取及酶切驗證。
1.4.2P.putidaAT39菌株pk18mob插入突變體的構建
同樣以tao-T重組質粒為模板,Δtao-F、Δtao-R為引物(分別含EcoR I、XbaI酶切位點),PCR擴增tao基因部分片段btao(約425 bp),連接同樣酶切處理過的pK18mob質粒,并轉化至大腸桿菌DH5α感受態細胞中,構建菌株DH5α/ btao-pK18mob。參照方法1.4.2中三親本接合實驗操作,將自殺質粒pk18mob插入Pseudomonassp.AT39基因組中,并進行PCR驗證。
1.4.3互補菌株的構建
參照方法1.4.2中的三親本接合實驗操作將重組質粒tao-pBBR1MCS5導入突變株AT39/btao中,挑選具有Cbr和Kmr雙抗性的重組子接種到液體種子培養基培養12~16 h,提取質粒并進行PCR或酶切驗證。
1.4.4菌株生長情況測定
按1%(v/v)的接種量將過夜培養的菌液接種到新鮮的液體種子培養基中,30 ℃,180 r/min振蕩培養,每隔2 h取樣檢測OD600值,測定菌株的生長曲線。
1.4.5TAO酶活的測定
按1%(v/v)的接種量將過夜培養的菌液接種至LB培養基中,30 ℃,180 r/min培養至OD600為0.6時,加入終濃度為1.0 mmol/L的IPTG,繼續培養直至菌株的生長穩定期。離心后,以50 mmol/L磷酸鉀緩沖液(pH 8.0)懸浮沉淀并超聲波破碎,所用振幅39%,總時間50 min(每隔5 s停頓5 s)。離心后的上清即為粗酶液。
酶活測定方法參考文獻[11,16]稍作修改。1 mL的反應體系中含有50 mmol/磷酸鉀緩沖液(pH 8.0),20 mmol/L NADH,20 mmol/L FAD,100 mmol/L 反式茴腦,30 ℃,180 r/min振蕩反應1 h,沸水浴10 min,以超純水為空白對照。對酶反應液進行萃取,用高效液相色譜法對底物反式茴腦的減少量進行檢測且酶活力計算。
酶活定義:在30 ℃,pH 8.0條件下,每分鐘轉化1 μmol/L的反式茴腦所需酶量為1個酶活單位1 U,即1 U。
酶比活力(U/g)=A/(t×m)
注:A為樣品中反式茴腦減少的量(μmol),t為反應時間(min),m為酶的質量(g)。
1.4.6高效液相色譜法(HPLC)分析
按1%(v/v)的接種量將過夜培養的菌液接種到以1%(v/v)反式茴腦為唯一碳源的LM9培養基中,30 ℃,180 r/min振蕩培養。待菌株OD600值達到0.6~0.8時,加入終濃度為1.0 mmol/L的IPTG,30 ℃,180 r/min繼續振蕩培養36 h。進而對菌液進行萃取以及高效液相色譜的測定,具體實驗操作及數據處理方法參考文獻[4,14]。
2 結果與分析
2.1 Pseudomonas sp. AT39重組表達菌株、突變菌株及互補菌株的構建
利用兩端分別含有XhoI和EcoR I酶切位點的引物tao-F和tao-R擴增tao基因,雙酶切純化后與同樣處理的pBBR1MCS-5質粒連接,轉化至大腸桿菌DH5α感受態中,通過含有Gmr抗性的X-gal和IPTG培養基進行篩選重組轉化子。并使用限制性內切酶XhoI和EcoR I進行酶切驗證(圖1)。以野生菌P.putidaAT39為受體菌,DH5α/tao-pB-BR1MCS5為供體菌,DH5α/pRK2013為幫助菌進行三親本接合實驗,將重組子質粒導入野生菌中,構建重組菌AT39/tao-pBBR1MCS5。
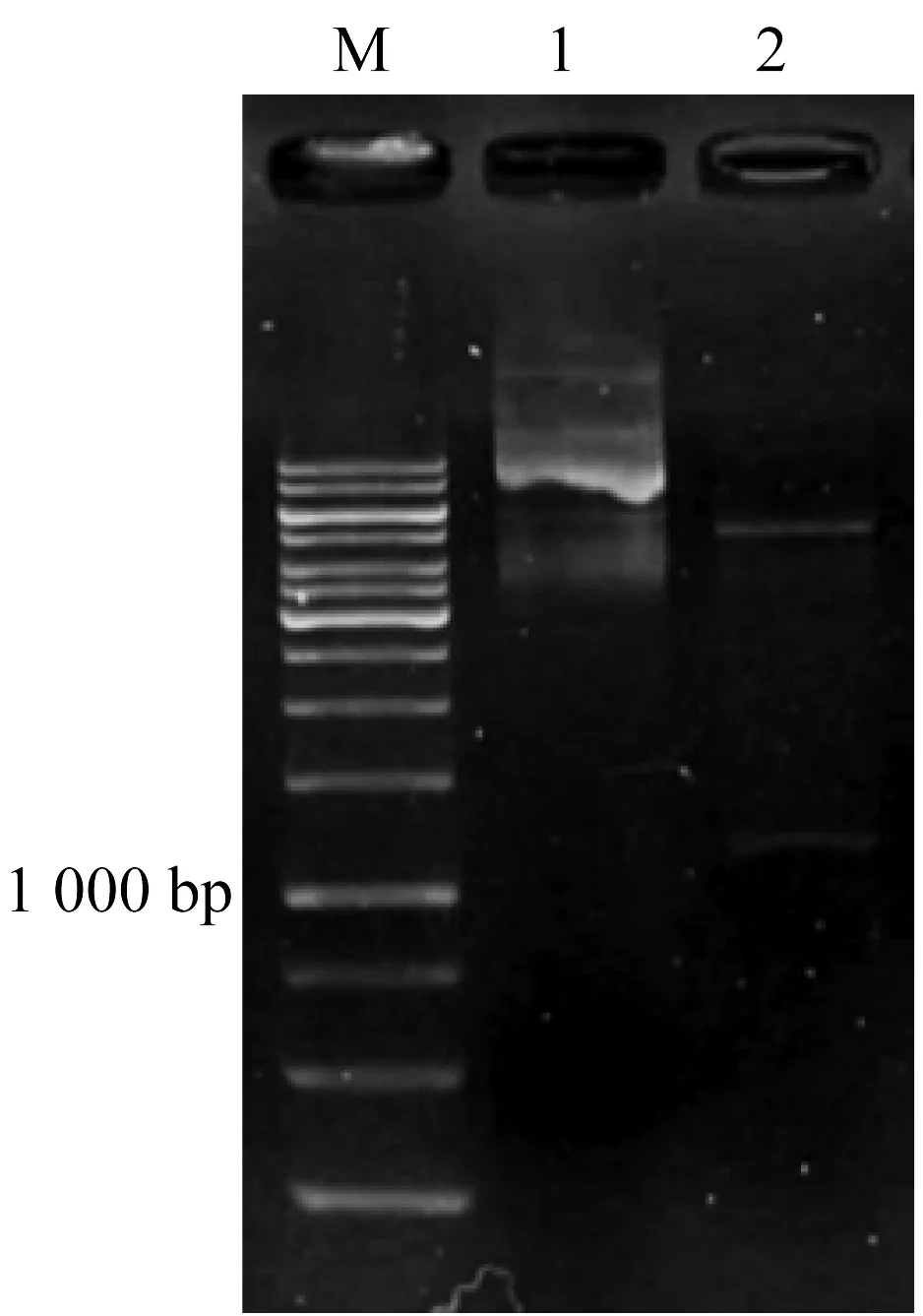
M: 1 000 b ladder DNA; 1: tao-pBBR1MCS5質粒; 2: tao-pBBR1MCS5質粒的Xho I 和EcoR I酶切圖1 重組質粒tao-pBBR1MCS5 的Xho I和EcoR I酶切驗證
以野生菌Pseudomonassp.AT39為受體菌,DH5α/tao-pBBR1MCS5為供體菌,DH5α/pRK2013為幫助菌進行三親本接合實驗,將重組子質粒tao-pBBR1MCS5導入野生菌中,構建重組菌AT39/tao-pBBR1MCS5。
按實驗操作,得到轉化子DH5α/btao-pK18mob,提取重組質粒酶切驗證(圖2)。參照方法1.4.1三親本實驗操作,將自殺質粒pK18mob插入到野生型AT39菌株基因組中,提取基因組DNA進行PCR驗證。
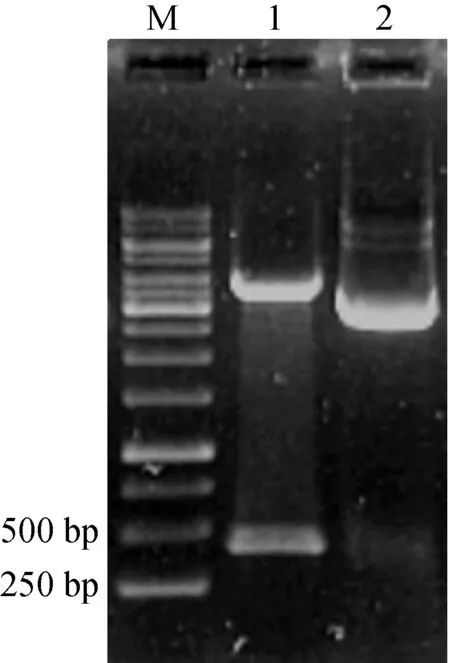
同樣參照1.4.1三親本實驗操作,將重組質粒tao-pBBR1MCS5導入突變菌AT39/btao中,構建互補菌HAT39/btao。提取互補菌重組質粒tao-pBBR1MCS5并進行酶切驗證。
2.2 菌株生長情況分析
對菌株AT39、AT39/pBBR1MCS5、AT39/btao、AT39/tao-pBBR1MCS5、HAT39/btao的生長曲線進行測定。結果表明,在種子培養基中,突變菌、重組菌以及突變互補菌到達穩定生長期的時間與野生菌的相差不大,與野生菌間的差值約為2 h。
2.3 酶活力測定
測定并計算菌株AT39、 AT39/btao、AT39/pBBR1MCS5、AT39/tao-pBBR1MC S5、HAT39/btao中TAO酶的比活力。結果如表2所示。
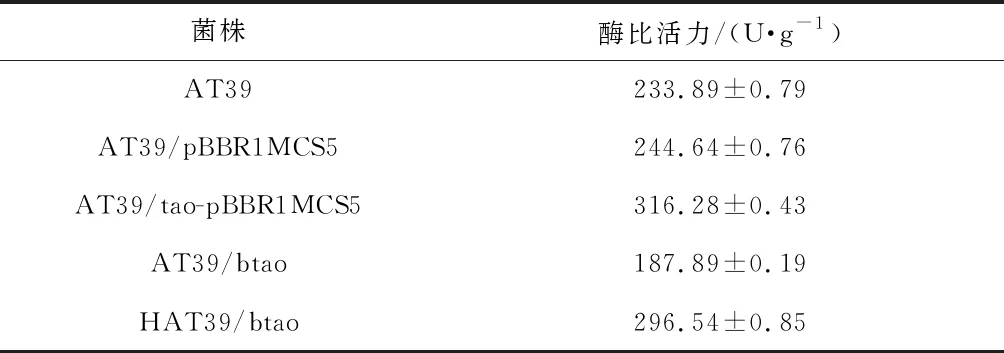
表2 各菌株中酶比活力的測定
根據表2中數據顯示,重組菌AT39/pBBR1MCS5 的TAO酶比活力同比野生菌AT39并未有顯著性差異。而重組菌AT39/tao-pBBR1MCS5比野生菌AT39酶比活力增加了35.23%,表明tao基因在lac啟動子作用下表達量增加,對反式茴腦的代謝作用增強,是反式茴腦代謝途徑中一個關鍵基因。突變菌AT39/btao比野生菌AT39酶比活力下降了19.67%,其互補菌HAT39/btao比野生菌AT39酶活力增加了26.79%,而相對于突變菌AT39/btao,酶比活力增加了57.83%。
2.4 茴香酸產量分析
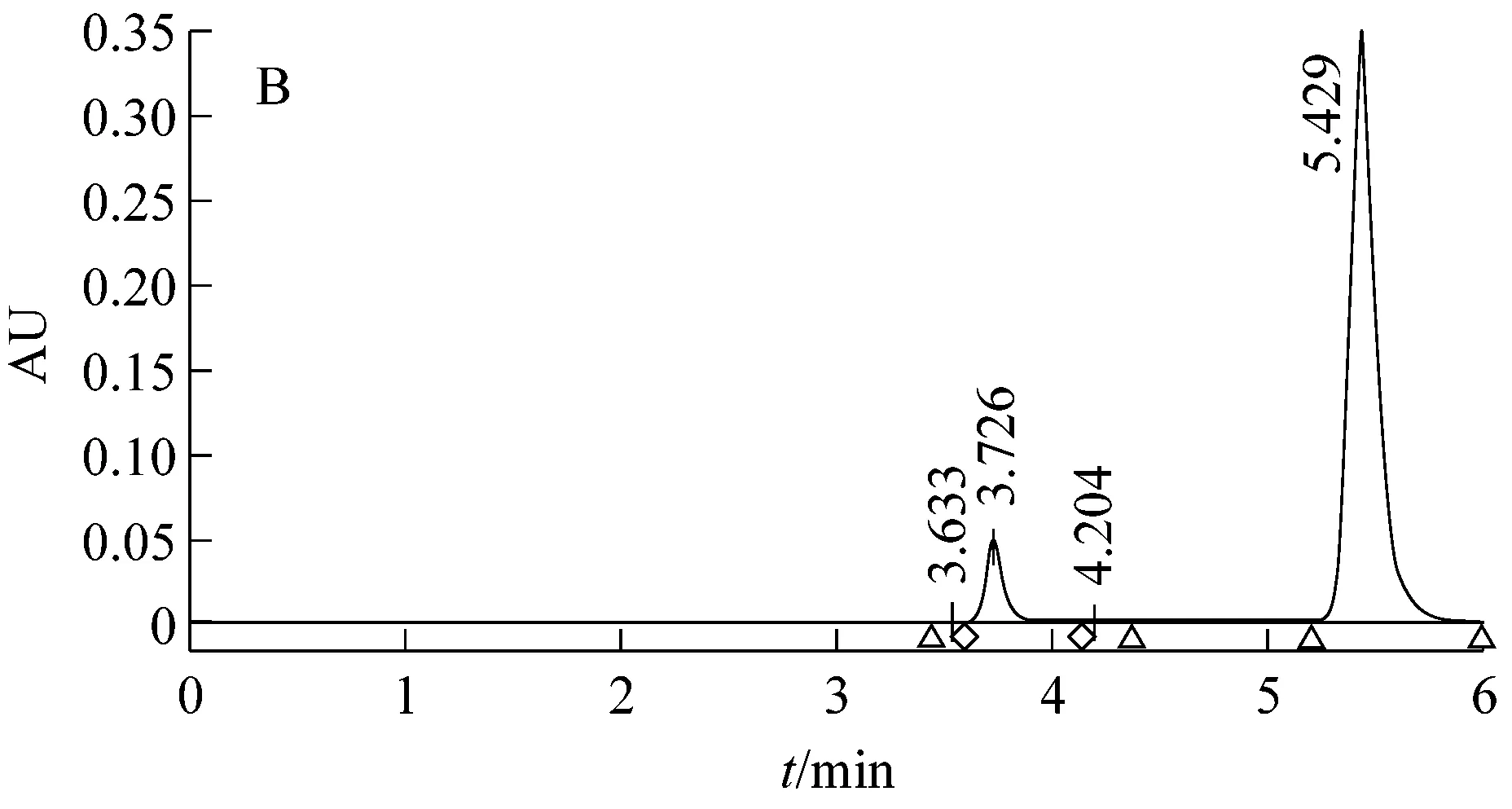
利用高效液相色譜法對Pseudomonassp. AT39野生型、重組型及突變型菌株發酵液中茴香酸進行檢測,如圖3所示。
圖3顯示野生菌AT39和空質粒重組菌AT39/pBBR1MCS5代謝反式茴腦36 h后茴香酸產量分別是0.706 g/L和0.695 g/L,茴香酸摩爾生成率分別為6.87%和6.77%,茴香腦的摩爾利用率分別為78.73%和88.48%。數據顯示兩者之間并未有顯著性差異,表明轉入的空質粒pBBR1MCS5對實驗結果影響不大。與此同時,重組菌AT39/tao-pBBR1MCS5代謝生成的茴香酸的量達到3.55 g/L,茴香酸摩爾生成率為34.56%,茴香腦摩爾利用率為86.42%。與已報道的P.putidaWGAF10[4]發酵條件優化后產茴香酸的量相比增加了45.5%。茴香酸摩爾生成率同比野生菌AT39增加了約4倍,比P.putidaWGAF10增加了42.22%。茴香腦的摩爾利用率同比野生菌AT39并未有顯著差異,而同比P.putidaWGAF10增加了46.18%。
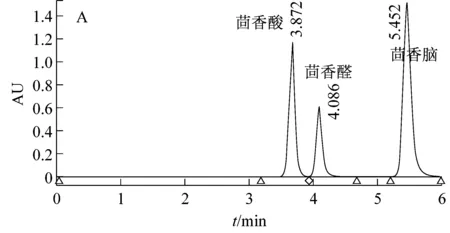
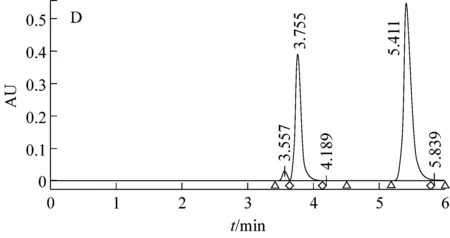
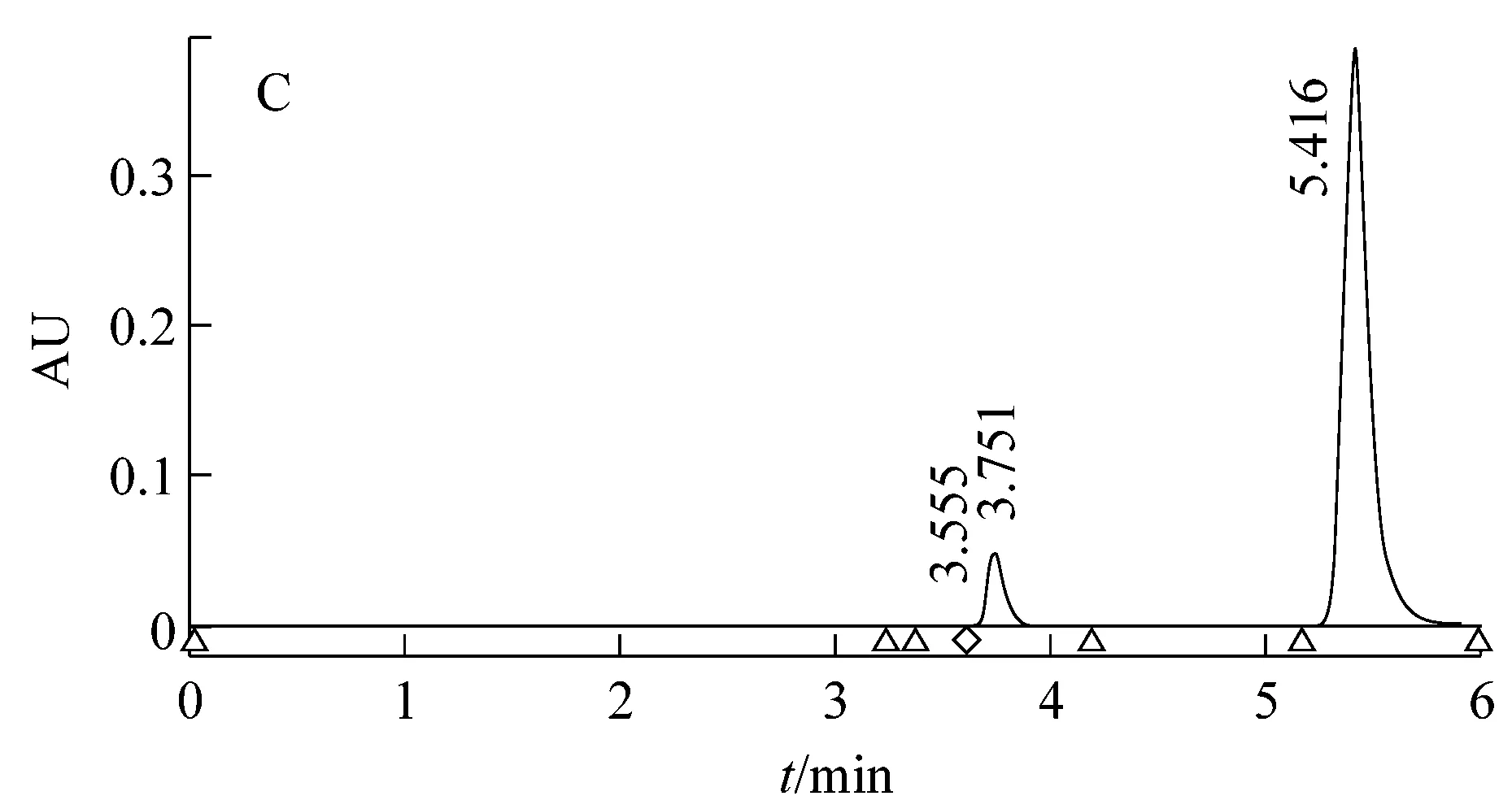
根據實驗結果分析得出突變株AT39/btao反式茴腦代謝過程中茴香酸生成量為0.028 g/L,比野生菌AT39茴香酸產量下降了96.10%。且其互補菌HAT39/btao代謝過程茴香酸產量為0.843 g/L,比野生菌AT39增加了19.4%,說明對突變菌的回補效果較好。
本次實驗中所用質粒為pBBR1MCS-5,所用的啟動子為低水平表達的lac啟動子,雖然相對野生型茴香酸的產量及茴香酸摩爾生成率均得到很大程度的提高,但為了后期能更好地應用于工業生產,可基于本次研究結果進行質粒強啟動子的構建,使tao基因進行高水平表達從而獲得更高產量的茴香酸。
3 結論
本研究對Pseudomonassp. AT39的tao基因進行了突變和表達,以研究該基因在菌株中對茴腦代謝及合成茴香酸的功能,發現tao基因的過量表達可以增加重組菌AT39/tao-pBBR1MCS5的酶活力,并提高茴香酸的轉化能力。確定了tao基因是Pseudomonassp. AT39利用反式茴腦代謝生產茴香酸的重要基因。

