影響檢測生活飲用水中菌落總數的相關因素探討
張 席
上海工微所科技有限公司, 上海 200233
細菌總數是評價水質污染程度的主要衛生指標,長期以來,國內多采用異養菌平板計數法[1,2]來測定水中的活菌數,現今對生活飲用水中的菌落總數檢測主要是根據《生活飲用水標準檢驗方法 微生物指標(GB/T 5750.12—2006)》中的平板計數法[3]來做,但由于飲用水中的貧營養環境有別于傳統培養基提供的富營養環境,大多數在顯微鏡下觀察到的細菌不能在傳統培養基中生長,致使活菌計數結果偏低。吖啶橙染色直接計數、活菌直接計數等方法可快速提高飲用水中的活菌計數[4],但這些方法要求高,需配備昂貴的儀器設備及專業技術人員。大部分小實驗室還是會選擇比較簡單的平板計數法,所以提高現有平板計數法的活菌檢出率是很有必要。
GB/T 5750.12—2006檢測水中菌落總數使用營養瓊脂(36±1) ℃培養48 h,而《食品安全國家標準 食品微生物學檢驗 菌落總數測定(GB 4789.2—2016)》中菌落總數檢測[5]采用平板計數瓊脂,并規定一般食品為(36±1) ℃培養(48±2)h,水產品是在(30±1) ℃培養(72±3) h,這是因水產品在溫度較低的水底生長,兼受海洋細菌與陸地細菌的污染,故以30 ℃作為培養溫度[6]。
本文將通過培養基的種類、培養溫度、實驗操作方法等條件和方法的比較,探討影響水中菌落總數檢測結果的影響因素,篩選合適的檢測參數,采用營養修復和實樣統計分析等手段研究縮短檢測時間的可能性,以提高平板計數法的檢出率的同時減少檢測時間,為GB/T 5750.12—2006中菌落總數檢測方法的改進提供數據。
1 材料與方法
1.1 主要儀器
培養箱(型號LRH-250,上海齊欣科學儀器有限公司);滅菌鍋(型號LDZX-50FBS,上海申安醫療器械廠);水浴鍋(型號DK-S28,上海精宏實驗設備有限公司);顯微鏡(型號BX-53,奧林巴斯) ;溫度計(型號0-100℃,上海華辰醫用儀表有限公司);氣浴恒溫振蕩器(型號THZ-82A,金壇市萬華實驗儀器廠);光學放大菌落計數器(型號 YLN-30,北京市亞力恩科學器材公司)。
1.2 供試培養基及樣品
葡萄糖(批號20180403,江蘇強盛功能化學股份有限公司);營養瓊脂(批號20190102,青島高科技工業園海博生物技術有限公司);平板計數瓊脂(批號20191127,青島高科技工業園海博生物技術有限公司);腦心浸液肉湯(批號20180726,青島高科技工業園海博生物技術有限公司);硫代硫酸鈉(批號20181101,無錫市亞泰聯合化工有限公司);樣品:生活飲用水(由某食品加工生產企業送檢提供或實驗室自備)。
1.3 實驗方法
1.3.1兩種培養基在不同培養條件下對菌落總數檢測結果的影響比較
在每125 mL生活飲用水樣品中加入0.1 mL的1%硫代硫酸鈉滅菌溶液進行除氯,振蕩搖勻后立即吸取1 mL分別置于8塊無菌平皿中,其中4塊倒入營養瓊脂培養基,另外4塊倒入平板計數瓊脂培養基,待凝固后每種培養基的其中2塊置于36 ℃培養2 d~10 d,另2塊置于30 ℃培養2 d~10 d,分別觀察結果。同時平行三次試驗,取其平均值來比較分析。
1.3.2添加不同比例的葡萄糖對檢測結果的影響比較
在營養瓊脂培養基中各加入0.0%、0.1%、0.3%、0.6%和1%的葡萄糖;在平板計數瓊脂培養基中加入0.0%、0.2%、0.5%和0.9%的葡萄糖,使兩種培養基中葡萄糖含量保持一致,將樣品除氯后,吸取1 mL分別置于36塊無菌平皿中,分別倒入這兩種含有不同比例葡萄糖的培養基,待平板凝固冷卻后分別置于36 ℃和30 ℃培養2 d~10 d。
1.3.3涂布平板法與倒平板法對檢測結果的影響比較
5個樣品除氯、搖勻后,分別吸取0.5 mL置于4塊無菌平皿中,其中2塊倒入(45±1) ℃平板計數瓊脂培養基,另外2塊倒入(40±1) ℃平板計數瓊脂培養基,同時置于30 ℃培養2 d~10 d。同時,分別吸取0.5 mL置于2塊已傾注好平板計數瓊脂的無菌平皿中,用涂布法將樣品涂布均勻后,置于30 ℃培養2 d~10 d。
涂布的無菌平皿應提前制備,平板計數瓊脂傾注到無菌平皿中后做去水汽處理,避免涂布后細菌混在一起無法計數。本實驗所用無菌平皿,是當天傾注好后打開平皿蓋子,放置在生物安全柜內通風2 h~4 h后,取出備用。
1.3.4營養修復后再培養對檢測結果的影響
加強充足的營養環境來復蘇或修復[7]細胞,可能會提高生活飲用水中的活菌檢出率。批量樣品除氯后,按樣品: 腦心浸液肉湯(BHI)為1∶1、1∶5、5∶1、1∶10和10∶1的量加入BHI液體培養基中,25 ℃下分別修復培養0 h、2 h、4 h和6 h后,平板計數瓊脂30 ℃培養2 d~7 d,計數,分析營養修復對計數的影響。
1.3.5按改進后方法對批量樣品檢測結果的統計分析
采用改進后的方法,即平板計數瓊脂、涂布平板、30 ℃、培養7 d,對自備的實驗室自來水管道用水20個、企業送檢的水樣42個進行檢測,記錄培養2 d、3 d和7 d時的計數。用SPSS 17.0對計數進行統計分析。
2 結果與討論
2.1 兩種培養基不同培養條件的計數比較
采用營養瓊脂和平板計數瓊脂在30 ℃、36 ℃下培養2 d~10 d后的計數結果見圖1,可看出,GB/T 5750.12—2006中使用營養瓊脂(36±1) ℃培養48 h(2 d)的數據明顯較低;相同培養溫度和培養時間下,平板計數瓊脂上生長的菌落總數明顯高于營養瓊脂培養的實驗結果;從第3 d開始,30 ℃條件下的菌落總數明顯高于36 ℃培養的結果,說明平板計數瓊脂培養基、30 ℃更適合生活飲用水中菌落總數的生長。
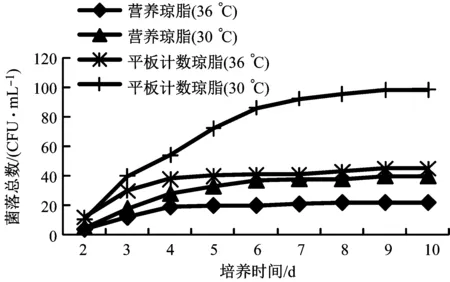
圖1 兩種培養基分別在36 ℃、30 ℃培養2 d~10 d的菌落總數
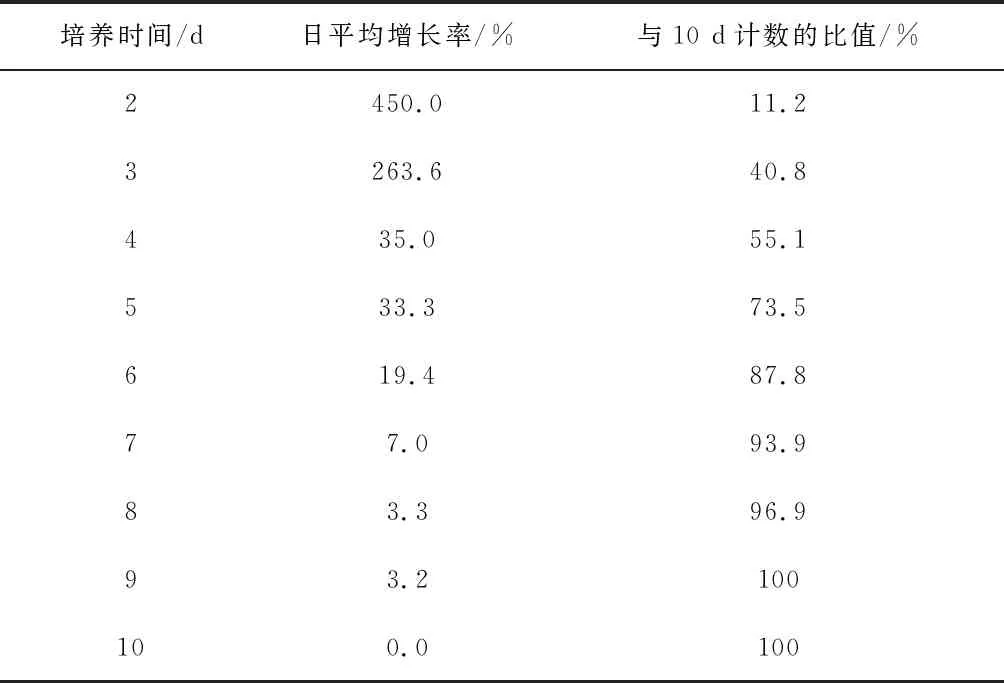
表1 平板計數瓊脂在30 ℃培養2 d~10 d的菌落數日增長率及與10 d計數的比值
表1是平板計數瓊脂在30 ℃下培養2 d~10 d的菌落計數的每日增長率及其與10 d計數的比值。結果發現,平板計數瓊脂30 ℃培養2 d后,在培養基上形成的肉眼可見的菌落,僅占10 d可見菌落的11.2% 左右,3 d后提高至40.8%,3 d的增長率達到了263.6%,而后開始逐步下降,直到6 d還有19.4%以上的增長率,從7 d開始增長率下降至7.0%以下,說明水中細菌總數在2 d~6 d增長幅度很大。對2 d~9 d與10 d成對實驗數據平均數進行t檢驗[8],2 d~6 d與10 d的實驗結果有顯著差異,而7 d~9 d與10 d實驗結果沒有顯著差異。說明水中菌落總數在平板計數瓊脂中、30 ℃條件下需要培養7 d才能達到生長峰值。
2.2 添加不同比例葡萄糖對計數結果影響的比較
比較平板計數瓊脂和營養瓊脂兩種培養基的配方成分,發現前者比后者多0.1%的葡萄糖。平板計數瓊脂更適合水中菌落總數生長是否是因為多了葡萄糖,因此,在兩種培養基中添加不同比例的葡萄糖,研究葡萄糖對計數的影響。
圖2是兩種培養基添加不同比例的葡萄糖后在36 ℃、30 ℃下培養2 d~10 d的計數結果。可以看到,在同一種培養基中,30 ℃培養結果明顯高于36 ℃培養結果,與圖1顯示的結果一致;添加葡萄糖后的營養瓊脂,36 ℃下培養的檢出數有少量提高,30 ℃下的培養結果反而降低;添加葡萄糖后的平板計數瓊脂培養基,兩個培養溫度下的檢出率均沒提高,說明原有的0.1%葡萄糖已能滿足微生物生長的需要。
2.3 倒平板法與涂布平板法對檢測結果的影響比較
表2是涂布平板法與倒平板法對檢測水中菌落總數的影響比較。發現兩個方法在2 d~6 d菌落總數累積增長率都在700%以上,說明在2 d~6 d菌落總數呈大幅生長趨勢,7 d~10 d累積增長率只有18.0% 以下,說明生長開始趨于平穩;倒平板法在30 ℃培養2 d后,在培養基上形成肉眼可見的菌落僅占10 d可見菌落的5.6%~6.4%,3 d后約占10 d平板上菌落總數的23.9%~25.4%;用涂布平板法在30 ℃培養2 d后,在培養基上形成肉眼可見的菌落僅占10 d可見菌落的8.6%左右,3 d后約占10 d平板上菌落總數的30.3%,說明兩種方法相差不大,涂布平板法沒有顯著提高檢出率。
倒入(40±1) ℃、(45±1) ℃兩種溫度的培養基經10 d培養后的計數結果無顯著性差異,說明倒入40 ℃~45 ℃的培養基對水中微生物的影響不大。通過2 d~9 d與10 d成對實驗數據平均數比較t檢驗[8],2 d~6 d與10 d檢測結果有明顯的差異,7 d~9 d與10 d實驗結果都沒有顯著差異。從圖3中也可明顯看出涂布平板法與倒平板法檢測菌落總數結果無差異性。
圖4是涂布平板法與倒平板法在30 ℃培養3 d的照片,可看出,涂布平板比倒平板上的生長菌落明顯大,計數方便。倒平板法在傾注培養基時要控制好培養基的溫度,避免溫度太高殺死部分不耐熱細菌致使計數偏低,或溫度太低無法與樣品均勻混合使細菌生長不均等問題[9],涂布平板是提前配制,不存在這些影響因素。因此確定水中菌落總數的檢測采用平板計數瓊脂、涂布平板、30 ℃培養7 d的方法。
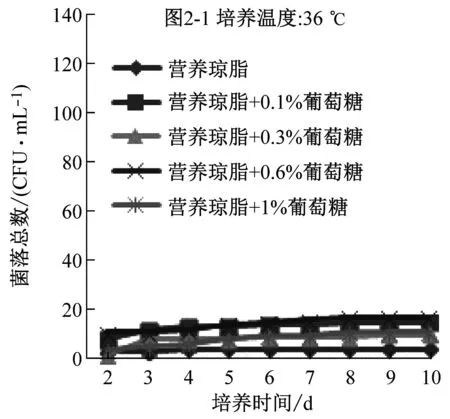

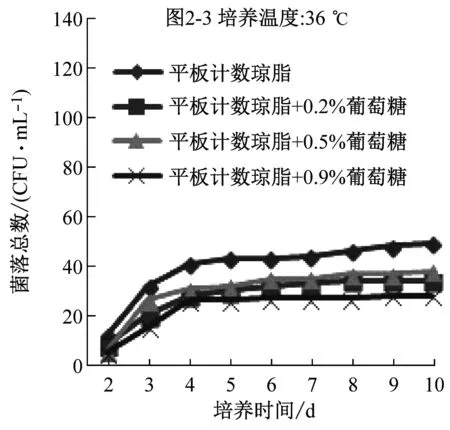
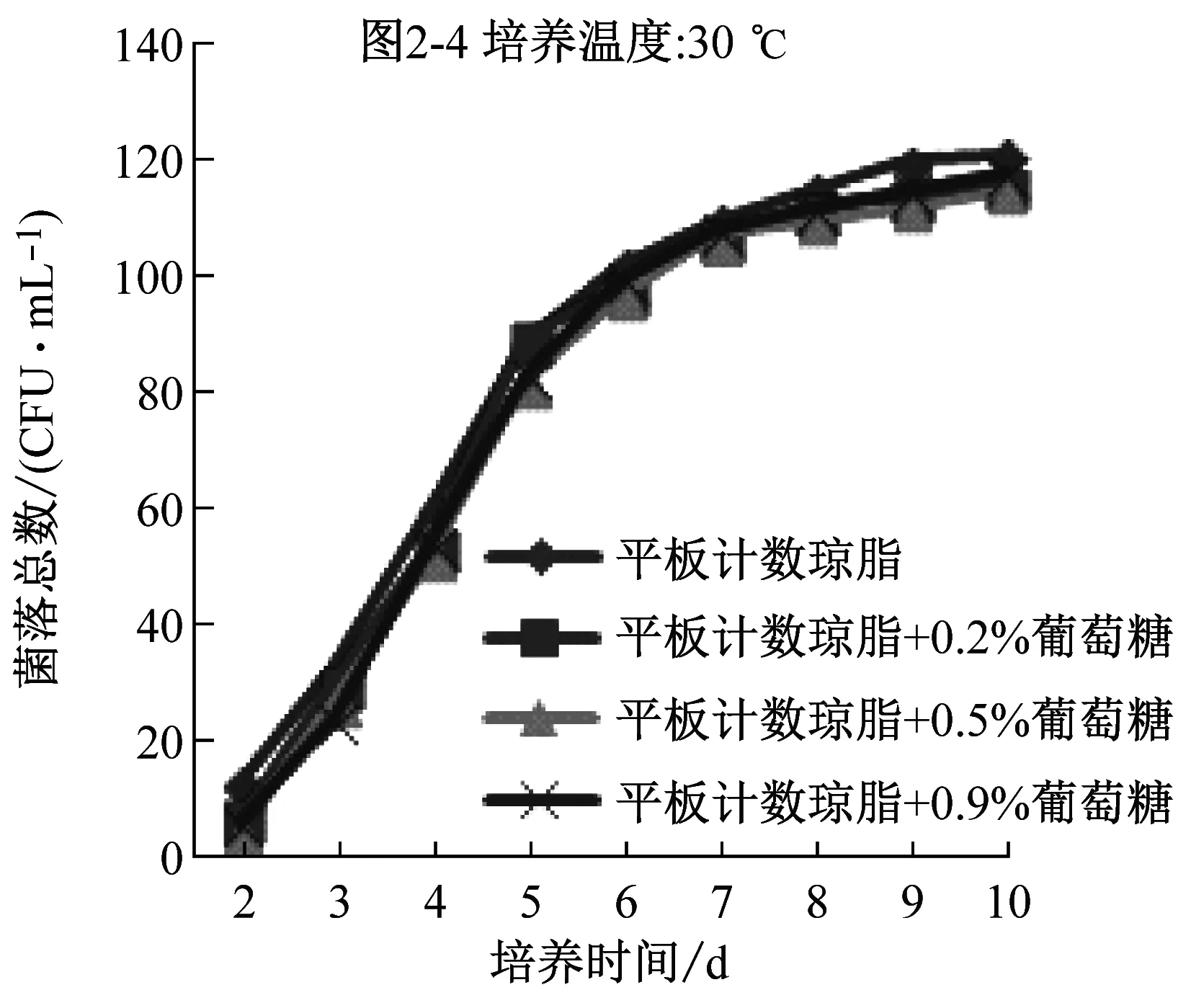
圖2 兩種培養基添加不同比例葡萄糖后在36 ℃、30 ℃培養2 d~10 d的計數結果
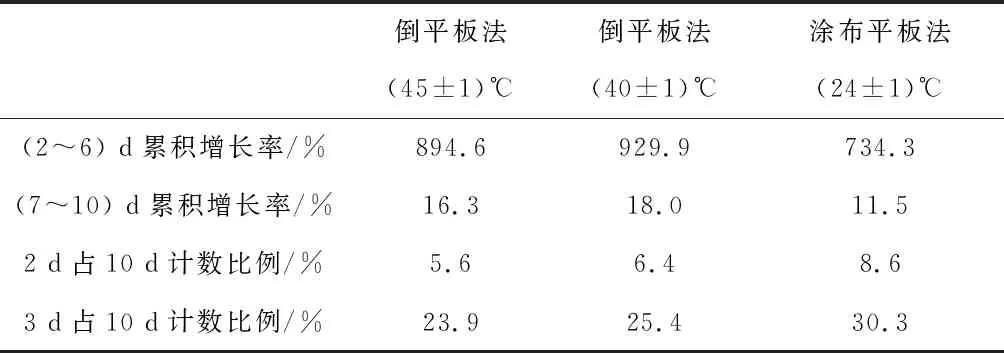
表2 涂布平板法與倒平板法對水中菌落總數檢測的影響比較
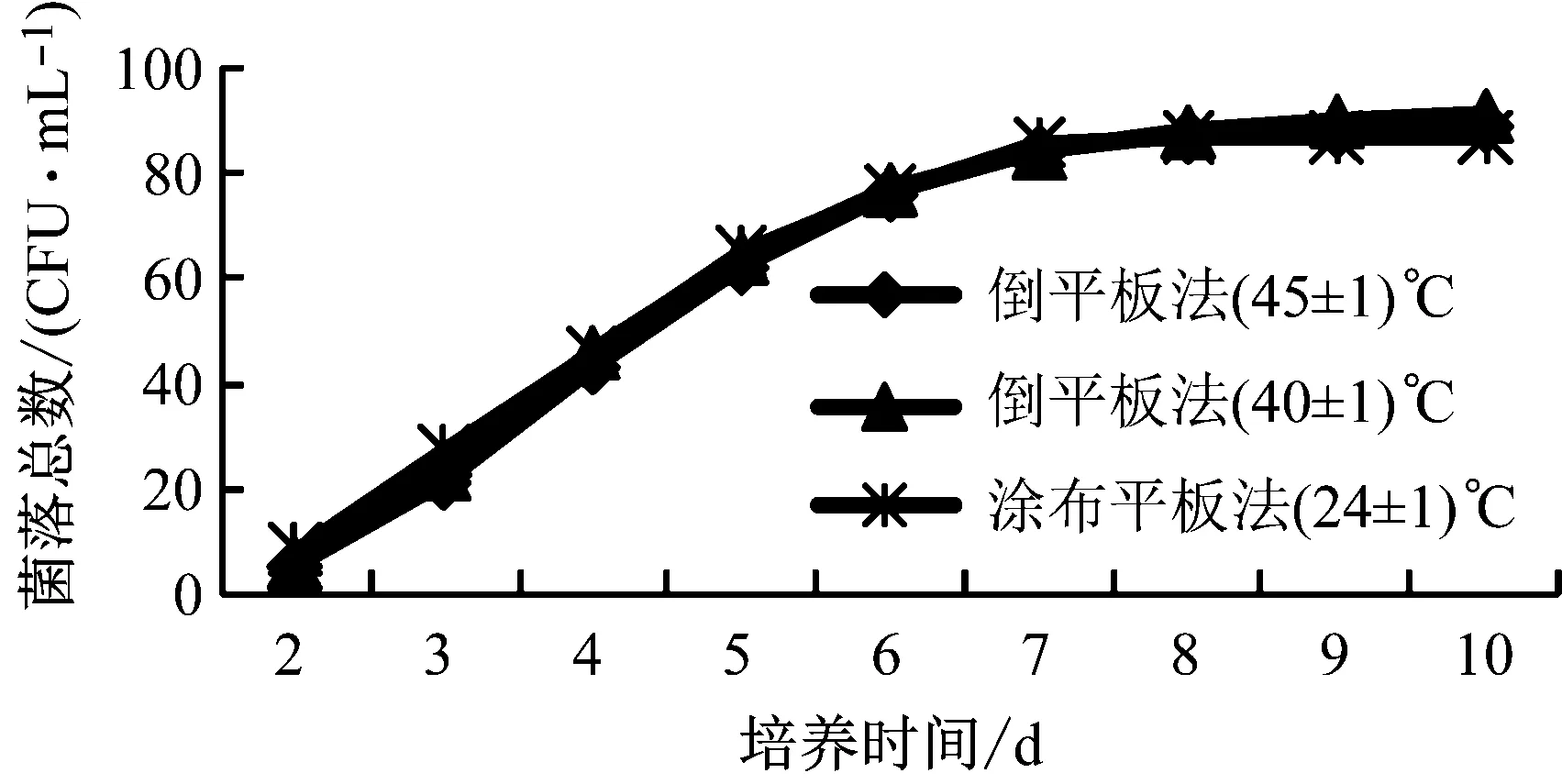
圖3 涂布平板法與倒平板法用平板計數瓊脂30 ℃培養2 d~10 d的計數結果
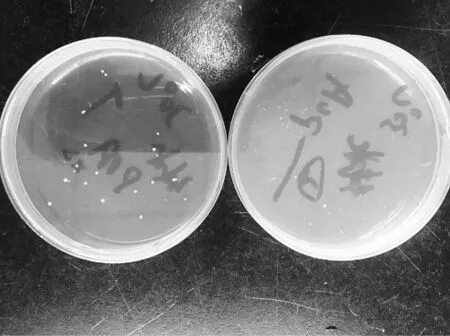
圖4 涂布平板法(左)與倒平板法(右)30 ℃培養 3 d的照片
2.4 營養修復后再培養對檢測計數的影響
改進后的生活飲用水中菌落總數的檢測方法已確定,但該方法需培養7 d,時間較長。一般生活飲用水中的營養貧乏,而還有含氯的抑菌物質存在,對水中的微生物細胞都會有影響,通過鏡檢觀察到有芽孢菌存在,說明有細胞受損等情況,所以水中微生物生長緩慢,需要較長的培養時間。通過加強充足的營養環境來復蘇修復受損的細胞,可能可以加快細胞生長,縮短培養時間。
批量樣品經營養修復實驗后,發現水樣中微生物主要有兩種類型,A類是營養修復后對其活菌生長速率沒影響;B類是自身能正常生長,營養修復后,生長速率加快。
A類樣品,除氯后在25 ℃條件中增加不同濃度的營養物質BHI修復0 h~6 h,結果均沒有出現增殖現象,在較高營養物質濃度中出現隨著修復時間加長而生長下降的趨勢,增加營養對細胞修復有限,不能提高活菌生長速率,見圖5。
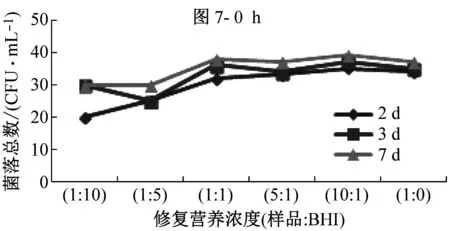
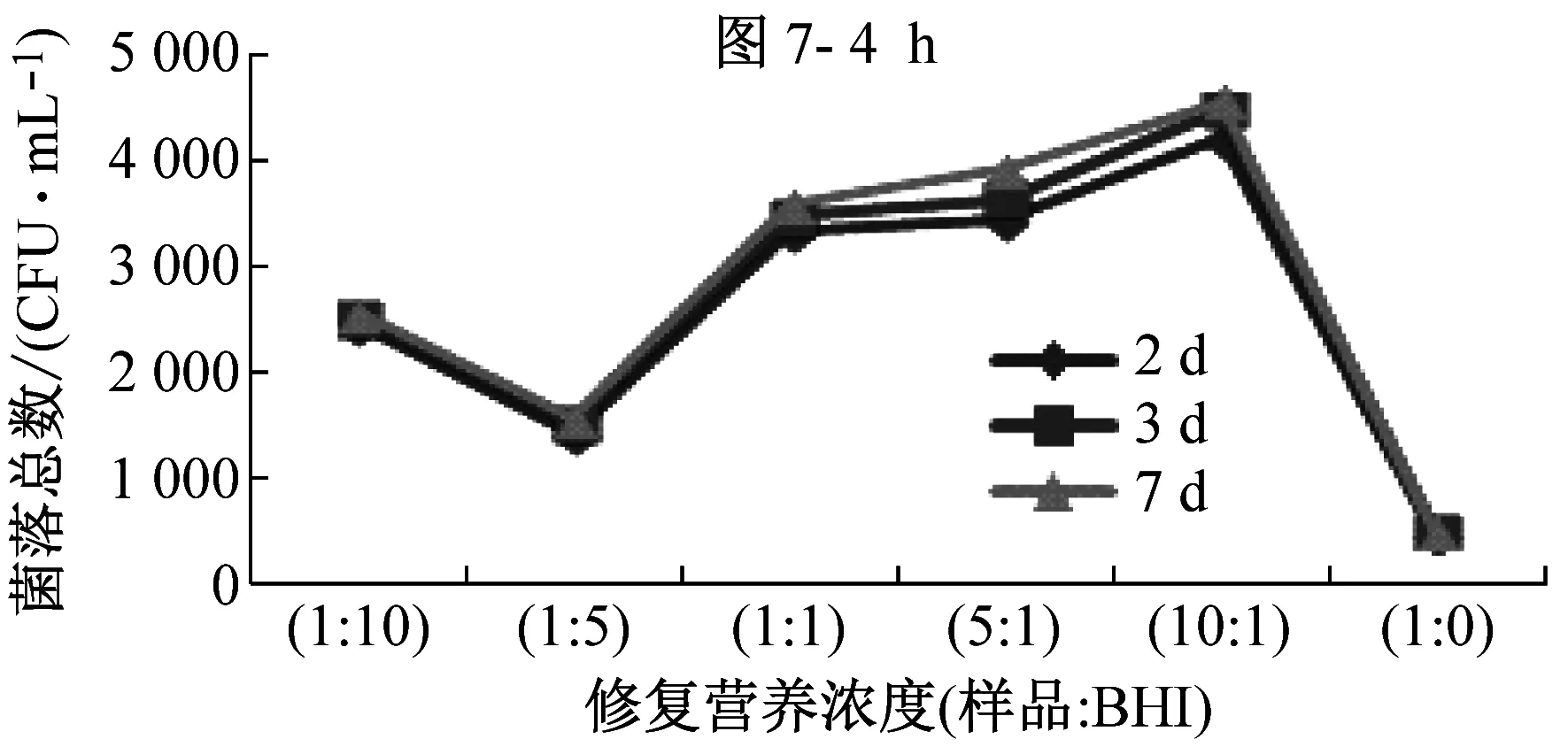
B類樣品,除氯后在25 ℃環境條件中修復0 h~6 h,隨著修復時間的增加,樣品原液(1∶0)和不同修復營養濃度下的樣品的菌落總數均出現大幅度增殖,見圖6,說明此類細菌易生長,無需修復。如圖7所示,B類樣品經修復后,在30 ℃下培養2 d、3 d和7 d的檢測結果無明顯差別,說明B類樣品只需培養2 d~3 d就能達到最高峰值。
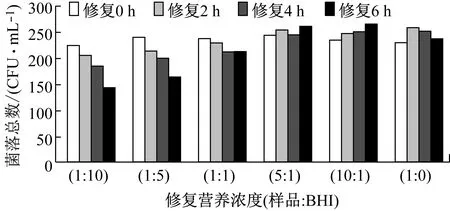
圖5 A類樣品經在不同修復營養濃度中25 ℃修復0 h~6 h后檢測結果

圖6 B類樣品經在不同修復營養濃度中25 ℃修復0 h~6 h后檢測結果
從圖8、圖9中看出,兩類水樣中的菌落形態不一樣,A類水樣菌落形態為灰白色、暗黃色、橘紅色為主要菌落,而B類水樣生長在平板計數瓊脂表面的是比較大且較粘稠的乳白色菌落、表層里的為乳白色細小菌落。
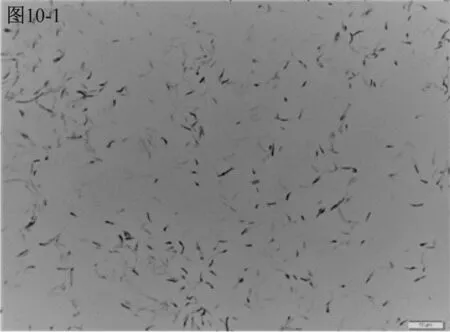
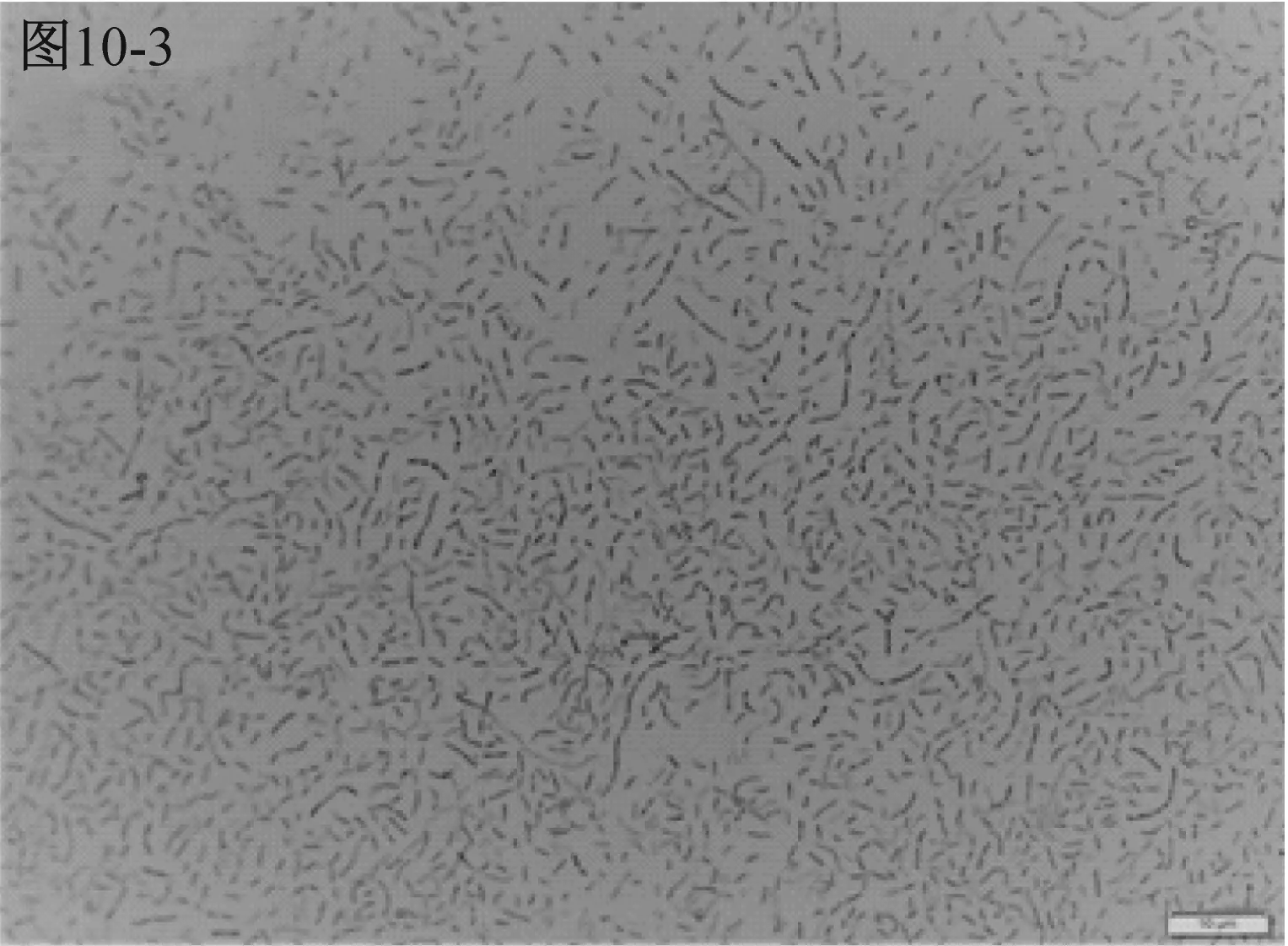
進一步鏡檢結果見圖10。A類水樣檢測平板上的三種細菌分別為以弧菌、長桿菌與短桿菌,并有少量芽孢菌存在,如圖10-1、10-2、10-3所示。有芽孢菌說明水中的部分細菌由于各種原因受抑制、損傷而在短時間內尚未形成肉眼可見的菌落,需繼續培養后使其復蘇并繁殖形成菌落[10],培養剛開始2 d形成的菌落比較少,此類菌生長緩慢需培養7 d。而B類水樣檢測平板上的兩種看似大小不一的細菌,經鏡檢發現都是球菌,見圖10-4,說明B類水樣生長的菌,在需氧條件下生長比厭氧條件下生長形成的菌落更快速,總的來說,此類細菌是一種容易生長的優勢菌,培養2 d~3 d即可。
圖8 A類樣品修復0 h~6 h后培養7 d的照片(從上右順時針0 h、2 h、4 h和6 h)
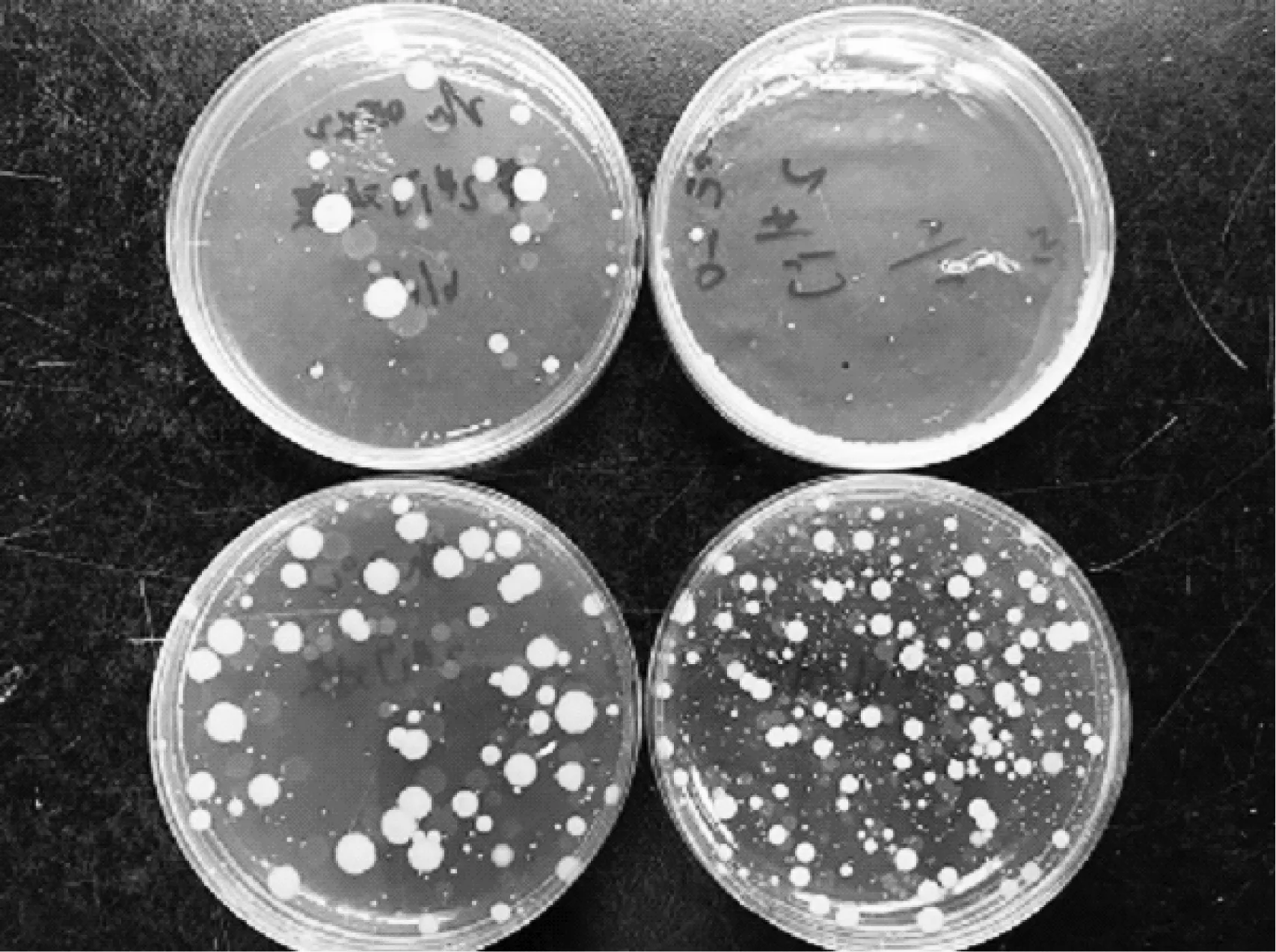
圖9 B類樣品的0 h~6 h后培養7 d的照片(從上右順時針0 h、2 h、4 h和6 h)
因此加強充足的營養物質,只會讓某類易生長的優勢菌大幅生長,沒能讓所有細菌達到同步生長繁殖,反而出現增殖或減少,影響檢測結果,故生活飲用水中菌落總數的檢測不宜采用營養修復方式進行預處理,一般水樣收到后應盡快開始檢驗,以盡量減少細菌群的變化,零星送檢的瓶裝采樣,若未經冷卻,采樣后6 h之內應行檢驗[11]。
2.5 按改進后方法對批量樣品檢測結果的統計分析
按改進后方法對62個水樣進行檢測,記錄培養2 d、3 d和7 d時的計數結果,發現7 d計數與2 d和3 d計數有一定的關系,采用SPSS 17.0對這些數據進行線性回歸擬合。
62個水樣中有7個樣品(占比11.3%),3 d與2 d計數的比值<2,7 d檢測結果與3 d計數接近,擬合后得線性回歸方程(1):Y=-0.387+1.155X(R=0.989),其中Y為7 d檢測結果,X為3 d計數。這類樣品的菌落易生長且單一,培養2 d~3 d就達到生長峰值,與B類水樣相似。
另外55個樣品(占比88.7%),3 d與2 d計數的比值≥2,3 d時計數與7 d時檢測結果有顯著性差異,培養2 d時菌落較少,3 d時生長速率加快,7 d時達到生長高峰,與A類水樣的特征比較相似,生長緩慢且有色素菌,需培養7 d后才能達到峰值。對這55個樣品7 d檢測結果和3 d計數進行擬合,得線性回歸方程(2):Y=27.455+2.525X(R=0.928),其中Y為7 d檢測結果,X為3 d計數。
改進后的方法需要培養7 d才能得到檢測結果,但經過以上統計分析,可根據培養2 d、3 d計數以及相應的回歸方程,預測7 d計數,從而預判樣品的檢測結果。
3 結 論
參考GB 4789.2—2016,對生活飲用水中菌落總數的檢測方法進行了改進,發現GB/T 5750.12—2006中使用營養瓊脂(36±1) ℃培養2 d的計數結果偏低,采用平板計數瓊脂培養基、30 ℃下培養2 d時,計數結果達到生長最高峰值的0%~11.2%,培養3 d計數結果能達到32.6%~40.8%,培養7 d達到生長最高峰值。
涂布平板法與倒平板法的計數結果無明顯差異,但涂布平板法在相同培養時間下菌落形態更大,更易于計數。
營養修復實驗發現水樣中的菌落有兩種類型,A類特點是生長緩慢且有多種色素菌,需培養7 d才能達到峰值;B類特點是易生長且單一,培養2 d~3 d即可。營養修復不能加快菌落總數的檢測時間,不建議對水樣進行營養修復前處理,應立即檢測。
采用平板計數瓊脂培養基30 ℃培養7 d的方法檢測水樣的菌落總數,可根據培養3 d與2 d時計數的比值以及相應的回歸方程,預測7 d時的計數結果。當樣品培養3 d與2 d計數的比值<2時,7 d 檢測結果Y=-0.387+1.155X(R=0.989,X為3 d計數);當培養3 d與2 d計數的比值≥2時,7 d檢測結果Y=27.455+2.525X(R=0.928,X為3 d計數)。
今后生活飲用水中菌落總數測定標準GB/T 5750.12—2006的改版,可參照國標GB4789.2—2016中的水產品要求,用平板計數瓊脂30 ℃培養3 d~7 d,這樣更能接近反映水中菌落總數的真實數值。另外,采用改進后方法計數時有相當比例的計數結果大于100 CFU/mL,故建議對現有生活飲用水的菌落總數判定限值進行合理的修訂。

