基于單核苷酸多態性位點的多重實時熒光定量聚合酶鏈式反應法鑒別當雄高山牦牛肉
劉睿茜 其美次仁 李家鵬 韋憶萱 李金春 王守偉
摘 要:通過比對5 個不同地區牦牛線粒體基因的差異,篩選出用于鑒定當雄高山牦牛的11 個單核苷酸多態性(single nucleotide polymorphisms,SNP)位點,將這些SNP位點作為引物3′端,同時引入引物堿基錯配理念,設計出8 對特異性引物,構建出2 個三重和1 個二重實時熒光定量聚合酶鏈式反應(real-time polymerase chain reaction,RT-PCR)體系,建立一種基于SNP位點和多重RT-PCR技術鑒別當雄高山牦牛肉的方法。結果表明:該方法特異性較好、簡便快捷、結果直觀可靠,能夠有效鑒別當雄高山牦牛肉;方法中3 個RT-PCR反應體系擴增產物對應的熔解溫度(melting temperature,Tm)范圍分別為反應體系A:73.1~75.2、76.0~77.3、79.0~80.0 ℃,反應體系B:69.5~72.8、75.0~77.9、78.5~80.0 ℃,反應體系C:76.1~78.1、79.5~80.7 ℃;根據3 個反應體系中熔解曲線峰的有無以及Tm是否符合取值范圍來判定樣品是否為當雄高山牦牛肉;市售樣品測定結果表明,該方法可用于實際樣品中當雄高山牦牛肉的快速鑒別。
關鍵詞:當雄高山牦牛;品種鑒別;單核苷酸多態性位點;多重實時熒光定量聚合酶鏈式反應;熔解曲線
Abstract: By comparing the difference in the mitochondrial gene of yaks from five different regions, 11 single nucleotide polymorphism (SNP) loci were selected for identification of the meat of Dangxiong alpine yaks. Utilizing the SNP loci as the 3 end of primers, and introducing the concept of base mismatch, 8 pairs of specific primers were designed to construct two triplex and one duplex real time polymerase chain reaction (RT-PCR) reaction systems. An SNP-based multiplex RT-PCR method was finally established to identify the meat of Dangxiong alpine yaks. The melting temperatures (Tm) of the three RT-PCR reaction systems were reaction A: 73.1–75.2, 76.0–77.3, and 79.0–80.0 ℃; reaction B: 69.5–72.8, 75.0–77.9, and 78.5–80.0 ℃; and reaction C: 76.1–78.1, and 79.5–80.7 ℃, respectively. The determination of whether an unknown sample was the meat of Dangxiong alpine yaks was dependent on the presence or absence of melting curve peaks in the three reaction systems and whether the peaks corresponded to the Tm ranges. The method was successfully applied to the rapid identification of real samples.
Keywords: Dangxiong alpine yak; breed identification; single nucleotide polymorphisms locus; multiplex real-time polymerase chain reaction; melting curve
DOI:10.7506/rlyj1001-8123-20200917-228
中圖分類號:TS207.3? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼:A 文章編號:1001-8123(2020)10-0047-06
牦牛是一種珍稀的畜種資源,可適應高海拔、低氣壓的氣候條件,且具有耐寒、耐勞、耐粗飼的優點。苛刻的生存環境造就了牦牛肉特有的品質,牦牛肉色澤深紅、富含蛋白質和礦物質,具有低脂肪、高營養、風味獨特等優良特性,越來越受到消費者的青睞[1-2]。我國牦牛產區眾多,主要分布于青海、四川、甘肅、西藏、云南和新疆等以青藏高原為中心的高原地帶[3-5]。各個產地的牦牛經過長期的自然選擇和人工選育形成了不同的品種[2,6]。當雄高山牦牛是當地人民經過長達300多年選育出的優良品種,2016年被認定為國家地理標志產品。當雄高山牦牛在生產性能、畜產品品質和遺傳穩定性上相比其他牦牛品種具有一定優勢[7]。王琳琳等[8]研究發現,當雄縣的高山牦牛肉在食用品質上優于麥洼牦牛肉。然而,不同地區牦牛因品牌知名度、市場接受度等不盡相同,導致牦牛肉價格也存在一定差異。低價肉冒充高價肉、普通產品冒充地理標志產品的欺詐行為,不僅侵害了消費者的合法權益,也對當地牦牛產業的發展造成了負面影響[9-11]。因此,為保護牦牛產業的健康發展,亟需開展當雄高山牦牛品種鑒定方法相關研究。
動物源性成分檢測技術通常建立在蛋白質、DNA等分子結構、序列或組成特異性分析的基礎上[12-13]。相對于蛋白質而言,DNA具有較高的熱穩定性和普遍存在性,使得基于DNA序列的動物源性成分鑒別方法得到更加廣泛的開發和應用[14-16]。聚合酶鏈式反應(polymerase chain reaction,PCR)技術具有靈敏度高、特異性強的特點,被認為是此類方法中鑒別動物源性成分的理想工具[17-18],其中實時熒光定量PCR(real-time PCR,RT-PCR)因操作簡便、可實時反映目標DNA片段的擴增情況,近些年被大量應用于動物源性成分的定性和定量分析[19-21]。RT-PCR技術主要包括探針法和染料法[22],相比于探針法,染料法更加簡單、節約成本[23],而熔解曲線分析是染料法中常用的結果分析手段,通過不同的熔解溫度(melting temperature,Tm)可以實現對物種的定性鑒別。凌睿等[24]使用SYBR Green染料法,通過熔解曲線中豬((82.03±0.25) ℃)、羊((78.83±0.16) ℃)擴增產物Tm的不同對以豬肉摻假羊肉的混合物進行檢測。Ishida等[25]通過線粒體DNA使用熔解曲線Tm分析法,應用2 個多重RT-PCR反應可鑒別多個動物物種。
目前,有關牦牛肉鑒別的研究主要是針對牦牛與普通牛等其他物種之間的鑒別。段慶梓等[9]利用細胞色素b(cytochrome b,Cyt b)基因設計牦牛特異性引物,對摻有豬肉、水牛肉和黃牛肉混合肉樣中的牦牛源性成分進行了有效鑒別。Zhao Jie等[11]利用等位基因特異性PCR技術,通過10 個單核苷酸多態性(single nucleotide polymorphisms,SNP)位點對牦牛肉和普通牛肉進行了區分。而不同品種牦牛肉之間鑒別方法的報道還很少。不同品種的牦牛由于氣候、海拔、植被和礦物質等生長環境不盡相同,在長期的自然選擇過程中,牦牛的遺傳物質DNA會發生不同程度、不同方向的變異,導致不同品種牦牛DNA中的個別堿基存在多態性[26-27]。有研究表明,利用多基因、多SNP位點組合以及多重PCR技術進行物種鑒別可以提高鑒別效率、準確度,節約成本[28-29]。
本研究采集西藏當雄縣、青海久治縣、青海祁連縣、四川紅原縣和甘肅甘南州5 個地區的牦牛肉樣品,通過對線粒體基因進行比對分析,篩選出11 個用于鑒定當雄高山牦牛肉的SNP位點,并以這些SNP位點作為引物3′端,設計出8 對特異性引物,最終建立一種基于SNP位點和多重RT-PCR技術鑒別當雄高山牦牛肉的方法。通過比較3 個反應體系熔解曲線峰的有無及Tm是否符合取值范圍,來判定樣品是否為當雄高山牦牛肉,對于西藏當雄牦牛的合理開發、利用及地理標志性的保護具有重要意義。
1 材料與方法
1.1 材料與試劑
當雄高山牦牛肉(霖肉,5 歲齡,32 份,1 kg/份) 西藏當雄縣凈土牦牛產業開發有限責任公司;其他地區牦牛肉(5 歲齡,68 份,1 kg/份):青海久治地區(久治牦牛,霖肉,20 份)、青海祁連地區(環湖牦牛,霖肉,14 份)、四川紅原地區(麥洼牦牛,脊肉,14 份)和甘肅甘南州地區(安多牦牛,脊肉,20 份);市售當雄牦牛肉(15 份,1 kg/份) 當雄縣農貿市場和拉薩市農貿市場。
DNA提取試劑盒 德國Qiagen公司;瓊脂糖?西班牙Biowest公司;D2000 DNA Marker 天根生化科技有限公司;PrimeSTAR? HS(Premix) 寶生物工程(大連)有限公司;LightCycler? 480 SYBR? Green I Master酶體系預混液 德國Roche公司。
1.2 儀器與設備
Omni Prep多樣品勻漿儀 美國Omni公司;NanoDrop One超微量紫外-可見分光光度計 美國Thermo Fisher公司;PCR儀、Biorad GelDoc XR凝膠成像儀?美國Bio-Rad公司;LightCycler 480熒光定量PCR儀 羅氏診斷產品(上海)有限公司;5417離心機 艾本德(中國)有限公司;DYCP-31F瓊脂糖水平電泳儀?北京六一儀器廠;Cascada BIO超純水系統 美國Pall公司。
1.3 方法
1.3.1 樣品DNA的提取
參考Li Jinchun等[30]所述方法進行樣品DNA提取。
1.3.2 線粒體基因擴增引物設計
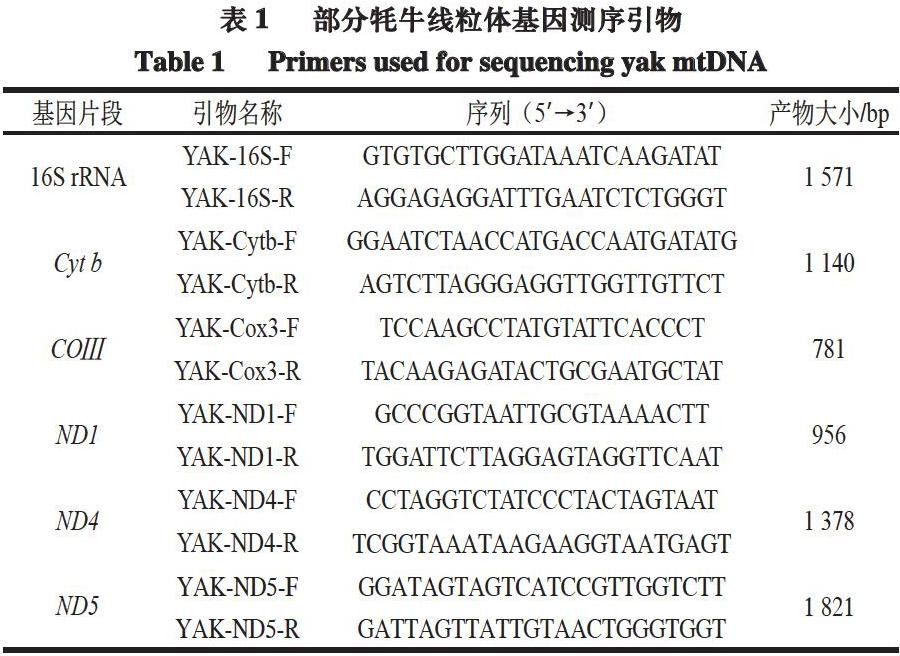
在美國國立生物技術信息中心(NCBI)數據庫下載青藏高原牦牛(Bos_grunniens,GenBank:KR011113.1)線粒體基因全序列,通過Oligo 7.0軟件設計出6 對用于擴增牦牛線粒體基因(16S rRNA、Cyt b、COⅢ、ND1、ND4、ND5)的引物(表1)。
1.3.3 線粒體基因擴增與測序
根據6 對線粒體基因引物,分別對32 份當雄高山牦牛肉樣品和68 份其他地區牦牛肉樣品進行PCR擴增。PCR擴增體系(30 μL):Premix 15 μL、上游引物(5 μmol/L)3 μL、下游引物(5 μmol/L)3 μL、模板(5 ng/μL)2 μL,滅菌雙蒸水補足體積至30 μL。普通PCR反應條件為:95 ℃預變性5 min,95 ℃變性30 s,60 ℃退火30 s,72 ℃延伸105 s,共計35 個循環。PCR反應結束后,使用1%瓊脂糖凝膠在100 V電壓條件下進行電泳,PCR產物上樣量5 μL,當溴酚藍移動到距離膠板下沿約1 cm處時停止電泳;電泳結束后在凝膠成像儀上成像,以檢測有無PCR擴增產物。擴增產物委托英濰捷基(上海)有限責任公司進行測序。
1.3.4 SNP位點篩選
將不同地區牦牛線粒體基因進行對比分析,篩選SNP位點。SNP位點篩選原則:以32 頭當雄高山牦牛保守序列為目標區域,篩選對應區域中其他牦牛線粒體堿基多態性高的位點,用于構建當雄高山牦牛鑒別方法。
1.3.5 鑒定當雄高山牦牛肉的引物設計
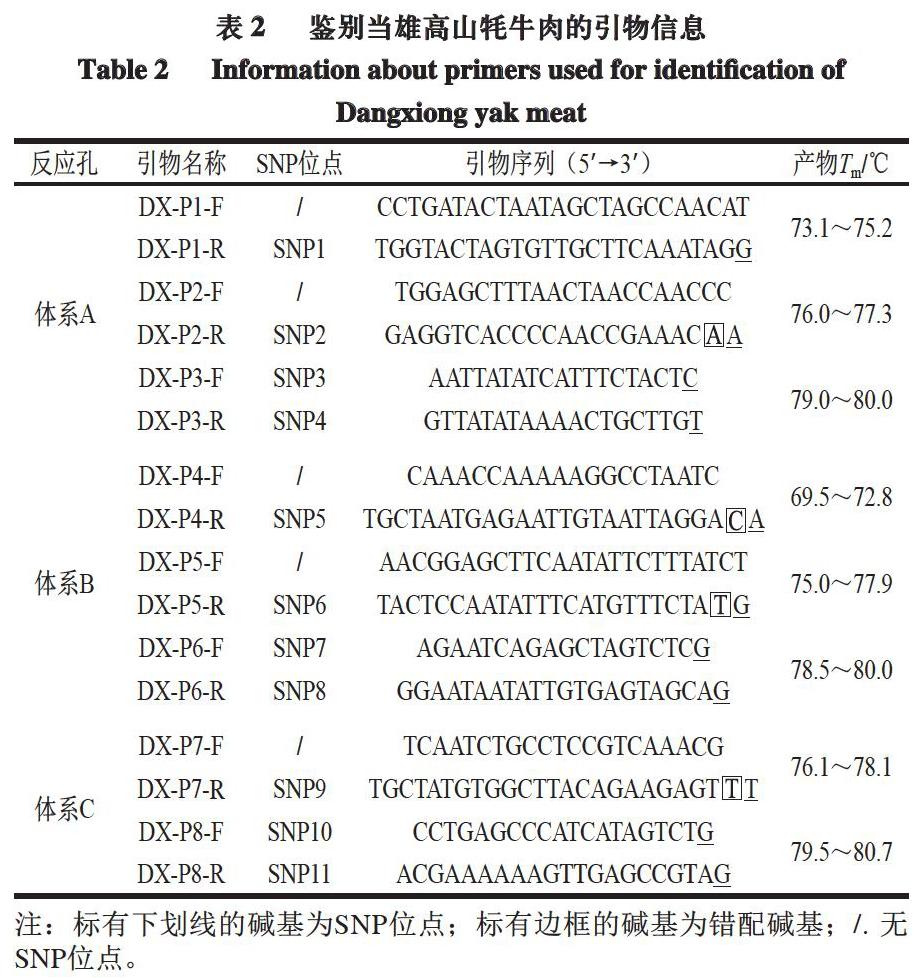
將篩選出的SNP位點作為鑒別當雄高山牦牛引物的3′端,將11 個SNP位點(表2)分別設計在8 對引物中并分組到3 個反應體系中,包括2 個三重反應體系(A、B)和1 個二重反應體系(C)。為了提高當雄高山牦牛引物的特異性和抑制非特異性擴增,引物設計過程中引入堿基錯配理念[31],在部分引物SNP位點的前一位引入錯配堿基(表2):DX-P2-R引物中由堿基T變為A;DX-P4-R引物中堿基A變為C;DX-P5-R引物中堿基G變為T;DX-P7-R引物中堿基A變為T。引物合成委托英濰捷基(上海)有限責任公司進行。
1.3.6 多重RT-PCR反應體系及條件
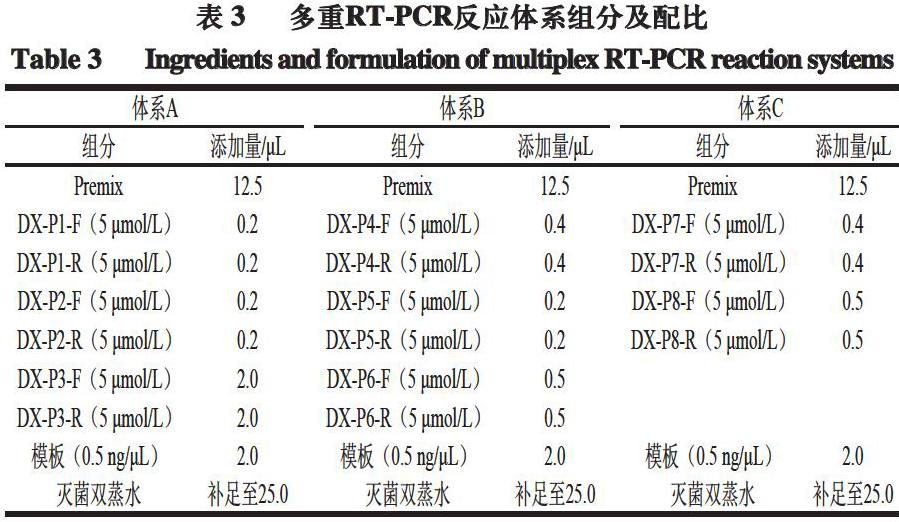
鑒別當雄地區牦牛肉的反應體系由2 個三重RT-PCR反應和1 個二重RT-PCR反應組成。多重RT-PCR反應體系總量為25 μL,組分及配比如表3所示。多重RT-PCR反應條件為:95 ℃預變性5 min,30 個循環,95 ℃變性10 s,57 ℃退火和延伸45 s;熔解曲線制作過程為:95 ℃、1 min,65 ℃、1 min,以0.02 ℃/s速率升溫至95 ℃,同時連續檢測熒光強度,最后冷卻(40 ℃、1 min)。
1.3.7 多重RT-PCR體系特異性檢驗
為考察多重RT-PCR體系特異性,分別隨機提取西藏當雄地區、青海久治地區、青海祁連地區、四川紅原地區和甘肅甘南州地區各3 個牦牛肉樣品的DNA,將DNA樣品質量濃度均稀釋至0.5 ng/μL,作為檢測模板。然后同時進行2 個三重和1 個二重RT-PCR熔解曲線分析。通過比較3 個反應體系熔解曲線峰的個數以及Tm是否符合取值范圍,來判定多重RT-PCR體系特異性。
1.3.8 多重RT-PCR體系的應用
將15 份于農貿市場采集的當雄牦牛樣品按照1.3.1節樣品DNA的提取方法進行處理,制備成待測模板,再根據1.3.6節多重RT-PCR反應體系及條件對15 個樣品模板進行檢測,每個樣品進行3 次平行實驗。
1.4 數據處理
通過LightCycler? 480軟件中Tm Calling分析得到Tm和熔解曲線圖,該曲線以Tm為橫坐標,熒光信號強度(F)對Tm的一階負導數(-dF/dTm)為縱坐標。
2 結果與分析
2.1 牦牛線粒體基因擴增結果
為驗證牦牛線粒體基因測序引物的擴增效果,挑選部分樣品的擴增產物進行瓊脂糖凝膠電泳實驗。由圖1可知,ND4和ND5基因擴增產物條帶清晰,大小與表1中產物大小一致,未發生非特異性擴增。PCR擴增產物經測序后進行比對分析,用于篩選SNP位點。
2.2 SNP位點篩選和引物設計
以當雄高山牦牛保守序列為目標區域,篩選對應區域中其他牦牛線粒體堿基多態性較高的位點,最終篩選出11 個SNP位點,所有SNP位點分布在16S rRNA、Cyt b、COⅢ、ND1、ND4、ND5共計6 個線粒體基因上,SNP位點物理位置及堿基分布情況見表4,其中物理位置參考青海高原牦牛線粒體基因組序列(GenBank:KR011113.1)確定。將這些SNP位點作為引物3′端,設計出8 對特異性引物,用于構建多重RT-PCR體系。
2.3 多重RT-PCR體系構建
在多重RT-PCR體系構建過程中,為避免多重RT-PCR體系中引物之間的交叉反應而導致非特異性擴增,相同或相鄰線粒體基因上的引物應當分組到不同RT-PCR反應體系中。另外,為防止熔解曲線峰重疊而無法區分,相鄰熔解曲線峰對應的ΔTm應大于其最小限值。Hernandez[32]、Ririe[33]等研究發現,二重RT-PCR中ΔTm為1.5 ℃或2 ℃時,均可通過峰圖對2 種擴增產物進行區分。基于以上2 點原因,將8 對引物分組到2 個三重和1 個二重RT-PCR反應體系中(表2)。
以當雄高山牦牛肉為陽性樣品,各反應體系中模板為滅菌雙蒸水作為空白對照,分別進行3 個多重RT-PCR反應,得到8 個擴增產物的熔解曲線峰圖,由圖2可知,反應體系A和B均出現3 個峰,反應體系C出現2 個峰。
單重RT-PCR到多重RT-PCR反應過程中,由于引物之間的競爭及引物與模板之間的競爭,相同擴增產物的含量也不盡相同,導致其Tm存在明顯差異[34]。統計當雄高山牦牛肉各反應體系中擴增產物Tm的溫度范圍,反應體系A擴增產物對應的Tm范圍分別為73.1~75.2、76.0~77.3、79.0~80.0 ℃;反應體系B擴增產物對應的Tm范圍分別為69.5~72.8、75.0~77.9、78.5~80.0 ℃;反應體系C擴增產物對應的Tm范圍分別為76.1~78.1、79.5~80.7 ℃。當樣品經過上述3 個多重RT-PCR體系出現上述8 個熔解峰,且各Tm均在相應溫度范圍之內時,則可判定為當雄牦牛肉陽性樣品,否則判定為非當雄牦牛肉樣品。
2.4 多重RT-PCR體系特異性檢驗
為驗證多重RT-PCR反應體系的特異性,隨機選取5 個地區不同品種牦牛肉樣品進行驗證,由表5可知,所有樣品的Tm均在陽性樣品Tm范圍內,其中當雄牦牛肉樣品熔解曲線峰達到8 個,其他4 個地區的非當雄牦牛肉樣品熔解曲線峰均少于8 個。例如,久治牦牛肉樣品1缺少體系B中的第3個熔解曲線峰(峰6),可推斷該樣品在SNP7位點的堿基不是G,或SNP8位點的堿基不是C,因此該方法可以達到通過符合Tm范圍的熔解曲線峰的有無來判斷各SNP位點的基因型,進而判斷樣品是否為當雄高山牦牛肉的目的。經過驗證,當雄高山牦牛肉樣品均出現8 個熔解曲線峰,且Tm符合取值范圍,而非當雄高山牦牛肉樣品熔解曲線峰均少于8 個,說明該多重RT-PCR體系具有良好的特異性。
2.5 市售當雄牦牛肉樣品檢測
為檢驗該方法的實際鑒別能力,對從拉薩市和當雄縣當地農貿市場購買的15 個當雄牦牛肉樣品進行檢測。通過分析熔解曲線峰圖發現,其中的11 個市售當雄牦牛肉樣品均出現8 個熔解曲線峰,Tm范圍分別為反應體系A:73.3~74.1、76.2~76.6、79.0~79.6 ℃;反應體系B:70.0~71.0、75.2~76.4、78.9~79.5 ℃;反應體系C:76.4~76.9、79.7~80.0 ℃,均符合判定標準中Tm的范圍,因此判定該11 個市售樣品為當雄高山牦牛肉。而剩余4 個市售樣品缺失反應體系B中Tm 78.5~80.0 ℃的第3 個熔解曲線峰(峰6)(表6),因此判定該4 個樣品為非當雄高山牦牛肉。通過此方法驗證的市售樣品中,有26.67%的當雄牦牛肉并非真實的當雄高山牦牛肉。
3 結 論
本研究開發了一種基于SNP位點和3 個多重RT-PCR反應體系熔解曲線分析鑒別當雄高山牦牛肉的方法,結果表明:3 個RT-PCR反應體系擴增產物對應的Tm范圍分別為反應體系A:73.1~75.2、76.0~77.3、79.0~80.0 ℃,反應體系B:69.5~72.8、75.0~77.9、78.5~80.0 ℃,反應體系C:76.1~78.1、79.5~80.7 ℃,根據3 個反應體系中熔解曲線峰的有無以及Tm是否符合取值范圍,來鑒定樣品是否為當雄高山牦牛肉。該方法具有良好的特異性,可用于實際樣品檢測。同時,該方法具有操作簡便、成本低、結果直觀可靠的優點,有利于推廣應用。該方法的建立將對保護當雄高山牦牛作為地理標志性產品、提升品牌價值、促進牦牛產業穩健發展起到重要作用。
參考文獻:
[1] 辜雪冬, 趙娟紅, 孫術國, 等. 不同工藝制備的干牦牛肉的理化特征分析[J]. 食品與發酵工業, 2019, 45(1): 165-170. DOI:10.13995/j.cnki.11-1802/ts.017025.
[2] 胡強, 鄭玉才, 金素鈺, 等. 用通用引物擴增細胞色素b基因進行牦牛肉的鑒定[J]. 食品科學, 2007, 28(11): 297-300.
[3] 李愛民, 馬云, 藍賢勇, 等. 牦牛分子標記研究進展[J]. 中國牛業科學, 2011, 37(4): 30-34. DOI:10.3969/j.issn.1001-9111.2011.04.009.
[4] 孟慶輝, 陳永杏, 董紅敏, 等. 牦牛分布特點及其種群數量[J]. 家畜生態學報, 2017, 38(3): 80-85. DOI:10.3969/j.issn.1673-1182.2017.03.017.
[5] WANG Zhaofeng, SHEN Xin, LIU Bin, et al. Phylogeographical analyses of domestic and wild yaks based on mitochondrial DNA: new data and reappraisal[J]. Journal of Biogeography, 2010, 37(12): 2332-2344. DOI:10.1111/j.1365-2699.2010.02379.x.
[6] 郭文場, 張嘉保, 陳樹寧. 中國牦牛品種(類群)的遺傳資源、生態特性、繁殖、飼牧管理與利用(1)[J]. 特種經濟動植物, 2014, 17(3): 8-12.
[7] 任戰軍, 常洪, 陳國宏, 等. 西藏當雄牦牛品種資源研究[J]. 西北農業學報, 2002, 11(2): 5-9. DOI:10.7606/j.issn.1004-1389.2002.2.002.
[8] 王琳琳, 陳煉紅. 紅原縣麥洼牦牛肉和當雄縣高山牦牛肉品質差異性的比較分析[J]. 西南民族大學學報(自然科學版), 2019, 45(5): 449-457. DOI:10.11920/xnmdzk.2019.05.002.
[9] 段慶梓, 尚柯, 張彪, 等. 肉及肉制品中牦牛源性成分的PCR鑒別[J]. 食品研究與開發, 2017, 38(9): 167-170. DOI:10.3969/j.issn.1005-6521.2017.09.035.
[10] WANG Ping, HU Yue, YANG Hairong, et al. DNA-based authentication method for detection of yak (Bos grunniens) in meat products[J]. Journal of AOAC International, 2013, 96(1): 142-146. DOI:10.5740/jaoacint.11-398.
[11] ZHAO Jie, XU Zhenzhen, CHEN Ailiang, et al. Identification of meat from yak and cattle using SNP markers with integrated allele-specific polymerase chain reaction-capillary electrophoresis method[J]. Meat Science, 2019, 148: 120-126. DOI:10.1016/j.meatsci.2018.08.019.
[12] LI Yingying, ZHANG Yingying, LI Huichen, et al. Simultaneous determination of heat stable peptides for eight animal and plant species in meat products using UPLC-MS/MS method[J]. Food Chemistry, 2018, 245: 125-131. DOI:10.1016/j.foodchem.2017.09.066.
[13] HOSSAIN M A M, ALI M E, HAMID S B A, et al. Targeting double genes in multiplex PCR for discriminating bovine, buffalo and porcine materials in food chain[J]. Food Control, 2016, 73: 175-184. DOI:10.1016/j.foodcont.2016.08.008.
[14] BALLIN N Z, VOGENSEN F K, KARLSSON A H. Species determination: can we detect and quantify meat adulteration?[J]. Meat Science, 2009, 83(2): 165-174. DOI:10.1016/j.meatsci.2009.06.003.
[15] 何瑋玲. 應用多重PCR及實時熒光PCR方法鑒別食品中肉類成分[D]. 南京: 南京農業大學, 2013: 2-11.
[16] FARAG M R, ALAGAWANY M, EL-HACK M E A, et al. Identification of different animal species in meat and meat products: trends and advances[J]. Advances in Animal and Veterinary Sciences, 2015, 3(6): 334-346. DOI:10.14737/journal.aavs/2015/3.6.334.346.
[17] GIRISH P S, KARABASANAVAR N S. Meat quality analysis: advanced evaluation methods, techniques, and technologies[M]. Elsevier Inc., 2020: 133-151. DOI:10.1016/B978-0-12-819233-7.00009-4.
[18] ALIKORD M, MOMTAZ H, KERAMAT J, et al. Species identification and animal authentication in meat products: a review[J]. Journal of Food Measurement and Characterization, 2018, 12(1):?145-155. DOI:10.1007/s11694-017-9625-z.
[19] KANG T S. Basic principles for developing real-time PCR methods used in food analysis: a review[J]. Trends in Food Science and Technology, 2019, 91: 574-585. DOI:10.1016/j.tifs.2019.07.037.
[20] 周彤, 李家鵬, 李金春, 等. 一種基于多重實時熒光聚合酶鏈式反應熔解曲線分析的肉及肉制品摻假鑒別方法[J]. 食品科學, 2017, 38(12): 217-222. DOI:10.7506/spkx1002-6630-201712033.
[21] WANG Wenjun, LIU Jianjian, ZHANG Qingde, et al. Multiplex PCR assay for identification and quantification of bovine and equine in minced meats using novel specific nuclear DNA sequences[J]. Food Control, 2019, 105: 29-37. DOI:10.1016/j.foodcont.2019.05.016.
[22] FARRELL R E, Jr. RNA methodologies[M]. 5th ed. New York: Academic Press, 2017: 283-328. DOI:10.1016/b978-0-12-804678-4.00009-9.
[23] LEVIN R E, EKEZIE F G C, SUN D W. DNA-based technique: polymerase chain reaction (PCR)[M]//SUN Dawen. Modern techniques for food authentication. 2nd ed. New York: Academic Press, 2018: 527-616. DOI:10.1016/b978-0-12-814264-6.00014-1.
[24] 凌睿, 薛建麗, 楊軍, 等. Real-Time PCR溶解曲線及Myostatin基因在肉類摻假快速鑒別中的應用[J]. 食品科技, 2013, 38(5): 318-322.
[25] ISHIDA N, SAKURADA M, KUSUNOKI H, et al. Development of a simultaneous identification method for 13 animal species using two multiplex real-time PCR assays and melting curve analysis[J]. Legal Medicine, 2018, 30: 64-71. DOI:10.1016/j.legalmed.2017.11.007.
[26] 張小波, 何慧, 吳瀟, 等. 基于SNP標記的肉類溯源技術[J]. 肉類研究, 2011, 25(5): 40-45. DOI:10.3969/j.issn.1001-8123.2011.05.010.
[27] 陳曉勇, 向海, BRAHI O H D, 等. 四引物擴增受阻突變體系PCR在綿羊線粒體基因組SNP檢測中的應用[J]. 中國草食動物科學, 2013, 33(6): 5-8. DOI:10.3969/j.issn.2095-3887.2013.06.001.
[28] 楊倩倩, 劉蘇汶, 俞曉平. DNA條形碼分析方法研究進展[J]. 應用生態學報, 2018, 29(3): 1006-1014. DOI:10.13287/j.1001-9332.201803.032.
[29] 趙杰. 基于SNP和SSR標記的牛肉產品溯源鑒定技術研究與應用[D]. 北京: 中國農業科學院, 2018: 1-10.
[30] LI Jinchun, LI Jiapeng, XU Suigen, et al. A rapid and reliable multiplex PCR assay for simultaneous detection of fourteen animal species in two tubes[J]. Food Chemistry, 2019, 295: 395-402. DOI:10.1016/j.foodchem.2019.05.112.
[31] 李金春, 李家鵬, 周彤, 等. 引物3'端不同堿基錯配情況下實時熒光定量PCR非特異性擴增的發生規律[J]. 食品科學, 2017, 38(10):?277-283. DOI:10.7506/spkx1002-6630-201710045.
[32] HERN?NDEZ M, RODR?GUEZ-L?ZARO D, ESTEVE T, et al. Development of melting temperature-based SYBR Green I polymerase chain reaction methods for multiplex genetically modified organism detection[J]. Analytical Biochemistry, 2003, 323(2): 164-170. DOI:10.1016/j.ab.2003.07.015.
[33] RIRIE K M, RASMUSSEN R P, WITTWER C T. Product differentiation by analysis of DNA melting curves during the polymerase chain reaction[J]. Analytical Biochemistry, 1997, 245(2): 154-160. DOI:10.1006/abio.1996.9916.
[34] LI Jinchun, LI Jiapeng, LIU Ruixi, et al. Identification of eleven meat species in foodstuff by a hexaplex real-time PCR with melting curve analysis[J]. Food Control, 2021, 121: 107599. DOI:10.1016/j.foodcont.2020.107599.

