基于“模型認知”的陌生氧化還原反應方程式書寫


“模型認知”是一種化學學科核心素養,是運用模型步驟學習和研究化學的一種重要思維技巧。陌生氧化還原反應方程式和電極反應式的書寫是高三化學復習過程中必須突破的重難點知識,其作為高考必考內容,對考生的基本功提出了很高的要求,需要考生具備從題目中提取有效信息、挖掘隱含條件和綜合分析處理問題等能力。
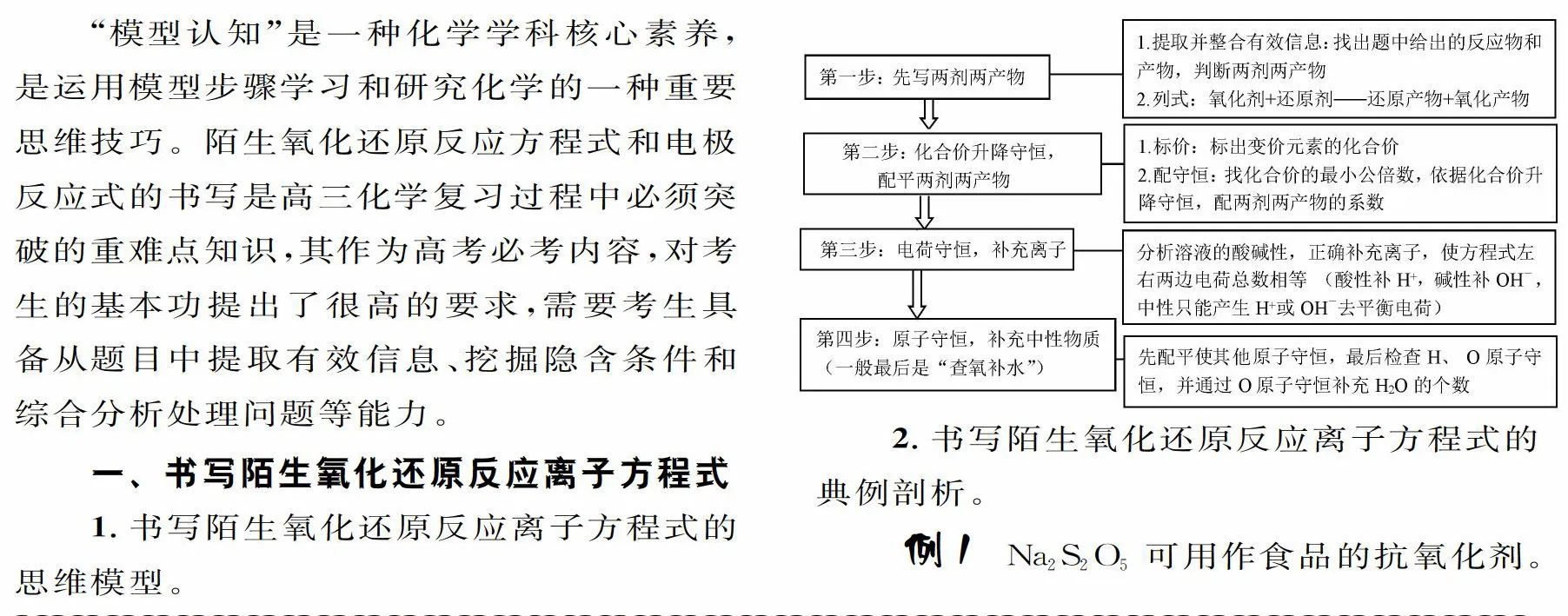
一,書寫陌生氧化還原反應離子方程式
1.書寫陌生氧化還原反應離子方程式的思維模型。
2.書寫陌生氧化還原反應離子方程式的典例剖析。
例1 Na2 S2 O5可用作食品的抗氧化劑。在測定某葡萄酒中Na2S2 O5殘留量時,取50. 00 mL葡萄酒樣品,用0.01000 mol . L-1的碘標準液滴定至終點,消耗10.00 mL。滴定反應的離子方程式為
。
例1的思維模型:
【知識儲備】若根據題中信息不能找出還原產物和氧化產物,應運用已有的知識儲備,依據一般情況下常見氧化劑對應的還原產物和常見還原劑對應的氧化產物,直接寫出相應的還原產物和氧化產物。在書寫陌生氧化還原反應離子方程式時考生必須掌握的知識如下:
(1)常見氧化劑(得電子,化合價降低)一對應的還原產物。
①濃硫酸→SO2(強調溶液中SO2-無強氧化性),②濃硝酸→NO2,③稀硝酸或NO3(H+)→NO(強調溶液中NO3無強氧化性),④Fe3+→Fe2+,⑤C12( Br2、I2)→Cl- (Br、I),⑥ClO- (ClO2、ClO3→CI-(強調還原產物不是Cl2),⑦MnO4 (H+)→Mn2+(只需記住酸性條件下Mn04的還原產物Mn2+,對于堿性和中性條件下的還原產物,題中一般都有信息,無需強記),⑧Cr2 O2-( H+)→Cr3+,⑨MnO2→Mn2+,⑩H2 O2→H2O。
(2)常見還原劑(失電子,化合價升高)一對應的氧化產物。
調:H2 O2中O為-1價,處于中間價態,既可以作氧化劑又可以作還原劑,其主要以氧化性為主,但當H2O2遇到很強的氧化劑如Mn04時只能作還原劑失電子化合價升高,O從-1價升高到0價的O2)。
二,書寫陌生氧化還原反應化學方程式
1.書寫陌生氧化還原反應化學方程式的思維模型。
2.書寫陌生氧化還原反應化學方程式的典例剖析。
例2高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業上可由天然二氧化錳粉與硫化錳礦(還含Fe、Al、Mg、Zn、Ni、Si等元素)制備,工藝流程如下:
寫出“溶浸”中二氧化錳與硫化錳反應的化學方程式:
。
答案:MnO2+MnS+2H2SO4==2MnSO4+S+2H2O
解析:第一步:提取并整合有效信息,問題中給出了反應物為MnO7和MnS,產物濾渣1中含S單質;流程中還可看出“溶浸”中有H2SO4參與反應。考生應運用已有的知識儲備,判斷出氧化劑為MnO2,其化合價降低后對應的還原產物為Mn2+,在硫酸溶液中,主要陰離子為SO2-,分析出還原產物為MnSO4;MnS中一2價S具有很強的還原性,其化合價升高后對應的氧化產物為S,判斷出兩劑兩產物后列式。MnO2+MnS==MnSO4+S。
第二步:標出變價元素的化合價,MnO2中Mn從+4價降低到+2價的MnSO4,MnS中S從 -2價升高到0價的S單質,升降均為2,化合價升降守恒,配兩劑兩產物的系數。MnO2 +MnS——MnSO4 +S。
第三步:檢查各原子是否守恒,先查Mn原子守恒,配MnSO4的系數為2,分析MnSO4中SO4來源于H2SO4,所以反應物中應補充2個H2SO4,最后檢查H、O原子守恒,方程式左邊10個O,右邊8個O,根據()原子守恒應在方程式右邊補充2個H2O。MnO2+MnS+2H2 SO4 -2MnSO4+S+2H2O。
例2的思維模型:
三,書寫陌生電極反應式
1.書寫陌生電極反應式的思維模型。
2.書寫陌生電極反應式的典例剖析。
例3 PbO2可以通過石墨為電極,Pb(NO3)2和Cu(NO3)2的混合溶液為電解液電解制取。陽極發生反應的電極反應式為_____。
答案:Pb2+ +2H2O- 2e - ==PbO2↓+4H+
解析:第一步:由信息可以看出實驗目的是運用電解原理制取產物Pb02,反應原料為Pb(NO3)2中的Pb2+。再根據陽極失電子化合價升高的規律,可以分析出陽極的反應物為Pb2+,產物為PbO2沉淀,列式:
Pb2+==PbO2↓
第二步:標出變價元素的化合價,Pb2+中Pb從+2價升高到+4價的PbO2,化合價升高2,失去2個電子。
Pb2+-2e--PbO2↓。
第三步:分析第二步的式子“Pb2+2e- ==PbO2↓,左邊帶4個單位正電荷,右邊不帶電荷。又由于Pb(NO3)2和Cu(NO3)2的混合溶液為電解液不是堿性或強堿性環境,則反應時無大量的OH可以被消耗,因而不能在反應物中補充OH來使反應式左右兩邊的電荷數相等,只能在反應式的右邊補充4個H+來滿足電荷守恒。
Pb2+2e--PbO2↓+4H+。
第四步:檢查各原子是否守恒,先查Pb原子已經守恒,最后檢查H、O原子守恒,在反應式左邊補2個H2O。答案為Pb2++2H2O- 2e- -PbO2↓+4H+.
例3的思維模型:
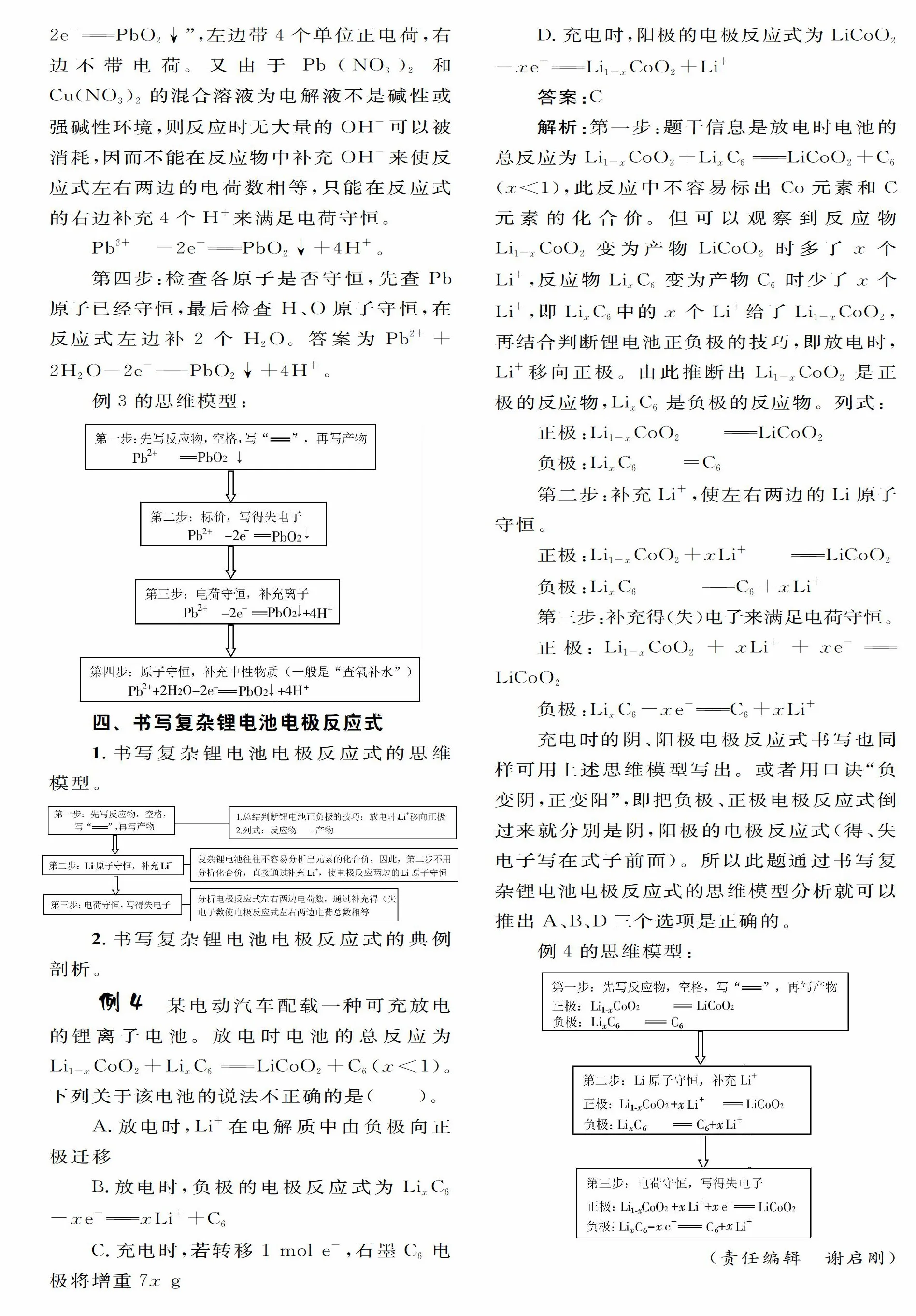
四,書寫復雜鋰電池電極反應式
1.書寫復雜鋰電池電極反應式的思維模型。
2.書寫復雜鋰電池電極反應式的典例剖析。
。
充電時的陰、陽極電極反應式書寫也同樣可用上述思維模型寫出。或者用口訣“負變陰,正變陽”.即把負極、正極電極反應式倒過來就分別是陰,陽極的電極反應式(得、失電子寫在式子前面)。所以此題通過書寫復雜鋰電池電極反應式的思維模型分析就可以推出A、B、D三個選項是正確的。
例4的思維模型:

