2020年普通高等學校招生全國統一考試(新課標Ⅲ卷)理科綜合化學試題及考查目標分析









【試題部分】(以原試卷題號為序)
可能用到的相對原子質量:H 1 B ll C 12 N 14 O16 Na 23 Al 27CI 35.5 Fe 56 Ni 59 Cu 64
一、選擇題:本題共7小題,每小題6分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
7.宋代《千里江山圖》描繪了山清水秀的美麗景色,經歷千年色彩依然,其中綠色來自孔雀石顏料(主要成分為Cu(OH)2. CuCO3),青色來自于藍銅礦顏料(主要成分為Cu(OH)2.2CuCO3)。下列說法錯誤的是(
)。
A.保存《千里江山圖》需控制溫度和濕度
B.孔雀石、藍銅礦顏料不易被空氣氧化
C.孔雀石、藍銅礦顏料耐酸耐堿
D.Cu(OH)2 . CuCO3中銅元素的質量分數大于Cu(OH)2 . 2CuCO3中銅元素的質量分數
8.金絲桃苷是從中藥材中提取的一種具有抗病毒作用的黃酮類化合物,結構式如下:
下列關于金絲桃苷的敘述,錯誤的是(
)。
A.可與氫氣發生加成反應
B.分子含21個碳原子
C.能與乙酸發生酯化反應
D.不能與金屬鈉反應
9.NA是阿伏加德羅常數的值。下列說法正確的是( )。
A. 22.4 1(標準狀況)氮氣中含有7NA個中子
B.1 mol重水比1 mol水多NA個質子
C.12 g石墨烯和12 g金剛石均含有NA個碳原子
D.1 L 1 mol . L-1 NaCI溶液含有28NA個電子
10.噴泉實驗裝置如圖1所示。應用下列各組氣體溶液,能出現噴泉現象的是( )。
11.對于下列實驗,能正確描述其反應的離子方程式是(
)。
該電池工作時,下列說法錯誤的是(
)。
A.負載通過0. 04 mol電子時,有0. 224 L(標準狀況)O2參與反應
B.正極區溶液的pH降低,負極區溶液的pH升高
C.電池總反應為4VB2+11O2 +20OH+6H2O ==8B(OH)4 +4VO3
D.電流由復合碳電極經負載、VB2電極、KOH溶液回到復合碳電極
13.W、X、Y、Z為原子序數依次增大的短周期元素,四種元素的核外電子總數滿足X+Y=W+Z;化合物XW3與WZ相遇會產生白煙。下列敘述正確的是(
)。
A.非金屬性:W>X>Y>Z
B.原子半徑:Z>Y>X>W
C.元素X的含氧酸均為強酸
D.Y的氧化物水化物為強堿
二、非選擇題:共58分。第26-28題為必考題,每個試題考生都必須作答。第35-36題為選考題,考生根據要求作答。
(一)必考題:共43分。
26. (14分)氯可形成多種含氧酸鹽,廣泛應用于殺菌、消毒及化工領域。實驗室中利用如圖3所示裝置(部分裝置省略)制備KC1O3和NaCIO,探究其氧化還原性質。
回答下列問題:
(l)盛放MnO2粉末的儀器名稱是____ ,a中的試劑為____。
(2)b中采用的加熱方式是____。c中化學反應的離子方程式是 ____ ,采用冰水浴冷卻的目的是_____。
(3)d的作用是____,可選用試劑(填標號)。
A. Na2S
B.NaCI
C.Ca(OH)2
D.H2SO4
(4)反應結束后,取出b中試管,經冷卻結晶,____ ,____ ,干燥,得到KClO3晶體。
(5)取少量KCIO3和NaCIO溶液分別置于1號和2號試管中,滴加中性KI溶液。1號試管溶液顏色不變。2號試管溶液變為棕色,加入CC14振蕩,靜置后CC14層顯色。可知該條件下KC1O3的氧化能力(填“大于”或“小于”)NaCIO。
27.(1 5分)某油脂廠廢棄的油脂加氫鎳催化劑主要含金屬Ni、Al、Fe及其氧化物,還有少量其他不溶性物質。采用如下工藝流程回收其中的鎳制備硫酸鎳晶體(NiSO4 . 7H2O)。
溶液中金屬離子開始沉淀和完全沉淀的pH如表1所示。
回答下列問題:
(1)“堿浸”中NaOH的兩個作用分別是____。為回收金屬,用稀硫酸將“濾液①”調為中性,生成沉淀。寫出該反應的離子方程式:_____ 。
(2)“濾液②”中含有的金屬離子是 ____ 。
(3)“轉化”中可替代H2 O2的物質是_____ 。若工藝流程改為先“調pH”后“轉化”,含有的雜質離子為____ 。
(4)利用上述表格數據,計算Ni( OH)2的Ksp=____ (列出計算式)。如果“轉化”后的溶液中Ni2+濃度為1.0 mol . L-1,則“調pH”應控制的pH范圍是____ 。
(5)硫酸鎳在強堿溶液中用NaCIO氧化,可沉淀出能用作鎳鎘電池正極材料的NiOOH。寫出該反應的離子方程式:____ 。
(6)將分離出硫酸鎳晶體后的母液收集、循環使用,其意義是_____ 。
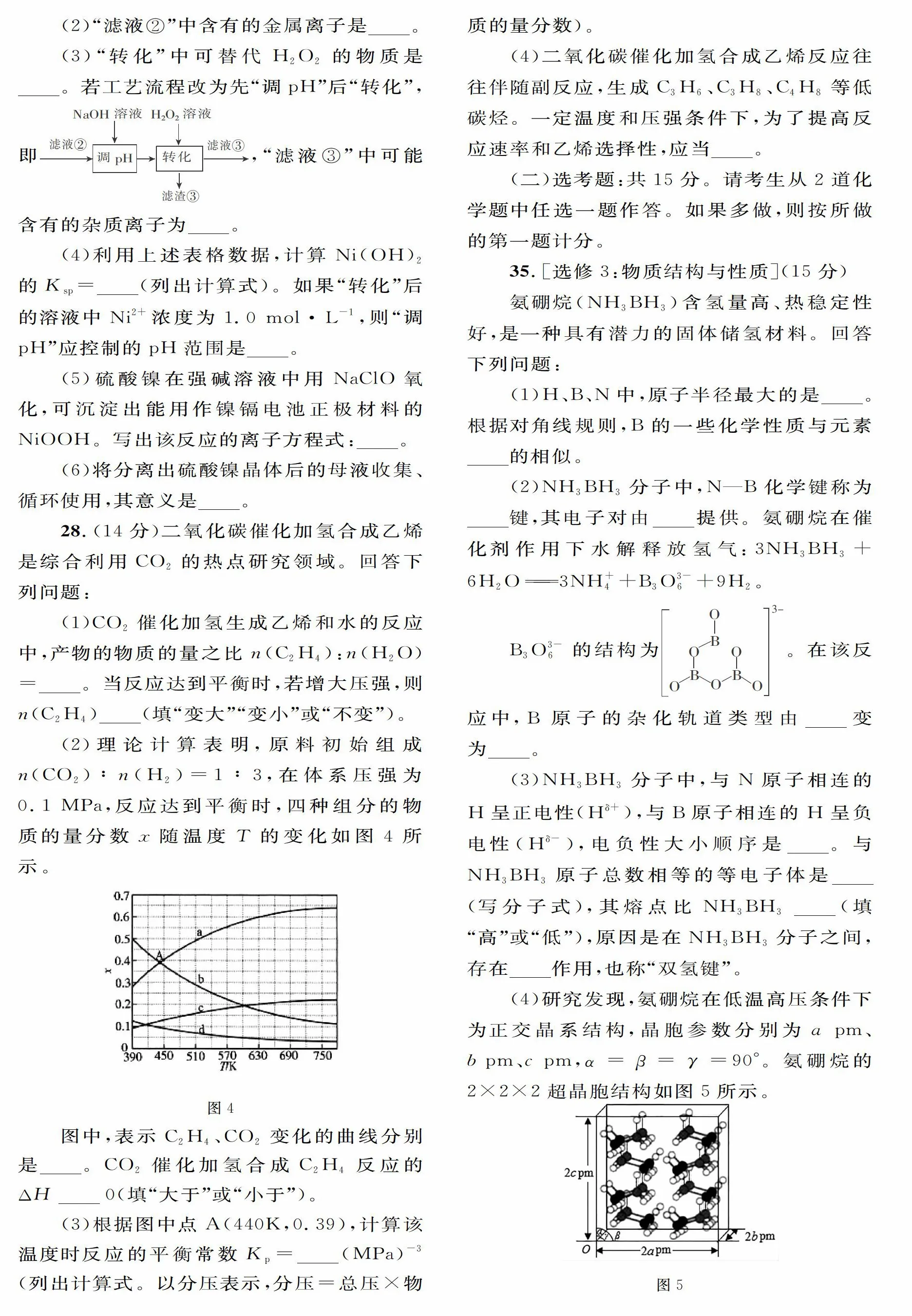
28. (14分)二氧化碳催化加氫合成乙烯是綜合利用CO2的熱點研究領域。回答下列問題:
(1)CO2催化加氫生成乙烯和水的反應中,產物的物質的量之比n( C2H4):N(H2 O)=____ 。當反應達到平衡時,若增大壓強,則n(C2 H4) _____(填“變大”“變小”或“不變”)。
(2)理論計算表明,原料初始組成n(CO2):n(H2)=1:3,在體系壓強為0.1 MPa,反應達到平衡時,四種組分的物質的量分數z隨溫度T的變化如圖4所示。
圖中,表示C2 H4、CO2變化的曲線分別是___。CO2催化加氫合成C2 H4反應的△H____0(填“大于”或“小于”)。
(3)根據圖中點A(440K,0.39),計算該溫度時反應的平衡常數Kp=____( MPa)-3(列出計算式。以分壓表示,分壓一總壓×物質的量分數)。
(4)二氧化碳催化加氫合成乙烯反應往往伴隨副反應,生成C3H6、C3 H8、C4 H8等低碳烴。一定溫度和壓強條件下,為了提高反應速率和乙烯選擇性,應當____ 。
(二)選考題:共15分。請考生從2道化學題中任選一題作答。如果多做,則按所做的第一題計分。
35.[選修3:物質結構與性質](15分)
氨硼烷( NH3 BH3)含氫量高、熱穩定性好,是一種具有潛力的固體儲氫材料。回答下列問題:
(l)H、B、N中,原子半徑最大的是____ 。根據對角線規則,B的一些化學性質與元素_____的相似。
(3) NH3BH3分子中,與N原子相連的H呈正電性(Hδ+),與B原子相連的H呈負電性( Ha-),電負性大小順序是_____ 。與NH3BH3原子總數相等的等電子體是___(寫分子式),其熔點比NH3BH3 ____ (填“高”或“低”),原因是在NH3BH3分子之間,存在_____作用,也稱“雙氫鍵”。
(4)研究發現,氨硼烷在低溫高壓條件下為正交晶系結構,晶胞參數分別為a pm、6 pm、c pm,a=β=γ=90°。氨硼烷的2×2×2超晶胞結構如圖5所示。
氨硼烷晶體的密度ρ= ___ g· cm-3(列出計算式,設NA為阿伏加德羅常數的值)。
36.[選修5:有機化學基礎](15分)
苯基環丁烯酮(◇=O PCBO)是一種十分活潑的反應物,可利用它的開環反應合成一系列多官能團化合物。近期我國科學家報道用PCBO與醛或酮發生[4+2]環加成反應,合成了具有生物活性的多官能團化合物(E),部分合成路線如下:
回答下列問題:
(1)A的化學名稱是_____ 。
(2)B的結構簡式為____ 。
(3)由C生成D所用的試劑和反應條件為 ____;該步反應中,若反應溫度過高,C易發生脫羧反應,生成分子式為C8 H8 O2的副產物,該副產物的結構簡式為____ 。
(4)寫出化合物E中含氧官能團的名稱:____。E中手性碳(注:連有四個不同的原子或基團的碳)的個數為____。
(5)M為C的一種同分異構體。已知:1 mol M與飽和碳酸氫鈉溶液充分反應能放出2 mol二氧化碳;M與酸性高錳酸鉀溶液反應生成對苯二甲酸。M的結構簡式為_____。
請找出規律,并解釋原因:_____ 。
【參考答案及解析部分】
2020年普通高等學校招生全國統一考試(新課標Ⅲ卷)理科綜合化學試題參考答案與解析
一、選擇題:本題共7小題,每小題6分,共42分。
7.C
考查目標及解析:
本題以古代字畫使用的顏料為素材,考查物質轉化的認識角度(價態和物質類別角度),考查宏微結合的素養水平。
選項A正確,Cu( OH)2.CuCO3和Cu(OH)2 - 2CuCO3 受熱易分解,Cu(OH)2 - 2CuC03吸濕后放出CO2,轉化為Cu(OH)2 . CuCO3,因此需在適宜的溫度和濕度下保存字畫。
選項B正確,由孔雀石和藍銅礦顏料的化學式可知,其中銅元素和碳元素均處于最高價態,不易發生氧化反應。
選項C錯誤,由孔雀石和藍銅礦顏料的化學式可知,兩者均易與酸發生反應生成相應的銅鹽,因此,用其制作的顏料不耐酸腐蝕。
選項D正確,因為氫氧化銅中銅元素的質量分數大于碳酸銅中銅元素的質量分數,所以Cu( OH)2. CuCO3中銅元素的質量分數大于Cu(OH)2 . 2CuCO3中銅元素的質量分數。
8.D
考查目標及解析:
本題以中藥材中的某種成分為素材,考查對有機物結構簡式和不同官能團性質的認識能力,考查宏微結合與證據推理等核心素養。
根據圖中結構簡式可知,該分子含有21個碳原子,官能團有碳碳雙鍵、苯環和羰基,因此在一定條件下可與氫氣發生加成反應;同時官能團還含有 - OH,因此可以與乙酸發生酯化反應,也可以與金屬鈉發生反應生成氫氣。綜合以上分析,選項A、B、C正確,選項D錯誤。
9.C
考查目標及解析:
本題以不同宏觀物質中微觀粒子數的判斷為載體,考查對NA的認識和運用能力,考查宏微結合素養。
選項A錯誤,標準狀況下22.4 L氮氣的物質的量為1 mol,若該氮氣分子中的氮原子全部為14N,則每個N2分子含有(14- 7)×2=14個中子,1 mol該氮氣含有l4NA個中子,不是7NA,且構成該氮氣的氮原子種類并不確定,無法準確計算其中子數。
選項B錯誤,重水分子和水分子都是由兩個氫原子和一個氧原子構成的,當重水分子和水分子的物質的量均為1 mol時,所含質子數相同,而重水分子中子數比水分子多2NA個。
選項C正確,石墨烯和金剛石均為碳單質,12 g石墨烯和12g金剛石均相當于12 g碳原子,碳原子物質的量為12g/12g.mol-1= 1 mol,所含碳原子數目為N A個。
選項D錯誤,1 mol NaCI中含有28NA個電子,但該溶液中除NaCI外,水分子中也含有電子。
10.B
考查目標及解析:
本題以噴泉實驗為情境素材,以元素化合物基本知識為載體,考查模型建構與認知能力、實驗操作與探究能力及其素養水平。
解題的關鍵是“形成噴泉最根本的原因是瓶內外存在壓強差”,在本題中,若氣體能與溶液反應且不再產生新氣體,則能達到圓底燒瓶內壓強減小,與大氣壓形成壓強差的效果。具體分析可知,稀鹽酸與H2S不反應,NO與稀硫酸不反應,CO2與飽和NaHC03溶液不反應,均無法形成壓強差,選項A、C、D錯誤。稀氨水與HCI發生酸堿中和:NH4 . H2O+ HCI=NH4CI+ H2O,氣體分子數明顯減小,可以形成壓強差,選項B正確。
11.A
考查目標及解析:
本題以離子反應方程式的正誤判斷為載體,考查元素化合物的知識和離子反應原理,考查宏微結合素養。
選項A正確,用Na2 SO3溶液吸收少量的C12,Cl2具有強氧化性,可將部分S02-氧化為SO2-,同時產生的H+與剩余部分SO2-結合生成HSO3,Cl2被還原為Cl,反應的離子反應方程式為3SO2-+ Cl2+H2O==2HSO3 +2CI- +SO2-。
選項B錯誤,向CaC12溶液中通人CO2,若反應則有CaC12+CO2+H2O==CaCO2↓++2HCI,而鹽酸能將碳酸鈣沉淀溶解,故不發生反應。
選項C錯誤,向H2 O2中滴加少量的FeCI3,Fe3+的氧化性弱于H2 O2,不能氧化H2O2,但Fe3+能催化H7O2的分解,正確的
Fe3+離子方程式應為2H2O2——2H2O+O2↑。
選項D錯誤,NH4HSO4電離出的H+優先和NaOH溶液反應,同濃度同體積的NH4HSO4溶液與NaOH溶液混合,氫離子和氫氧根恰好完全反應,正確的離子反應方程式應為H++OH—=H2O,當NaOH溶液過量時,發生反應NH++H++2O ==NH3.H2O+H2O。
12.B
考查目標及解析:
本題以堿性硼化釩 空氣電池為素材,考查了電極判斷、溶液酸堿性變化、電極反應式的書寫以及定量計算、電流的流向和化學方程式的書寫等能力,考查變化觀念與平衡思想,以及證據推理與模型認知的素養水平。
依據題意,該裝置為原電池裝置。根據VB2電極反應VB2+16OH
- 11e—=VO2-+2B(OH)4+4H2O,可知VB2電極為負極,負極反應消耗OH-,負極溶液pH減小;復合碳電極為正極,電極反應為O2+2H 2O+4e==4OH,轉移0.04 mol電子時,消耗0.01 molO2,即標準狀況下0. 224 LO2。結合正負極電極反應式,推出總反應為4VB2+11O2+20OH+6H2O=8B(OH)4 +4VO4-。化學電源工作時,電流沿外電路從正極流向負極,再從內電路流回正極,綜上所述,選項A、C、D正確,選項B錯誤。
13.D
考查目標及解析:
本題考查元素周期表和元素周期律相關知識,解題時需根據題目中相關信息推斷出元素的種類。
由題干,化合物XW3與WZ相遇會產生白煙,可推測“白煙”為NH4CI。進一步推測XW3為NH3,WZ為HCI。則W為H,X為N,Z為CI。最后根據“核外電子總數滿足X+Y=W+Z”,推出Y的核外電子總數為11,則 Y為Na。
選項A錯誤,非金屬性的順序應為Z>X>W>Y。
選項B錯誤,原子半徑的順序應為Y>Z>X>W。
選項C錯誤,N的含氧酸有強酸如硝酸(HNO3),弱酸如亞硝酸(HNO2)。
選項D正確,Y為Na,其氧化物水化物為hBT9Z7HRQjhdUfAvRhoeGg==NaOH,屬于強堿。
二、非選擇題:共58分。第26-28題為必考題,每個試題考生都必須作答。第35-36題為選考題,考生根據要求作答。
(一)必考題:共43分。
26.答案及解析:
本題以氯氣、KC103和NaCIO的制備及其氧化還原性質的探究為主題,考查常見氣體的制備與除雜、尾氣處理等一般流程,考查實驗的基本操作、儀器識別、性質檢驗等基礎知識,考查實驗操作與探究能力素養。
解題時,首先需明確實驗目的及常見氣體制備除雜和尾氣處理等一般流程,結合裝置圖分析各儀器的作用,繼而根據題意分析裝置目的,完成相關實驗操作等。
(1)圓底燒瓶 飽和食鹽水
考查基本儀器的識別與物質的分離提純。第一空,根據盛放MnO2粉末的儀器結構可知該儀器為圓底燒瓶;第二空,聯系前后裝置可知,在后續操作中氯氣需與堿溶液反應制備物質,為提高堿溶液的轉化率,氯氣中不能再混有酸性氣體,a中溶液只能選擇飽和食鹽水以除去氯氣中混有的HCI氣體。
(2)水浴加熱 Cl2+2OH==CIO-+CI- +H2O避免生成NaC1O3
考查實驗基本操作、反應原理、操作目的等。第一空,根據裝置圖可知盛有KOH溶液的試管放在盛有水的大燒杯中加熱,該加熱方式為水浴加熱;第二空,c中氯氣在NaOH溶液中發生歧化反應生成氯化鈉和次氯酸鈉,結合元素守恒可得離子方程式為C12+20H- -CIO+Cl-+ H2O;第三空,根據氯氣與KOH溶液的反應可知,加熱條件下氯氣可以和強堿溶液反應生成氯酸鹽,所以冰水浴的目的是避免生成NaC103。
(3)吸收C12尾氣,防止污染環境AC
考查常見氣體制備的一般流程、裝置的目的分析以及試劑的選擇。第一空,氯氣有毒,所以d裝置的作用是吸收尾氣(C12),防止污染環境。第二空,Na2S可以將氯氣還原成氯離子,可以吸收氯氣,故A項可選;氯氣在NaCI溶液中溶解度很小,無法吸收氯氣,故B項不可選;氯氣可以與Ca(OH)2濁液反應生成氯化鈣和次氯酸鈣,故C項可選;氯氣與硫酸不反應,且硫酸溶液中存在大量氫離子會降低氯氣的溶解度,故D項不可選。
(4)過濾少量(冷)水洗滌
考查物質分離提純的基本操作。b中試管中溶液為KC1O3和KCI的混合溶液,KCIO3的溶解度受溫度影響更大,所以將b中試管中的混合溶液冷卻結晶,過濾,少量(冷)水洗滌,干燥,得到KC1O3晶體。
(5)紫小于
考查探究物質氧化還原性質的能力及現象分析能力。1號試管溶液顏色不變,2號試管溶液變為棕色,說明1號試管中氯酸鉀沒有將碘離子氧化,2號試管中次氯酸鈉將碘離子氧化成碘單質,即該條件下KC103的氧化能力小于NaCIO;碘單質更易溶于CC14,所以加入CCI4振蕩,靜置后CCI4層顯紫色。
27.答案及解析:
本題以廢棄油脂中鎳的回收再利用制備硫酸鎳晶體的化學工藝為主題,通過給出具體的工藝流程圖及相關信息,考查流程分析能力、外加試劑作用的分析能力、計算能力等,考查變化觀念與平衡思想、證據推理素養水平。解題時可從流程線、物質線、操作線這三線人手,對應分析各步驟流程的目的,外加試劑的作用以及相關操作的意義。
(1)除去油脂,溶解鋁及其氧化物AI(OH)4+H+==Al(OH)3↓+H2O
考查化工流程的分析能力,外加試劑作用的分析能力。第一空,考查原料預處理的方法以及元素化合物性質相關的物質轉化關系的分析。化工工藝中常用熱堿溶液去除廢舊金屬表面的油污,故由工藝流程分析可得,向廢鎳催化劑中加入NaOH溶液進行堿浸,可以去除表面油污。同時由廢鎳催化劑的成分可知Al及其氧化物可以溶于NaOH溶液。第二空,需從流程中分析出“濾液①”的主要成分為Na[AI(OH)4](或NaAIO2),加入稀硫酸可發生Al( OH)-+H+==AI(OH)3↓+H2O或AlO2+H++ H2O==Al(OH)3↓,生成沉淀,從而達到回收金屬的目的。
(2)Ni2+、Fe2+、Fe3+
考查化工流程中物質線的分析能力。結合題干信息,“濾餅①”中的主要成分為Ni、Fe及其氧化物,加入稀硫酸,Ni、Fe及其氧化物溶解,所以“濾液②”中含有的金屬陽離子為Ni2+、Fe2+、Fe3+。
(3)O2或空氣Fe3+
考查化工流程中外加試劑的作用以及反應條件控制的分析能力,也是對元素化合物的性質、氧化還原反應相關原理等基礎知識的綜合考查。第一空,結合化工流程中物質的變化關系可知,“轉化”步驟中H7O2的作用是將Fe2+氧化為Fe3+,以便于在后續步驟中轉化為Fe( OH)3沉淀除去,所以能替代H2O2的須為強氧化劑,同時考慮不引入雜質,所以可用O2或空氣代替。第二空,若將工藝流程改為先“調pH”后“轉化”,會使調pH過濾后的溶液中含有Fe2+,則濾液③中可能含有轉化生成的Fe3+。
考查陌生氧化還原方程式書寫的能力。由題干信息可知,硫酸鎳在強堿溶液中被NaCIO氧化得到NiOOH沉淀,即Ni2+被氧化為NiOOH,又根據氧化還原反應規律可得,CIO被還原為CI-,則結合氧化還原得失電子守恒及電荷守恒、原子守恒可得離子方程式2Ni2++ CIO-+4 OH==2NiOOH ↓+CI- +H2O。
(6)提高鎳回收率
考查流程與操作意義的分析能力。通過結晶的方式獲得硫酸鎳晶體后,母液中還含有NiO+,將其收集后循環使用,可以提高鎳的回收率。本問要求考生具備化工生產的效益觀念,通過對母液成分的分析考慮循環使用的意義。
28.答案及解析:
本題以二氧化碳催化加氫合成乙烯為主題,考查該反應涉及的化學反應原理,考查外界因素對化學反應速率、化學平衡等的影響,KP的相關計算等,考查變化觀念與平衡思想等素養水平。
(1)1:4變大
考查陌生方程式的書寫以及平衡移動方向的判斷。第一空,根據題意,CO2催化加氫生成乙烯和水的化學方程式可表示為2CO2+6H2→CH2=CH2+4H2O,可得n(C2H4):n(H2O) =1:4,或者用原子守恒法,反應物Co。中的碳原子和氧原子分別去到了生成物乙烯和水中,由n(C):n(O)=1:2,也可推出n(C2H4):n(H2O) =1:4。第二空,考查壓強對平衡移動的影響,由于該反應是氣體分子數減少的反應,若增大壓強,則化學平衡向正反應方向移動,n(C2 H4)變大。
(2)d、c 小于
考查外界條件對平衡移動的分析能力和數形結合能力。第一空,由題中信息可知,兩反應物的初始投料之比等于化學計量數之比,由于消耗的n (CO2)和n(H2)之比為1:3,因此平衡時n(CO2):n( H2)始終等于1:3且同時增大或同時減小,產物中n(C2H4):n(H2O)始終等于1:4,也同時增大或同時減小,由圖中曲線的起點坐標可知,c和a所表示的物質的物質的量分數之比為1:3,故a為H2,c為CO2;d和b表示的物質的物質的量分數之比為1:4,則b為H2O,d為C2 H4。第二空,由圖中曲線的變化趨勢可知,升高溫度,乙烯的物質的量分數減小,則化學平衡向逆反應方向移動,可知該反應為放熱反應,△H小于0。
(4)選擇合適的催化劑等
考查運用平衡移動的影響因素來分析實際問題的能力。本題已經限制在“一定的溫度和壓強”條件下,因此為了提高反應速率,最常用的方法為使用催化劑,工業上通常通過選擇合適的催化劑,以加快化學反應速率,同時還可以提高目標產品的選擇性,減少副反應的發生。由于參加反應的物質均為氣態,不存在接觸面積的影響,因此選擇改變二氧化碳或氫氣的用量,副反應往往也有著同步變化,不能很好地體現選擇性。
(二)選考題:共15分。請考生從2道題中任選一題作答。如果多做,則按所做的第一題計分。
35.答案及解析:
本題以儲氫材料氨硼烷(NH3BH3)為載體,圍繞N、B、H等元素考查原子、分子與晶體結構的必備知識,考查從物質的材料性能角度分析整合信息并形成解題思路的能力,考查宏微結合、證據推理與模型認知素養水平。
(l)B Si(硅)
考查原子半徑大小比較和元素周期律中對角線規則的理解。第一空,H為元素周期表中原子半徑最小的原子,B與N同屬一個周期,原子半徑從左到右逐漸減小,故可得半徑最大的原子為B。第二空,對角線規則只存在于周期表第二與第三周期中處于對角線位置的元素之間,如Li與Mg、Be與Al、B與Si,這些“元素對”的一些化學性質相似。
故可知NB化學鍵為配位鍵,且N提供電子對,B提供空軌道。氨硼烷在催化劑作用下水解之后形成B3O3-,由題中結構式可知B的雜化軌道類型為sp2。故在該反應中B原子的雜化軌道類型由sp3變為sp2。
(3)N>H>B CH3 CH3 低 Ha+與Ha的靜電引力
考查電負性大小的判斷、等電子體的書寫、熔點高低的比較與“雙氫鍵”,考查知識遷移與信息分析能力。第一空,在氨硼烷分子中,與N原子相連的H原子呈正電性,說明H的電負性小于N;與B原子相連的H原子呈負電性,說明H的電負性大于B,故可推知電負性由大到小的順序為N>H>B。第二空,NH3BH3分子為八核分子,價電子總數為14,依據最常見的價電子數原子替換規律,可以寫出等電子體CH3 CH3。第三空,由于NH3BH3與CH3CH3同屬分子晶體,且兩者相對分子質量相近,故應從分子極性考慮其熔點的高低。NH3 BH3屬于極性分子,CH3CH3屬于非極性分子,極性分子的分子間作用力較大,故CH3CH3熔點比NH3BH3的低。第四空,雙氫鍵是一種特殊的氫鍵作用形式,指帶有正電的氫原子(如與N、O、F等電負性較強的原子相連的H)與帶有負電的氫原子(如與金屬、B等原子相連的H)之間的靜電吸引作用,也正是由于這種Ha+與Ha的靜電引力使得氨硼烷分子具有極性,使其熔點較高。
36.答案及解析:
本題以苯基環丁烯酮與醛或酮的[4+2]環加成反應合成具有生物活性的多官能團化合物為背景素材,通過給出部分合成路線,考查有機基礎知識及分析推斷能力,考查宏微結合、變化觀念與證據推理素養水平。
(1)2一羥基苯甲醛(水楊醛)
考查有機化合物的系統命名法。難點在于判斷母體是苯甲醛還是苯酚,根據官能團的優先順序規則,-CHO>-OH,因此母體為苯甲醛,羥基為取代基。
考查有機合成過程中間產物結構的推導,側重于考查對有機物碳骨架變化的推斷,以及陌生反應機理的理解。
考查常見反應類型、反應條件的判斷和信息分析與推理能力。第一空,C生成D為酯化反應,根據碳原子數目變化可知參與酯化反應的另一物質是乙醇,由此可得答案為“乙醇、濃硫酸/加熱”;第二空,由“脫羧反應”及分子式C8 H8 O2可知,C僅脫去羧基,可得
(4)羥基、酯基2
考奎常見官能團與手性碳原子的辨識。第一空,注意題干要求寫出含氧官能團,因此只有羥基和酯基。第二空,根據手性碳原子
考查限定條件的同分異構體的書寫,需要熟悉常見官能團性質,進而進行官能團的推斷。M為C(Cg H8 O4)的一種同分異構體,1 mol M與飽和NaHCO3溶液反應能放出2 mol二氧化碳,則M中含有兩個羧基(COOH),又M與酸性高錳酸鉀溶液反應生成對二苯甲酸,則M分子苯環上只有兩個取代基且處于對位,綜合以上信息可知M含1個苯環、2個COOH和1個飽和碳原子,組合可得 M 的結構簡式為
(6)隨著R’體積增大,產率降低;原因是R’體積增大,位阻增大
考查對新信息進行提取并探究規律的能力。由表格數據分析可得到規律,隨著取代基R’碳原子數目的增加,產物的產率降低,出現此規律的原因可能是因為R’隨碳原子數目增加而造成體積增大,從而位阻增大,導致產率降低。
(責任編輯謝啟剛)

