鹽杜仲標準湯劑制備及指紋圖譜研究
許懷禮,徐頂巧,唐志書,宋忠興,張君威,蘇彪,許洪波
論著·中藥研究與開發
鹽杜仲標準湯劑制備及指紋圖譜研究
許懷禮1,徐頂巧2,唐志書1,宋忠興1,張君威1,蘇彪1,許洪波1
1.陜西中醫藥大學,陜西中藥資源產業化省部共建協同創新中心,秦藥特色資源研究開發國家重點實驗室(培育),陜西省創新藥物研究中心,陜西 咸陽 712083;2.陜西中醫藥大學藥學院,陜西 咸陽 712083
制備鹽杜仲標準湯劑并建立質量標準。制備15批鹽杜仲標準湯劑,以松脂醇二葡萄糖苷為指標成分,計算出膏率、指標成分含量和轉移率,并建立超高效液相色譜指紋圖譜分析方法,使用《中藥色譜指紋圖譜相似度評價系統》進行相似度評價,采用超高效液相色譜-四級桿-飛行時間-串聯質譜技術對共有峰進行結構鑒定。15批鹽杜仲標準湯劑中松脂醇二葡萄糖苷轉移率為42.74%~71.43%,平均為57.26%。15批鹽杜仲標準湯劑指紋圖譜與對照指紋圖譜相似度均大于0.95。指紋圖譜共有峰9個,確認分別為梓醇、杜仲醇苷、京尼平苷酸、車葉草苷酸、綠原酸、olivil-4’---D-glucopyranoside、京尼平、松脂醇二葡萄糖苷和紫云英苷。本研究建立的鹽杜仲標準湯劑制備工藝穩定,指紋圖譜方法精密度、穩定性及重復性良好,可為鹽杜仲配方顆粒的質量控制提供參考。
鹽杜仲;標準湯劑;指紋圖譜;松脂醇二葡萄糖苷
杜仲為杜仲科植物杜仲Oliv.的干燥樹皮,具有補肝腎、強筋骨、安胎功效[1]。現代藥理研究表明,杜仲具有防治骨質疏松[2]、降血壓[3]、降血糖[4]、降脂減肥[5]、抗老年癡呆和提升性功能[6]等作用。杜仲主要含木質素[7]、環烯醚萜[8]、黃酮[9]、苯丙素[10]、酚酸類[11]和杜仲膠[12]等化學成分,其中木脂素類是杜仲的主要成分之一[12-13]。杜仲臨床常用飲片形式有杜仲、炒杜仲和鹽杜仲3種,2015年版《中華人民共和國藥典》(以下簡稱《中國藥典》)收錄含杜仲方劑36個,其中以鹽杜仲入藥18個。中醫認為,鹽制可引藥入腎經,更好地發揮杜仲補益肝腎的功效[14]。
中藥飲片標準湯劑是以中醫理論為指導、臨床應用為基礎,參考現代提取方法,經標準化工藝制備而成的單味中藥飲片水煎劑,用于標化臨床用藥,保障用藥的準確性和劑量的一致性[15-16]。中藥飲片標準湯劑可以作為一種標準物質,用于評價中藥配方顆粒從原料到成品之間的質量傳遞規律,從而為配方顆粒的研究和制備提供科學依據[17]。2019年,國家藥品監督管理局發布的《中藥配方顆粒質量控制與標準制定技術要求(征求意見稿)》明確指出:為使中藥配方顆粒能夠承載中藥飲片安全性、有效性,需要以標準湯劑為橋接,該標準湯劑為衡量中藥配方顆粒是否與臨床湯劑基本一致的物質基準。目前尚未見關于杜仲標準湯劑相關研究的報道,本研究選取臨床常用的鹽杜仲進行標準湯劑研究,以松脂醇二葡萄糖苷為指標成分,計算出膏率和轉移率,同時開展指紋圖譜研究,并結合超高效液相色譜-四級桿-飛行時間-串聯質譜(UPLC-Q-TOF-MS/MS)技術對其主要共有峰進行確認,從指標成分和整體角度對鹽杜仲標準湯劑進行質量評價,為鹽杜仲標準湯劑的制備及其配方顆粒質量標準的制定提供參考。
1 儀器與試藥
LC-20XR高效液相色譜系統(含CBM-20A控制器、LC-20AD雙泵、SPD-M20A紫外檢測器、CTO-20AC柱溫箱、LC-solution色譜工作站),日本島津;Waters Xevo G2-XS QTOF質譜系統,美國沃特世公司;KQ-300DE型數控超聲波清洗器,昆山市超聲儀器有限公司;FTS-10A多功能煎藥鍋,航方中藥鍋煎藥壺;CPA2250型電子天平(精度0.01 mg),賽多利斯公司;EYELAN-1100旋轉蒸發儀,東京理化器械株式會社。
松脂醇二葡萄糖苷(純度>98%,批號S-047- 181216),成都瑞芬思生物科技有限公司;甲醇和乙腈均為色譜級,Honeywell;其余試劑均為分析純,水為純凈水。15批鹽杜仲飲片分別購自西安藥材市場和陜西興盛德藥業有限責任公司,經陜西中醫藥大學王繼濤高級實驗師鑒定,均為杜仲科植物杜仲Oliv.的干燥樹皮,具體信息見表1。
表1 15批鹽杜仲飲片來源信息
編號產地規格批號 編號產地規格批號 S1陜西鎮坪選20180302 S9貴州正安統20180902 S2陜西鎮坪選20180501 S10貴州正安統20181101 S3陜西鎮坪選20180802 S11四川廣元統20180402 S4陜西鎮坪選20180901 S12四川廣元統20180601 S5陜西鎮坪選20181102 S13四川廣元統20180701 S6貴州正安統20180301 S14四川廣元統20180902 S7貴州正安統20180601 S15四川廣元統20181001 S8貴州正安統20180801
2 方法與結果
2.1 一般檢查
依據2015年版《中國藥典》(四部)通則0832第二法測定水分,依據通則0512熱浸法測定醇溶性浸出物,依據2015年版《中國藥典》(四部)通則2302測定總灰分。結果15批鹽杜仲飲片水分為2.72%~8.46%,醇溶性浸出物為13.12%~22.06%,總灰分為5.48%~6.35%,均符合2015年版《中國藥典》(一部)對鹽杜仲飲片的規定,見表2。
表2 15批鹽杜仲飲片水分、浸出物、總灰分測定結果(%)
編號水分浸出物總灰分 編號水分浸出物總灰分 S13.5114.286.20 S95.8013.505.48 S22.7217.846.15 S108.0714.475.61 S34.4722.066.26 S118.2113.755.89 S43.8420.336.35 S127.7013.126.32 S53.4517.916.11 S137.3614.616.03 S67.1216.655.71 S144.2314.555.71 S77.6713.335.51 S156.0015.165.96 S88.4614.975.93
2.2 飲片中松脂醇二葡萄糖苷含量測定
按2015年版《中國藥典》(一部)杜仲飲片項下含量測定方法,測得15批鹽杜仲中松脂醇二葡萄糖苷含量為0.107%~0.149%,表明15批樣品均符合《中國藥典》對鹽杜仲的含量測定要求(含松脂醇二葡萄糖苷的量不得少于0.10%)。
2.3 標準湯劑制備
取鹽杜仲飲片200 g,加10倍量水,浸泡30 min,迅速加熱至沸后轉小火煎煮30 min,趁熱用紗布過濾,收集濾液,再加8倍量水,繼續煎煮25 min,同法過濾,合并2次濾液并濃縮至1000 mL,即得濃度為0.2 g/mL的鹽杜仲標準湯劑。
2.4 標準湯劑中松脂醇二葡萄糖苷含量測定
2.4.1 色譜條件
采用Agilent 5 TC-C18色譜柱(250 mm×4.6 mm,5 μm),以乙腈-甲醇-水(11∶11∶88)為流動相,等度洗脫,柱溫30 ℃,檢測波長277 nm,進樣量5 μL。在此條件下,供試品溶液中的松脂醇二葡萄糖苷分離良好。色譜圖見圖1。
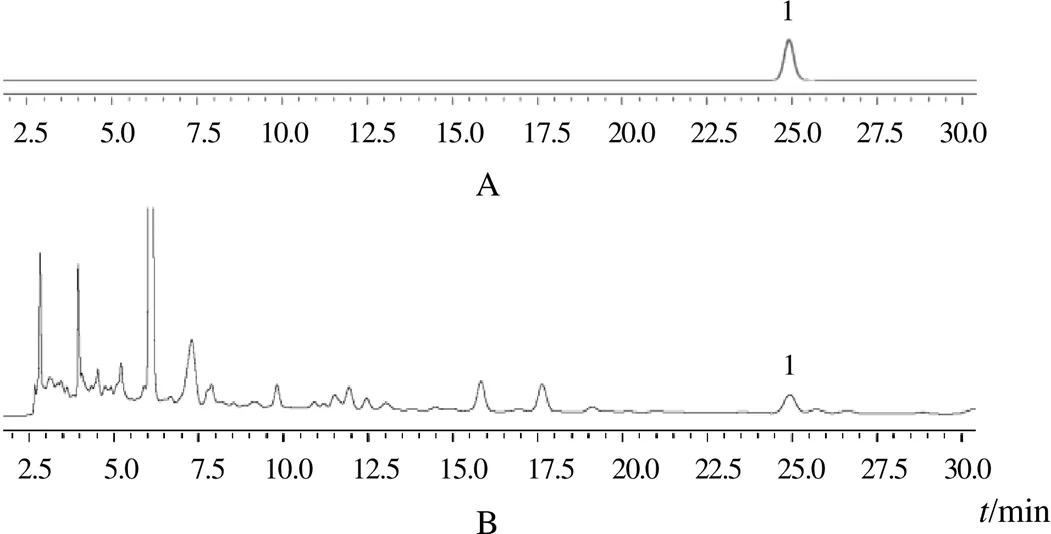
注:A.對照品;B.供試品;1.松脂醇二葡萄糖苷
2.4.2 供試品溶液制備
精密量取“2.3”項下標準湯劑10 mL,4000 r/min離心5 min,取上清液,過濾,取續濾液,即得。
2.4.3 對照品溶液制備
精密稱量4.99 mg松脂醇二葡萄糖苷,用50%甲醇定容至10 mL,即得0.499 mg/mL的松脂醇二葡萄糖苷對照品溶液。
2.4.4 線性關系考察
取對照品溶液,分別進樣0.2、0.5、1、2、3、5 μL,按“2.4.1”項下色譜條件測定,以對照品質量(μg)為橫坐標,峰面積為縱坐標,繪制標準曲線,得松脂醇二葡萄糖苷回歸方程=439 881-3329.5,=1,線性范圍為0.099 8~2.495 μg。
2.4.5 精密度試驗
取供試品溶液(S1),按“2.4.1”項下色譜條件連續測定6次,結果供試品溶液中松脂醇二葡萄糖苷峰面積RSD=0.22%,表明儀器精密度良好。
2.4.6 穩定性試驗
取供試品溶液(S1),分別于0、2、4、8、12、24 h按“2.4.1”項下色譜條件進行測定,結果供試品中松脂醇二葡萄糖苷峰面積RSD=2.45%,表明標準湯劑供試品溶液在24 h內穩定。
2.4.7 重復性試驗
取同一批標準湯劑樣品(S1),按“2.4.2”項下方法平行制備6份供試品溶液,分別按“2.4.1”項下色譜條件進行測定,結果松脂醇二葡萄糖苷峰面積RSD=2.77%,表明該方法重復性良好。
2.4.8 加樣回收率試驗
精密量取已知松脂醇二葡萄糖苷含量的標準湯劑(S1)6份,加入等量松脂醇二葡萄糖苷對照品,按“2.4.2”項下方法制備,按“2.4.1”項下色譜條件測定,結果見表3,表明該方法準確度良好。
表3 松脂醇二葡萄糖苷加樣回收率試驗
樣品中含量/mg加入量/mg測得量/mg回收率/%平均回收率/%RSD/% 0.1120.1120.235104.8104.21.93 0.1120.1110.223100.2 0.1120.1140.236104.6 0.1120.1090.234105.9 0.1120.1130.235104.3 0.1120.1100.233105.1
2.4.9 樣品測定
按“2.4.1”項下色譜條件對15批鹽杜仲標準湯劑進行測定。
2.5 出膏率及轉移率計算
按“2.3”項下方法制備標準湯劑,采用干燥稱量法獲得干膏質量,計算出膏率和指標成分轉移率。出膏率(%)=干膏質量(g)÷飲片質量(g)×100%。轉移率(%)=標準湯劑中含量÷飲片中含量×100%。15批鹽杜仲標準湯劑出膏率為4.75%~8.11%,平均為6.34%,標準偏差(SD)為1.08%。松脂醇二葡萄糖苷轉移率為42.74%~71.43%,平均為57.26%,SD為10.07%。結果見表4。
表4 15批鹽杜仲標準湯劑出膏率及指標成分轉移率測定結果(%)
編號出膏率松脂醇二葡萄糖苷 飲片中含量標準湯劑中含量轉移率 S17.800.1160.05648.28 S27.260.1490.06644.30 S37.140.1160.06757.76 S47.960.1240.06955.65 S58.110.1110.07870.27 S66.280.1070.06560.75 S75.150.1090.07366.97 S85.210.1170.05042.74 S95.720.1080.04844.44 S104.750.1110.05852.25 S116.070.1420.07049.30 S125.770.1190.08571.43 S136.590.1220.08166.39 S144.920.1320.07859.09 S156.360.1170.08169.23
2.6 指紋圖譜建立與分析
2.6.1 色譜條件
色譜柱為Waters XBridgeTMBEH C18(2.1 mm×150 mm,2.5 μm),流動相為水(A)-甲醇(B),梯度洗脫(0~10 min,3%~8%B;10~15 min,8%~12%B;15~20 min,12%~15%B;20~35 min,15%B;35~45 min,15%~25%B),檢測波長277 nm,柱溫30 ℃,流速0.4 mL/min,進樣量5 μL。
2.6.2 供試品溶液制備
按“2.4.2”項下方法制備,即得。
2.6.3 精密度試驗
取供試品溶液(S1),按“2.6.1”項下色譜條件進樣6次,記錄共有峰峰面積,結果共有峰峰面積RSD=0.86%,同時用相似度評價軟件計算指紋圖譜的相似度均大于0.99,表明儀器精密度良好[18]。
2.6.4 重復性試驗
取同一批標準湯劑(S1),按“2.4.2”項下方法平行制備6份供試品溶液,按“2.6.1”項下色譜條件進樣測定,記錄共有峰面積,同時用相似度評價軟件計算指紋圖譜相似度。結果共有峰峰面積RSD=2.64%,指紋圖譜相似度均大于0.99,表明方法重復性良好[19]。
2.6.5 穩定性試驗
取供試品溶液(S1),分別于0、2、4、8、12、24 h按“2.6.1”項下色譜條件進樣測定,結果共有峰峰面積RSD=1.83%,同時用相似度評價軟件計算指紋圖譜的相似度均大于0.99,表明標準湯劑供試品溶液在24 h內穩定性良好[18]。
2.6.6 指紋圖譜采集

表5 15批鹽杜仲標準湯劑指紋圖譜相似度
編號S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15R S11.0000.9970.9560.9900.9650.9710.9970.9870.9970.9530.9921.0000.9830.9560.9960.994 S20.9971.0000.9760.9810.9820.9870.9970.9930.9980.9700.9990.9980.9760.9680.9960.999 S30.9560.9761.0000.9160.9920.9900.9590.9840.9610.9940.9850.9600.9400.9850.9670.982 S40.9900.9810.9161.0000.9420.9510.9920.9560.9910.9040.9700.9910.9560.9050.9750.972 S50.9650.9820.9920.9421.0001.0000.9760.9750.9760.9740.9880.9710.9270.9610.9650.983 S60.9710.9870.9900.9511.0001.0000.9810.9780.9820.9720.9910.9770.9340.9600.9710.987 S70.9970.9970.9590.9920.9760.9811.0000.9801.0000.9470.9920.9990.9650.9440.9890.992 S80.9870.9930.9840.9560.9750.9780.9801.0000.9820.9880.9960.9870.9860.9900.9960.997 S90.9970.9980.9610.9910.9760.9821.0000.9821.0000.9500.9930.9990.9680.9480.9900.993 S100.9530.9700.9940.9040.9740.9720.9470.9880.9501.0000.9800.9540.9570.9980.9720.980 S110.9920.9990.9850.9700.9880.9910.9920.9960.9930.9801.0000.9940.9740.9770.9941.000 S121.0000.9980.9600.9910.9710.9770.9990.9870.9990.9540.9941.0000.9780.9540.9950.995 S130.9830.9760.9400.9560.9270.9340.9650.9860.9680.9570.9740.9781.0000.9700.9920.979 S140.9560.9680.9850.9050.9610.9600.9440.9900.9480.9980.9770.9540.9701.0000.9760.979 S150.9960.9960.9670.9750.9650.9710.9890.9960.9900.9720.9940.9950.9920.9761.0000.997 R0.9940.9990.9820.9720.9830.9870.9920.9970.9930.9801.0000.9950.9790.9790.9971.000
2.7 質譜分析
2.7.1 質譜條件
采用Waters Xevo G2-XS QTOF質譜儀,ESI離子源,離子化模式為正、負離子,離子源溫度500 ℃,脫溶劑氣體為氮氣,掃描范圍(m/z)為100~2000。
2.7.2 共有峰指認
使用Waters Xevo G2-XS QTOF系統對277 nm波長色譜圖中共有峰的結構進行鑒定。取供試品溶液1 μL,按“2.6.1”項下色譜條件測定,記錄質譜數據,采用MassLynx V4.2對各共有峰的相對分子質量、UV吸收、特征碎片和保留時間等數據進行分析,同時結合PeakView軟件中MasterView數據庫比對,以及SciFinder數據庫檢索,參考文獻[20-22]數據,鑒定了1~9號共有峰的結構,見表6。
表6 正離子模式下鹽杜仲標準湯劑共有指紋峰鑒定
峰號tR/min成分分子式相對分子質量m/z 1 4.64梓醇C15H22O10362.33363.042 4 2 5.99杜仲醇苷C15H26O9350.41349.075 5 3 6.09京尼平苷酸C16H22O10374.38375.156 4 4 8.24車葉草苷酸C18H24O12432.37433.346 6 511.07綠原酸C16H18O9354.31353.382 6 621.54olivil-4’-O-β-D-glucopyranosideC26H34O12538.54539.372 4 724.41京尼平C11H14O5226.23225.334 3 833.66松脂醇二葡萄糖苷C32H42O16682.67683.145 3 944.56紫云英苷C20H20O11448.38449.145 3
3 討論
《中藥配方顆粒質量控制與標準制定技術要求(征求意見稿)》強調標準湯劑是衡量中藥配方顆粒是否與單味中藥湯劑基本一致的物質基準。本研究共收集15批鹽杜仲飲片樣品,分別來自杜仲的3個主產地(陜西、貴州、四川),試驗所用樣品具有一定的代表性。在標準湯劑制備前對飲片進行了鑒別和檢測,為后續研究提供了保障。
迄今已從杜仲中分離鑒定了140余種化學成分[23],其中木脂素類是其中研究較多、專屬性較強、結構特征明顯的一類化合物。木脂素多以苷的形式存在于杜仲中,其中松脂醇二葡萄糖苷具有雙向調節血壓作用[24-25],2015年版《中國藥典》將其作為杜仲藥材和飲片的質量控制指標,并規定鹽杜仲中松脂醇二葡萄糖苷的含量不得少于0.10%。因此,本研究選擇松脂醇二葡萄糖苷作為鹽杜仲標準湯劑的指標成分,用于質量標準的建立和轉移率的表征。
此前針對鹽杜仲水提取物進行指紋圖譜的研究較少,《中藥配方顆粒質量控制與標準制定技術要求(征求意見稿)》明確要求建立標準湯劑的指紋圖譜,并建議采用液相或氣相色譜法。杜仲所含化學成分種類較多,成分復雜,特別是其木脂素類成分普遍存在同分異構現象,加之化合物極性偏大,給色譜分離帶來了一定困難。本研究分別考察以乙腈-水、甲醇-水和甲醇-乙腈-水等為流動相的指紋圖譜,結果表明以甲醇-水為流動相時,色譜峰的峰形較好,各共有峰的保留時間偏移較小,所得指紋圖譜的精密度、重復性和穩定性均符合要求。本研究所得15批鹽杜仲標準湯劑指紋圖譜的相似度均大于0.95,表明所建立的方法具有較好的適用性。
本研究收集15批鹽杜仲飲片樣品,按照規范步驟制備標準湯劑,采用出膏率、指標成分含量和轉移率、UPLC指紋圖譜對所得標準湯劑進行表征。研究選用的樣品來自多個產地、具有不同規格,目的是考察不同原料的出膏率、轉移率和指紋圖譜情況,進而根據這些數據制定出參數的允許范圍。本研究結果具有一定代表性和適用性,可為鹽杜仲配方顆粒的制備及質量控制提供參考,同時為鹽杜仲水提物的質量控制及進一步研究提供依據。
[1] 國家藥典委員會.中華人民共和國藥典:一部[M],北京:中國醫藥科技出版社,2015:165.
[2] 邢蘊蘊,王健英,潘穎宜,等.杜仲骨保護的作用機制研究進展[J/OL].中華中醫藥學刊[2020-03-22].http://kns.cnki.net/kcms/detail/21. 1546.R.20190815.1511.075.html.
[3] 鞏仔鵬,吳林霖,陸苑,等.杜仲降血壓活性成分在正常大鼠和自發性高血壓大鼠體內的藥代動力學差異研究[J].中國藥理學與毒理學雜志, 2016,30(10):1043.
[4] 蘇卓,郭誠,梁韜.杜仲多糖對鏈脲佐菌素致糖尿病小鼠的作用[J].中國實驗方劑學雜志,2016,22(14):159-162.
[5] 李文娜,肖苑,黃燮南,等.杜仲葉綠原酸提取物對大鼠的減肥作用機制[J].中國臨床藥理學雜志,2012,28(7):534-535,538.
[6] HE X, WANG J, LI M, et al.Oliv.:ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine[J]. J Ethnopharmacol, 2014,151(1):78-92.
[7] 新型.北林大研發農林生物質多級資源化利用關鍵技術[J].化工新型材料,2016,44(2):254.
[8] CHEN G, SUI X, LIU T, et al. Application of cellulase treatment in ionic liquid based enzyme-assisted extraction in combine with in-situ hydrolysis process for obtaining genipin fromOlive barks[J]. J Chromatogr A,2018,1569:26-35.
[9] 黃衛星,姚鐵,丁麗琴,等.杜仲皮化學成分研究[J].中草藥,2019, 50(14):3279-3283.
[10] 馬永青,王璐,劉穎,等.基于UPLC-LTQ-Orbitrap-MS技術快速解析杜仲顆粒化學成分[J].分析測試學報,2019,38(7):817-822.
[11] 張凌風,洪雅丹,駱媱,等.HPLC法測定杜仲-淫羊藿藥對中8個化學成分的含量[J].藥物分析雜志,2019,39(5):772-779.
[12] 程光麗.杜仲有效成分分析及藥理學研究進展[J].中成藥,2006, 28(5):723-725.
[13] LIU B, LI C P, WANG W Q, et al. Lignans extracted fromOliv. protects against AGEs-induced retinal endothelial cell injury[J]. Cell Physiol Biochem,2016,39(5):2044-2054.
[14] 李獻平,王勤.杜仲炮制前后補腎作用初探[J].中成藥研究, 1988(1):15-16.
[15] 陳士林,劉安,李琦,等.中藥飲片標準湯劑研究策略[J].中國中藥雜志,2016,41(8):1367-1375.
[16] 鄧哲,荊文光,王淑慧,等.中藥飲片標準湯劑研究進展與討論[J].中國中藥雜志,2019,44(2):242-248.
[17] 劉安.中藥飲片標準湯劑制備與質量標準研究方法概述[J].中國實驗方劑學雜志,2017,23(7):1.
[18] 趙曼佳,趙嶸,代云桃,等.大黃標準湯劑質量評價[J].中國中藥雜志,2018,43(5):861-867.
[19] 許洪波,高春暉,蔡興航,等.玄參飲片標準湯劑制備及質量標準研究[J].中國中藥雜志,2019,44(12):2493-2498.
[20] 馬永青,王璐,劉穎,等.基于UPLC-LTQ-Orbitrap-MS技術快速解析杜仲顆粒化學成分[J].分析測試學報,2019,38(7):817-822.
[21] 嚴穎,趙慧,鄒立思,等.基于LC-QTOF MS/MS技術分析不同產地杜仲的差異化學成分[J].中國中藥雜志,2017,42(14):2730-2737.
[22] 何峰,王永林,鄭林,等.UPLC-PDA-ESI-MS分析杜仲中化學成分[J].中國實驗方劑學雜志,2014,20(3):59-62.
[23] 王娟娟,秦雪梅,高曉霞,等.杜仲化學成分,藥理活性和質量控制現狀研究進展[J].中草藥,2017,48(15):3228-3237.
[24] 馮晗,周宏灝,歐陽冬生.杜仲的化學成分及藥理作用研究進展[J].中國臨床藥理學與治療學,2015,20(6):713-720.
[25] 戚向陽,陳維軍,張聲華.杜仲中雙環氧木脂素二糖苷分離純化技術的研究[J].林產化學與工業,2005,25(4):47-50.
Study on Preparation and Fingerprints of Standard Decoction of Salt Eucommiae Cortex
XU Huaili1, XU Dingqiao2, TANG Zhishu1, SONG Zhongxing1, ZHANG Junwei1, SU Biao1, XU Hongbo1
To prepare standard decoction of salt Eucommiae Cortex; To establish the standards of quality control.Totally15 batches of standard decoction of salt Eucommiae Cortex were prepared. With pinoresinoldiglucoside as the detection index, the extraction rate, content and transfer rate of index components were calculated and the UPLC characteristic chromatograms was established.was used to analyze and compare the characteristic chromatograms. The chemical structures of common peaks were identified with UPLC-Q-TOF-MS/MS in the standard decoction of salt Eucommiae Cortex.The extraction ratio of pinoresinoldiglucoside was from 42.74% to 71.43%, with an average value of 57.26%. The similarity between the fingerprint of standard decoction of salt Eucommiae Cortex pieces and the reference fingerprint was over 0.95. There were 9 peaks in the fingerprint, and the peaks were identified as catalpol, eucommioside, geniposidic acid, asperulosidic acid, chlorogenic acid, olivil-4’---D-glucopyranoside, genipin, pinoresinoldiglucoside, and astragalin.The preparation method of standard decoction of salt Eucommiae Cortex established in this study is stable. The fingerprint method has good precision, stability and repeatability, which can provide reference for the quality control of salt Eucommiae Cortex formula granules.
salt Eucommiae Cortex; standard decoction; fingerprints; pinoresinoldiglucoside
R284.1
A
1005-5304(2020)12-0053-06
10.19879/j.cnki.1005-5304.202003588
陜西省“三秦學者”創新團隊支持計劃(2018年);陜西省科技統籌創新工程計劃(2016KTTSSF01-06-01);陜西省自然科學基礎研究計劃(2019JQ-370)
許洪波,E-mail:xhb2005@sntcm.edu.cn
(2020-03-22)
(2020-04-15;編輯:陳靜)

