蘿卜硫素通過Nrf2/ARE信號通路對脂多糖性急性肺損傷機制的保護作用
劉振峰, 劉代順, 劉建英, 周國旗, 李云飛, 曾靜新
(1.遵義醫科大學第三附院醫院/貴州省遵義市第一人民醫院呼吸內科, 貴州 遵義 563000 2.貴州省遵義市紅花崗區人民醫院呼吸內科, 貴州 遵義 563000)
ALI/ARDS的發生主要由直接和間接致傷因素導致毛細血管內皮損傷和肺泡上皮細胞損傷引發肺泡水腫和彌漫性肺間質,從而可造成急性低氧性呼吸功能不全[1]。ALI在臨床中病理生理特征主要以通氣/血流比例失調和肺容積減少等,嚴重者可發展為急性呼吸窘迫綜合征(ARDS)。研究發現嚴重感染和大面積燒傷患者的死亡與ALI存在明顯相關性,因此對ALI有效防治存在重要意義[2]。針對ALI臨床多采用小潮氣量進行保護機械通氣,以此降低死亡率。目前ALI發病機制尚未有明確報道,因此探尋新的治療方法已被諸多學者所關注。研究發現氧化應激在ALI和損傷機制中存在重要作用,且ALI發病機制中各細胞經呼吸爆發大量產生活性氧從而造成氧化應激的發生。正常生理情況下活性氧主要通過細胞內抗氧化反應元件(ARE)進行調控相關抗氧化酶的降解和去除[3]。合成內生性抗氧化酶中Nrf2是主要調節器,當Nrf2激活入核后直接參與了ARE的基因調控[4]。本文選取32只小鼠進行實驗,觀察內毒素誘發ALI后,SF是否可激活Nrf2表達上調,從而起到保護ALI的作用,以期為臨床防治ALI提供新靶點。
1 材料與方法
1.1實驗動物:選取32只6~8周齡雄性小鼠均有廣東醫學實驗室提供(C57BL/6),體重9~13g,飼養溫度21±2℃;隨機將32只小鼠分為SF組、對照組、SF溶劑組和ALI組,每組各8只。
1.2材料:SDS-PAGE凝膠電泳試劑盒、Western blotting檢測、全蛋白試劑盒、血氣分析儀(GE premier3000)、IX51光學顯微鏡、凝膠成像分析系統、LPS、鼠抗人Nrf2單抗、蘿卜硫素、SOD、MPO、iNOS、IL-6和TNF-α試劑盒。
1.3模型制作:SF溶劑組和SF組均行腹腔注射20mg/kg(SF),2次/d,每次間隔8h,連續注射3d;第4d時ALI組、SF組和SF溶劑組注射腹腔脂多糖(LPS)10mg/kg,并制備內毒素誘發急性損傷模型;對照組腹腔注射10mg/kg生理鹽水;注射生理鹽水或LPS后6h,進行配制10%水合氯醛進行注射麻醉,再取腹主動脈血使用GE premier3000進行血氣分析,并同時計算氧合指數(PaO2/FiO2),急性肺損傷模型是否制備成功以氧合指數≤300mmHg(1mmHg=0.133kPa)為標準;下腔取血行肝素抗凝后立即自胸腔取出心肺組織。
1.4肺組織勻漿和干重/濕重比(W/D):依據上述方法處理后,將32只雄性小鼠進行處死,并立即自胸腔取出心肺組織;將左肺組織取出放入預冷生理鹽水玻璃勻漿器中充分勻漿;MPO檢測:制備10%組織勻漿,取0.45mL10%組織勻漿進行檢測;剩余組織勻漿采用低溫離心機進行離心(10000r/min),離心10min,離心半徑6cm,采集上清液并放于-80℃中保存,備至各項檢測所用。將右肺尖葉肺組織取出進行稱重,放于烘箱中,溫度設定80℃,烘24h后面達到恒重量進行測定肺組織W/D比值。
1.5觀察肺組織病理:使用鹽水將右肺副葉肺組織進行浸洗后,采用福爾馬林(10%)進行固定,并經梯度乙醇脫水置換,二甲苯透明后進行石蠟包埋,切片和染色后于IX51光學顯微鏡下觀察肺組織病理學結果,并對肺組織損傷結果進行評分;隨機選取每張切片10個視野進行觀察評分[5],取平均值。
1.6檢測Nrf2核蛋白表達、IL-6和TNF-α水平含量:Nrf2應用Western blotting檢測;使用Bradfo測定蛋白試劑盒提取的組織樣品蛋白;每孔加入20μg蛋白進行凝膠電泳、轉模和封閉后加入Nrf2一抗(1∶1000稀釋)并于4℃下過夜孵育,次日采用TBST漂洗3次后加入二抗(1∶10000稀釋)孵育后給予顯色,并應用凝膠成像系統和Gel-Pro32軟件對結果進行灰度分析。IL-6和TNF-α水平含量采用ELIAS檢測。
1.7SOD、MPO和iNOS使用比色法檢測:嚴格根據試劑盒說明測定超氧化物歧化酶(SOD)、氧化物酶(MPO)和一氧化碳合酶(iNOS)的水平含量。
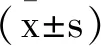
2 結 果
2.1觀察各組小鼠肺組織病理學和W/D比值:通過光鏡下可發現SF組、ALI組和SF溶劑組經切片HE染色明顯可見炎癥反應;對照組未見相關炎癥反應的發生(圖1)。SF組、SF溶劑組和ALI組肺損傷評分明顯高于對照組,且W/D比值均高于對照組(P<0.05);ALI組肺損傷評分和W/D比值高于SF組(P<0.05);AIL組與SF溶劑組比較上述兩項指標差異無統計學意義(P>0.05),見表1。

表1 比較4組小鼠肺組織病理學評分和W/D比值

圖1 肺組織病理切片(HE×200)
2.2觀察SOD、MPO和iNOS水平:SF溶劑組和ALI組MPO和iNOS水平明顯較對照組升高,但SOD明顯低于對照組(P<0.05);SF組SOD水平明顯較ALI組升高,但MPO和iNOS水平低于ALI組,差異具有統計學意義(P<0.05);SF溶劑組與ALI組比較上述各項指標水平含量差異無統計學意義(P>0.05),見表2。

表2 比較4組肺組織SOD MPO和iNOS水平
2.3觀察各組血清IL-6和TNF-α水平含量:SF溶劑組和ALI組IL-6和TNF-α水平含量明顯較對照組升高(P<0.05);SF組IL-6和TNF-α水平含量低于ALI組,差異具有統計學意義(P<0.05);ALI組IL-6和TNF-α水平含量與SF溶劑組比較差異無統計學意義(P>0.05),見表3。

表3 比較4組血清IL-6和TNF-α水平含量

圖2 比較4組小鼠肺組織Nrf2核蛋白表達
2.4觀察各組肺組織Nrf2核蛋白表達情況:SF溶劑組與ALI組Nrf2核蛋白表達明顯較對照組上調(P<0.05);SF組肺組織Nrf2核蛋白表達明顯較ALI組上調(P<0.05);ALI組與SF溶劑組比較Nrf2核蛋白上調表達情況差異無統計學意義(P>0.05),見圖2。
3 討 論
目前引發ALI的誘因較多,其中常見的內毒素是致其發病的主要原因。研究顯示SF溶劑組和ALI組LPS注射6h后肺組織W/D比值明顯降低,而肺損傷組織評分明顯升高,說明模型建立成功。研究表明ALI組肺組織Nrf2核蛋白表達明顯較對照組上調,考慮Nrf2核蛋白表達的原因與LPS激活機體氧化應激有關,從而引起內源性免疫系統反應升高Nrf2進行對抗損傷,但此保護作用不足以對抗炎癥介質造成的損傷,因此最終結果顯示肺損傷程度加重。研究發現SF組肺組織Nrf2表達、W/D比值和抗氧化酶明顯較ALI組升高,且肺損傷評分和各項抗氧化應激損傷指標低于ALI組(P<0.05),說明SF可通過激活Nrf2表達減輕LPS誘導ALI的加重,造成氧化應激損傷指標和促炎介質降低,抗氧化酶升高等,有效起到了保護機體和調節作用。ROS造成的氧化應激反應在ALI發病機制中存在重要作用[6]。生理情況下ROS主要通過細胞內ARE調控相關解毒和抗氧化酶的降解/去除。正常生理狀態下Nrf2定位于細胞漿,與Keaol結合成復合物[7]。當機體發生氧化應激情況下,Nrf2磷酸化并自Keaol蛋白上解離后進入細胞核并于ARE結合,啟動其下游多個抗氧化基因和解毒酶進行轉錄翻譯,并以此進行對抗氧化應激反應[8]。研究發現[9,10]Nrf2/ARE信號通路在急性肺損傷中起到了重要保護作用,若將其阻斷可加快小鼠膿毒癥器官的損傷。Nrf2表達可通過SF進行上調表達,是Nrf2基因的重要激活劑[11]。本研究發現SF組Nrf2表達明顯較ALI組增加,且ALI組抗氧化酶、肺損傷組織評分和各項應激損傷指標明顯低于SF組,證實SF可通過誘導Nrf2提高表達起到保護ALI的作用。本研究為SF對ALI的預防干預性研究,簡單探討了Nrf2/ARE通路在ALI中起到的作用。筆者將進一步研究SF聯合或對比其他抗氧化劑對ALI保護作用,且Nrf2/ARE通路具體的作用機制及是否有其他通路與之共同作用干預ALI的發生和發展也有待進一步探討。
綜上所述,SF可通過激活Nrf2/ARE對內毒素造成的ALI損傷可起到明顯保護作用。

