腹腔鏡下Dixon與Miles手術對低位直腸癌根治保肛術后患者手術應激反應及肛門功能的影響
張玉麒,劉明亮
(浚縣人民醫院普外二科,河南 浚縣 456250)
低位直腸癌是指發生在距肛緣3~6 cm左右的直腸惡性腫瘤,發病率占所有直腸癌的70%,臨床以手術切除治療為主[1]。但對于直腸癌患者來說,傳統手術術后由于人工肛門的存在使患者心理和生活質量受到極大影響。目前認為保留完整的肛管直腸黏膜對維持患者肛門括約肌功能以及排便反射功能正常具有重要的生理意義[2]。目前臨床上低位直腸癌根治保肛術常用的術式包括腹會陰聯合直腸癌根治術(Miles)和直腸低位前切除術(Dixon)。Miles手術主要切除患者的全部直腸、部分乙狀結腸、腸系膜下動脈及區域淋巴結、直腸系膜、肛提肌等的基礎上做一單腔造口。Dixon手術在切除病變直腸的基礎上,較好地保留了部分直腸、肛管、肛門括約肌、肛提肌等和一部分排便功能。鑒于此,筆者采用對比研究的方法探討腹腔鏡下Dixon與Miles手術治療對低位直腸癌根治保肛術后患者手術應激反應及肛門功能的影響,報告如下。
1 資料與方法
1.1 一般資料
選取2014年5月至2017年5月浚縣人民醫院收治的低位直腸癌患者108例,根據手術方案不同,分為2組:觀察組54例,男33例、女21例,年齡36~75歲、平均(55.64±19.28)歲;對照組54例,男31例、女23例,年齡38~79歲、平均(56.12±16.69)歲。2組患者的性別、年齡等一般資料比較,差異無統計學意義(P>0.05),具有可比性。本研究經本院醫學倫理委員會審批批準。
1.2 入選及排除標準
入選標準:1)所選患者均符合《胃腸病學》中關于直腸癌的診斷標準[3];2)所有患者術前臨床分期為T2-4N0-2;3)年齡35~80歲;4)符合低位直腸癌保肛術的適應證;5)患者自愿參與本研究并簽署知情同意書。
排除標準:1)腫瘤已轉移或轉術中開腹者;2)急性腸穿孔、出血、梗阻者;3)心、肝、腎等重要器官功能嚴重障礙者;4)血液及免疫系統疾病者;5)伴有其他惡性腫瘤者;6)有精神疾病史者。
1.3 手術方法
所有患者手術均由同一組經驗豐富的胃腸外科專科醫師團隊完成,手術嚴格遵循全直腸系膜切除(TME)原則[4]。
對照組予以Miles手術,具體操作方法如下:行氣管插管、全身麻醉,體位放置頭低足高截石位,建立人工氣腹,常規做操作孔,置入腹腔鏡探查病灶,游離直腸,切除肛門周圍5 cm處皮下至肛提肌、肛尾韌帶,將切斷后的近端腸管拉出,擴張肛口,吻合肛管殘端,于左下腹部麥氏點操作孔處作乙狀結腸造口,結束關腹。
觀察組予以Dixon手術,具體操作方法如下:行氣管插管、全身麻醉,體位放置頭低足高截石位,建立人工氣腹,常規做操作孔,置入腹腔鏡探查病灶,離斷腫瘤下方1~2 cm處范圍的直腸,離斷腫瘤上方10~15 cm處的近端腸管,于左下腹劃一5 cm左右的切口,于腹腔內取出病變直腸及部分乙狀結腸,用彎型吻合器吻合直腸與結腸,常規放置引流管,結束關腹。
1.4 觀察指標及評價標準
1)比較2組術中出血量、胃腸功能恢復時間等臨床相關指標。2)比較2組術前及術后3 d炎癥因子白細胞介素-6(IL-6)水平變化。3)術后3個月隨訪2組排便困難、切口感染、吻合口瘺等并發癥發生情況。4)術后6個月,對患者的肛門功能進行隨訪。比較2組患者肛門功能的優良率。評價標準:按照“五項十分制”讓患者從0~10分進行評分;綜合得分后,將肛門功能劃分為4個等級;其中優:9~10分;良:7~8分;一般:5~6分;差:4分及以下。優良率=(優+良)例數/總病例數×100%。5)隨訪2年后,比較2組術后復發率。
1.5 統計學方法

2 結果
2.1 2組臨床相關指標比較
2組術中出血量、胃腸功能恢復時間等臨床相關指標比較,差異無統計學意義(P>0.05)。見表1。
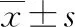
表1 2組臨床相關指標比較
2.2 2組炎癥因子IL-6水平比較
觀察組術前、術后3 d IL-6水平分別為(17.86±4.58)pg·mL-1、(54.27±9.63)pg·mL-1;對照組術前、術后3 d IL-6水平分別為(18.04±4.36)、(74.89±10.26)pg·mL-1。與對照組比較,觀察組術后3 d的IL-6水平上升幅度明顯減小,差異有統計學意義(t=10.768,P<0.05)。
2.3 2組術后并發癥比較
隨訪2年,觀察組發生排便困難、切口感染、吻合口瘺的例數為1、0、1,分別對應對照組的3、3、2。觀察組排便困難、切口感染、吻合口瘺等并發癥總發生率為3.70%,顯著低于對照組的14.81%,差異有統計學意義(χ2=3.967,P=0.046)。
2.4 2組肛門功能優良率比較
與對照組比較,觀察組術后6個月肛門功能優良率顯著升高,差異有統計學意義(P<0.05)。見表2。

表2 2組肛門功能優良率比較 例
2.5 2組術后復發率比較
隨訪2年后,觀察組有2例復發,復發率為3.70%,對照組有5例復發,復發率為9.26%。2組復發率比較,差異無統計學意義(χ2=0.611,P=0.434)。
3 討論
低位直腸癌由于其部位較深且解剖結構層次復雜,加大了手術的難度,同時對術者提出了更高的要求。近年來,隨著對腸癌生物學研究的深入和腹腔鏡技術的不斷進步,其在治療直腸癌患者中的優勢越來越突出,同時也使直腸癌患者保肛的實現成為可能。Miles手術全名為腹會陰聯合直腸癌根治術,主要切除患者的全部直腸、部分乙狀結腸、腸系膜下動脈及區域淋巴結、直腸系膜、肛提肌等的基礎上做一單腔造口。Dixon手術全名為直腸低位前切除術,多應用于直腸癌保肛手術中,該手術方案在切除病變直腸的基礎上,較好地保留了部分直腸、肛管、肛門括約肌、肛提肌等和一部分排便功能。
本研究中,2組術中出血量、胃腸功能恢復時間等臨床相關指標及術后2年復發率比較,差異無統計學意義,說明兩種手術方式對患者的術后恢復及生存質量的遠期效果均較高。分析其原因可能與腹腔鏡使局部手術視野更清晰,幫助醫生更加準確地辨認血管及神經組織有關[4];術中超聲刀分離和止血作用效果好,有利于減少術中出血及醫源性種植,降低術后轉移和復發。本研究經3個月的隨訪后發現,觀察組術后并發癥發生率顯著低于對照組,與周啟軍等人[5]的研究結果一致,表明腹腔鏡下Dixon手術相比于Miles手術治療低位直腸癌的安全性較高。本研究中觀察組術后3 d的IL-6水平上升幅度明顯小于對照組,表明腹腔鏡下Dixon手術可有效減輕直腸癌患者的炎癥因子水平,從而減輕手術帶來的應激反應,保護患者的腸道功能[6]。可能與Miles手術切除范圍更廣、對患者身體的損傷程度更大,造成切口感染的風險更高有關。本研究結果顯示,觀察組術后6個月肛門功能優良率為74.07%,顯著高于對照組的53.70%,表明應用Dixon手術方式較Miles手術方式治療對低位直腸癌根治保肛術后患者肛門功能的恢復效果較好。可能與Dixon手術中彎型吻合器的使用,將直腸與結腸進行吻合有關,此步驟盡可能保留了患者的肛門功能[7]。
綜上所述,腹腔鏡下Dixon手術相比Miles手術治療低位直腸癌總體效果明顯,可以顯著降低術后患者的應激反應,改善肛門功能,且術后并發癥較少。

