ERH 基因對人膀胱癌細胞周期的影響
周榮升 韓從輝,3 陳 波 郝 林,3 史振鐸 姜 波 張治國,3龐 昆,3▲
1.江蘇省徐州市中心醫院 南京中醫藥大學附屬徐州中心醫院 東南大學醫學院附屬徐州醫院徐州醫科大學徐州臨床學院泌尿外科,江蘇徐州 221009;2.江蘇師范大學生命科學學院,江蘇徐州 221000;3.蘇州大學附屬第三臨床學院泌尿外科,江蘇常州 213000
在世界范圍內,膀胱尿路上皮癌(BUC)在惡性腫瘤中發病率排第五位[1]。在2018 年美國惡性腫瘤統計中,BUC 的發病率高居第四位,占惡性腫瘤總發病率的7%[2-3],在男性泌尿生殖系統中,僅次于前列腺癌,高居第二位,每年約有70 000 例新病例,并導致約15 000 人死亡[4]。在中國,BUC 發病率和相關死亡率逐年升高[5-6]。BUC 的主要治療方式為手術治療,但BUC 術后3 年內復發率仍高達70%,而且復發者中約1/3 病例向更高分級和分期進展[6-7],其中,浸潤性BUC 的10 年生存率僅為50%[8]。化療和放療也被廣泛用于晚期BUC的治療,但是這些方法會引起嚴重的副作用[9]。為有效治療BUC,減少不良反應,分子靶向治療引起了臨床泌尿學家的關注[10-11]。其具體致病機制尚不清楚,但與增殖基因的過度激活、凋亡因子的活性下降、與轉移有關基因的表達增強和炎癥因子的激活等[12-13]密切關系。故迫切需要找到BUC 發生發展、進展和轉移的潛在機制,繼而尋找一個有效的診斷、預后生物標志物和潛在的治療靶標。
在之前的研究中[14],本課題組通過免疫組化技術和聚合酶鏈式反應(PCR)技術在蛋白和mRNA 水平方面發現未成熟同源蛋白增強子(ERH)基因在人BUC的T24 細胞系中表達較正常膀胱尿路上皮細胞明顯上調,敲低ERH 基因表達后,會顯著抑制BUC 的T24細胞和5637 細胞增殖,促進凋亡[15]。本課題組的后續實驗表明[16],敲除ERH 基因后,人BUC 細胞在裸鼠的皮下成瘤能力受到顯著抑制。
為了進一步研究ERH 基因調控BUC 增殖凋亡的分子生物學機制,本研究通過人轉錄組表達譜芯片技術,檢測了敲除ERH 基因后,BUC 細胞基因的表達變化;通過對表達差異基因進行生物信息學分析,發現ERH 基因可能調控細胞周期相關蛋白;ERH 基因通過對細胞周期的調控,影響BUC T24 細胞的增殖和凋亡功能。現報道如下:
1 材料與方法
1.1 倫理、細胞培養及分組
所有實驗均經江蘇省徐州市中心醫院倫理委員會批準并通過。膀胱癌細胞系T24 購自中國科學院上海生命科學研究院細胞資源中心。將細胞在含有10%FBS、鏈霉素和青霉素的RPMI 1640 培養基中于37℃、含有5%CO2的培養箱中培養。根據是否使用慢病毒敲除ERH 基因,將人膀胱癌T24 細胞分為ERH 敲除組和ERH 正常組,慢病毒敲除方法如前期文獻所述[4,6]。
1.2 主要儀器和試劑
RNA 質檢采用NanoDrop 2000 儀(美國Thremo 公司,型號:OD1000+)、Agilent RNA 6000 Nano Kit 試劑盒(貨號:5067-1511)和Agilent 2100 Bioanalyzer(美國Agilent 公司)分析儀(部件號:G2939BA);體外反轉錄和aRNA 純化采用GeneChip 3’ IVT Express Kit試劑盒(美國Affymetrix 公司,貨號:902790);芯片雜交和洗染的試劑盒為GeneChip Hybridization Wash and Stain Kit 試劑盒(美國Affymetrix 公司,貨號:900 720);芯片雜交采用GeneChip Hybirdization Oven 645儀、芯片洗染采用GeneChip Fluidics Station 450 儀,芯片掃描采用GeneChip Scanner 3000 儀 (三臺儀器均購自美國Thremo 公司);流式細胞儀為Guava easyCyte HT(美國Millipore 公司);熒光顯微鏡為日本Olympus公司的IX71。
1.3 人轉錄組表達譜芯片
通過人轉錄組表達譜芯片技術對ERH 敲除組和ERH 正常組細胞進行分析比較,每組設3 個樣本,共6 個樣本,使用RNA marker 作為梯子(參考樣本)。質檢衡量標準為RIN(RNA Integrity Number,RNA 完整指數)值,這是檢測RNA 質量的質控方法,RIN 數值大小即反應樣品完整性情況,數值越接近10 表明樣品完整性越高,反之RIN 值越小完整性越差。Agilent 2100 Bioanalyzer RNA 質檢合格的標志是RIN(RNA完整指數)≥7.0 且28S/18S>0.7[17]。
總RNA 樣本經Agilent 2000 分析后,制備成aRNA,然后經一鏈合成得到cDNA,然后二鏈合成雙鏈DNA模板,體外反轉獲得帶生物標記的aRNA,純化后將其片段化,然后與芯片探針雜交,雜交完成后,對芯片進行洗染,掃描得到圖片和原始數據。檢測全轉錄組表達譜中受ERH 敲除影響的基因表達情況。
反應條件:一鏈cDNA 合成,42℃,2 h 后,4℃保持;雙鏈cDNA 合成,16℃,1 h,65℃,10 min 后,4℃保持;反轉錄,40℃,16 h 后,4℃保持;片段化,94℃,35 min后,4℃保持;芯片雜交,98℃,10 min,45℃,3 min 后,4℃保持。
1.4 差異基因富集分析和篩選
使用Metascape 數據庫(http://metascape.org/gp/index.html)對篩選出來的差異基因進行功能富集分析。Metascape 數據庫可以根據差異基因列表,根據其功能進行分析、注釋和富集。采用基因功能(gene oncology)和KEGG 通路(KEGG pathway)數據庫進行分析。然后根據基因功能做圖,并根據BioGrid6,In-Web_IM7,OmniPath8 數據庫對相應的蛋白互作進行分析,繪制蛋白互作網絡圖。
1.5 細胞周期功能研究
使用流式細胞技術觀察ERH 基因敲除對人膀胱癌T24 細胞周期的影響。使用6 孔板,細胞生長至覆蓋率約80%的時候通過胰酶消化,重懸,細胞計數將數目控制在106個/孔,共設置3 個復孔,洗滌3 次,后乙醇固定,使用PI 細胞染色,然后上機檢測,采用ModFit 軟件進行分析數據。
1.6 統計學方法
采用SAS 8.02 統計學軟件對所得數據進行分析,計量資料以均數±標準差()表示,采用student’s t 檢驗;計數資料采用例數或百分比表示。以P <0.05為差異有統計學意義。
2 結果
2.1 RNA 質檢
ERH 正常組三個樣本的RIN 值分別是8.9、9.5、9.5,28S/18S 值分別是1.9、1.9、1.8,質檢合格;ERH 敲除組三個樣本的RIN 值均為9.4,28S/18S 值分別是1.8、1.9、1.8,質檢合格。見圖1。

圖1 Agilent 2100 Bioanalyzer RNA 質檢圖譜
2.2 ERH 敲除后的其余基因表達變化情況
人轉錄組表達譜芯片結果顯示,ERH 基因在ERH 敲除組表達明顯降低,FC 值為-4.50,P <0.0001。ERH 敲除組比ERH 正常組有344 個基因表達上調,254 個基因表達下調(截斷值|FC|>2)。見圖2。

圖2 ERH 正常組和ERH 敲除組基因表達散點圖
2.3 ERH 敲除后的差異基因及互作網絡
通過Metascape 數據庫對篩選出的598 個基因進行生物功能富集分析。結果顯示,有顯著差異的598 個基因,與腫瘤相關的通路有:細胞因子介導的信號通路、NOD 樣受體信號通路、腫瘤壞死因子信號通路、嗜同性細胞黏附、P53 下調通路、負向調節蛋白質磷酸化、負向調節細胞增殖、細胞凋亡通路等。見表1、圖3。圖3 為log10(P)值由小到大的前20 位差異基因對應的生物學功能。
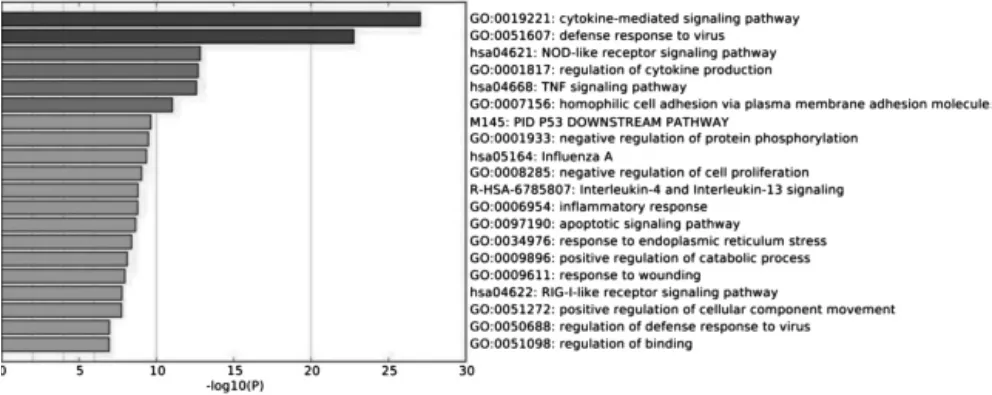
圖3 差異基因生物功能富集熱圖
數據庫進一步對篩選的598 個基因進行互作功能研究,使用Cytoscape5 可視化網絡圖,每個節點代表一個生物功能,類似的生物功能聚為一個集群,用相同顏色表示。見圖4(封四)。

2.4 ERH 基因敲除后,差異基因對應蛋白的互作網絡與功能分析
繼續采用Metascape 數據庫鏈接BioGrid6,In-Web_IM7,OmniPath8 數據庫對相應的部分蛋白互作關系做出分析并繪制互作網絡圖(圖5)。發現ERH敲除后的598 個基因中,有大量差異基因對應的蛋白與細胞周期密切相關。

表1 差異基因對應的腫瘤相關生物功能

圖5 差異基因相關蛋白互作網絡圖
2.5 ERH 基因敲除對細胞周期的影響
ERH 敲除組G1期和G2/M 期的細胞數目少于ERH 正常組,ERH 敲除組S 期細胞數目多于ERH正常組,差異均有統計學意義(均P <0.05)。見表2、圖6。
3 討論
ERH 基因位于人類14 號染色體,優先表達于細胞核[18],除了核仁外,也表達于細胞質中,作為基因增強子和轉錄調控因子,具有多種結合蛋白,如RPS3或RPL19[19],功能涉及嘧啶生物合成、細胞周期、轉錄和細胞生長控制過程。有研究表明[20],ERH 蛋白通過與鋅指蛋白Ciz1 結合,成為與p21cip1/Waf1相互作用的DNA 復制因子。ERH 蛋白和RNA 結合蛋白Mmi1 形成一個復合物,稱為ERH-Mmi1 復合物(EMC)[21],與剪接體蛋白SNRPD3 相互作用,是有絲分裂運動蛋白CENP-E 的mRNA 剪接所必需的[22]。這些研究均提示ERH 基因可能會參與癌細胞的細胞周期[23-24]。在前期研究中,本課題組首次發現ERH 基因在BUC T24 細胞中呈高表達豐度,而且ERH 基因敲除對T24 細胞的增殖、克隆形成具有抑制作用,對凋亡具有促進作用[15,25]。本課題組進一步在動物體內發現ERH 基因敲除后,裸鼠皮下成瘤能力明顯減弱[16]。
表2 ERH 基因敲除后細胞各周期變化(%,)

表2 ERH 基因敲除后細胞各周期變化(%,)
注:ERH:未成熟同源蛋白增強子

圖6 ERH 基因敲除后細胞各周期變化
本研究將ERH 基因敲除后,使用流式細胞技術觀察ERH 基因敲除對細胞周期的影響。結果可見,ERH 敲除組G1期和G2/M 期的細胞數目少于ERH 正常組,ERH 敲除組S 期細胞數目多于ERH 正常組,差異均有統計學意義(均P <0.05),說明ERH 基因主要影響細胞周期的S 期。本研究進一步通過人轉錄組表達譜芯片技術,在抑制ERH 基因的表達后,檢測轉錄組基因表達情況。結果顯示,有598 個基因表達受ERH 基因敲除的影響發生上調或下調。然后,通過生物信息分析技術,篩選與腫瘤通路有關的差異基因,發現ERH 基因敲除與細胞因子介導的信號通路、NOD 樣受體信號通路、腫瘤壞死因子信號通路、嗜同性細胞黏附、P53 下調通路、負向調節蛋白質磷酸化、負向調節細胞增殖、細胞凋亡通路等有關。這些通路介導了BUC T24 細胞的增殖和凋亡過程,這與本課題組前期研究相一致[16]。然后,本研究繼續通過生物信息分析技術來尋求蛋白的互作網絡與功能分析,結果提示ERH 基因可能通過細胞周期蛋白影響BUC T24 細胞的增殖與凋亡,這也與本課題組前期研究結果一致[16]。
在BUC T24 細胞系中,本研究通過細胞周期實驗發現ERH 基因主要影響細胞周期的S 期,通過人轉錄組表達譜芯片技術,找到了ERH 基因敲除相關的差異基因598 個。通過生物信息分析技術,發現了ERH 基因通過調控細胞周期影響BUC T24 細胞的增殖和凋亡。

