149株布魯氏菌病原快速診斷方法的評價
臺錦閣,汪定成,楊 銘,邵海連,蘇 博,郭鵬娟,陳靜文,董 軻
近年來,我國人獸共患病不斷增多,尤其以布魯氏菌病最為顯著。該病患者臨床表現復雜多樣,無臨床特征性,容易造成漏診和誤診,給臨床診斷帶來棘手問題。目前,布魯氏菌病的診斷方法主要分為病原學檢測和血清學診斷,前者其準確率高,不易漏診,是布魯氏菌檢測的“金標準”;后者因為存在交叉抗原及采集標本不合格等原因會造成假陽性診斷結果[1]。此外,布魯氏菌對人體的致病力極強,易導致實驗室獲得性感染[2]。因此,確保實驗室安全的情況下,快速準確鑒定布魯氏菌顯得尤為重要。本文就布魯氏菌實驗室快速鑒定的方法進行探討,現報道如下。
1 材料與方法
1.1儀器 法國梅里埃BACT/ALERT3D240全自動細菌培養系統及配套的培養瓶、荷蘭Mart Anoxomat Mark Ⅱ厭氧培養系統、含溶血素厭氧培養瓶、美國Forma Class Ⅱ臺式生物安全柜、美國BD BECTEC FX全自動血培養儀、泰斯特SPX-150B Ⅲ生化培養箱、奧林巴斯CX21顯微鏡。
1.2試劑 哥倫比亞血瓊脂培養基、麥康凱培養基及巧克力培養基(購自鄭州安圖生物技術有限公司)、美國BD BECTEC FX全自動血培養儀配套的樹脂需氧培養基。
1.3菌株采集 149株布魯氏菌(剔除同一病號)分離自本院2014年1月至2019年9月臨床的血液、骨髓、關節腔液、引流液、腦脊液等標本。經無菌操作將3~10 mL標本接種于血培養儀配套的培養瓶中,經全自動血培養儀掃描識別后直接放進培養儀進行檢測。
1.4實驗室快速鑒定方法 首先將所采集標本進行血培養,根據陽性瓶報警時間和觀察細菌生長曲線對細菌進行初步判斷,如果陽性報警時間較長且生長曲線有明顯的“布魯氏菌”曲線特征,則高度懷疑為布魯氏菌;再用注射器抽取所懷疑血培養瓶中的樣本,一部分用于涂片并進行革蘭染色,瑞氏染色和石碳酸復紅單染,然后觀察顯微鏡鏡下形態,與此同時,另一部分轉種血平板、巧克力平板及麥康凱平板,并于35 ℃恒溫箱中培養18~24 h,觀察細菌生長情況,并進行觸酶,氧化酶,尿素水解試驗,根據鏡檢的“布魯氏菌”特征形態及生化反應結果為2 h內尿素水解陽性,氧化酶、觸酶均為陽性則可確診為布魯氏菌。
2 結 果
2.1布魯氏菌病患者的統計情況 臨床分離的149株布魯氏菌,其中男性占110株,女性占39株,年齡分布在1~81歲,兒童占3株。該病患者最常見的臨床表現是發熱,典型病例表現為波狀熱,常伴有寒戰等癥狀;其次是多汗,布魯氏菌病急性患者出汗尤重,可濕透衣褲、被褥等;還有一些患者表現為全身肌肉和多發性、游走性大關節疼痛;少數患者會出現脊柱(腰椎為主)骨關節疼痛、畸形和功能障礙等。本文所涉及到的149例患者中,143株患者有明確的牛羊接觸史,4株有吃牛羊肉或者喝生牛羊奶的情況,2株有犬類接觸史。
2.2布魯氏菌陽性報警時間 布魯氏菌的陽性報警時間遠遠大于其他細菌,因此可以通過陽性報警時間對細菌類型做出初步判斷[3]。本文中149株布魯氏菌在血培養儀上陽性報警時間為58.9~124.3 h,均值為73.8 h。具體分布時間見表1。

表1 來源于不同標本的布魯氏菌在全自動血培養儀中陽性報警時間(株)
2.3布魯氏菌生長曲線 細菌在血培養瓶中的生長繁殖過程可劃分為遲緩期、生長期和穩定期3個過程,布魯氏菌是專性需氧菌,生長緩慢。布魯氏菌血培養生長曲線如圖1所示,其特征為遲緩期曲線較平坦,生長期曲線短且幅度小,穩定期曲線平坦。圖2和圖3分別為大腸埃希菌生長曲線和金黃色葡萄球菌生長曲線,其與布魯氏菌血培養生長曲線有明顯的區別。
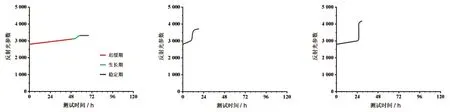
圖1 布魯氏菌生長曲線 圖2 大腸埃希菌生長曲線 圖3 金黃色葡萄球菌生長曲線
2.4細菌學和生化功能鑒定 鏡檢:革蘭染色鏡下發現呈片狀的革蘭陰性小球桿菌,染色很弱,不易觀察;瑞氏染色鏡下可見紫色的小球桿菌單個或成堆或像細沙樣;石碳酸復紅單染鏡下可見紅色的小球菌成泥沙樣,其鏡下染色圖片分別為圖4、圖5、圖6(放大倍數均為10×100),不同染色方法所觀察到的布魯氏菌分別如圖中箭頭所示。接種的平板在35 ℃恒溫箱中培養18~24 h,血平板及巧克力培養平板上生長出針尖大小的菌落類似一層血膜,延長培養到72 h,生長出較小、灰色、圓形、突起、邊緣整齊且不溶血的大小相同的菌落,麥康凱平板上無菌落生長,其生化反應結果為2 h內尿素水解陽性,氧化酶、觸酶均為陽性。

圖4 布魯氏菌革蘭染色 圖5 布魯氏菌瑞氏染色 圖6 布魯氏菌石碳酸復紅單染
3 討 論
布魯氏菌病,是由布魯氏菌屬細菌引起的人獸共患病,是全世界范圍的動物源性傳染病[4]。布魯氏菌病的發生、發展和轉歸比較復雜,其臨床表現多種多樣,很難以某一種癥狀來確診,臨床醫生多因發熱考慮菌血癥,送檢血液培養和骨髓培養,部分實驗室因經驗不足,未能培養鑒定出細菌,造成漏診。目前,布魯氏菌病確診實驗方法主要有布魯氏菌培養鑒定、試管凝集試驗(SAT)、補體結合試驗(CFT)、抗人免疫球蛋白試驗(Coomb′s)和聚合酶聯反應等[5],但是布魯氏菌培養鑒定和試管凝集試驗(SAT)是最常見的診斷方法。其中,試管凝集試驗(SAT)不屬于臨床實驗室常規開展的方法,而是由疾病控制中心開展的項目,常用于流行病調查研究。臨床科室一般通過細菌培養鑒定為布魯氏菌后,運送標本至疾病控制中心進行試管凝集試驗(SAT)復檢。
因此,實驗室目前診斷布魯氏菌最可靠的方法還是以細菌培養為主,該法通常在血培養瓶報陽后進行接種,常規培養72 h左右,待有灰白色菌落生成后進行生化鑒定[6]。而本文所采用的是對細菌培養方法進行優化后的方法,其主要特點在于血培養瓶報陽后,直接取一部分樣品進行革蘭染色和石碳酸復紅單染,由于布魯氏菌屬于革蘭陰性小型球桿菌,經革蘭染色該菌呈細沙樣且細胞壁不易被堿性復紅復染,著色較淡不易被發現,分離的149例布魯氏菌中85例鏡下革蘭染色陰性,未能明顯看見細菌,經驗不足的人員不易分辨。但經石碳酸復紅單染,鏡下明顯可見櫻紅色的小球菌成泥沙樣排列,提示有細菌存在,結合革蘭染色和石碳酸復紅單染的染色結果,高度懷疑為布魯氏菌;與此同時,取另一部分樣品接種培養18~24 h,隨后通過生化反應進行鑒定,縮短了報告時間。因而本文所述方法較常規細菌培養方法相比更加快速。值得注意的是,本文無法參考標準菌株進行鑒定,因為根據《中華人民共和國動物防疫法》規定,布魯氏菌病為乙類傳染病,其標準菌株在國內沒有購買途徑。本文所涉及到的布魯氏菌都是通過凝集實驗和基質輔助激光解吸電離飛行時間質譜來進行驗證的。
本文中的149株布魯氏菌以血液和骨髓標本來源為主,分別為89株和46株,有少量標本來源于關節腔液,極少量存在于膿液和腦脊液中。在149株布魯氏菌中,有兩株臨床反饋的結果為陰性,該兩名患者否認牛羊接觸史和食用未熟的肉制品、奶制品,但有飼養犬類,臨床科室按照布魯氏菌病治療方案對患者進行治療,病情明顯好轉,則可判斷為犬布魯氏菌感染。造成SAT凝集結果為陰性的最主要原因可能是由于犬布魯氏菌屬于粗糙型菌,不適合用光滑型菌SAT抗原檢測,即由于抗原表位的不同,布魯氏桿菌可以表現為SAT陰性[7-9]。此外,也不排除可能受采樣及血清中抗體濃度的影響等[6]。SAT凝集方法對產生癥狀的急性感染患者更加敏感,但對于慢性患者很容易造成漏診,比如Sanodze等人研究發現該方法在布魯氏菌病的早期診斷中其靈敏度很低[10-11]。同時,對于流行區患者,由于高背景抗體效價等原因,會出現假陰性,因此,可能存在多種因素導致該方法對布魯氏菌病診斷的準確率并沒有本文所述的方法高。
綜上所述,本文所采用的實驗室布魯氏菌診斷方法的準確率高,快速且具有較高的生物安全性,說明了病原學診斷在一定程度上優于血清學診斷。
利益沖突:無

