溫膽湯通過調節膽固醇逆轉運相關膜蛋白表達抑制ApoE?/?小鼠動脈粥樣硬化斑塊形成*
陳玄晶,吳炳鑫,吳煥林,徐丹蘋
(1廣州中醫藥大學第二臨床醫學院,2廣東省中醫院,廣東廣州 510020;3北京中醫藥大學,北京 100700)
動脈粥樣硬化(atherosclerosis,AS)是眾多心血管疾病的病理基礎和關鍵環節,其引發的重要臟器缺血性功能障礙已成為全球人類死亡的首要原因。WHO 最新統計數據顯示,每年全球約1 790 萬人死于AS 所致的心腦血管疾病,約占全球死亡的31%,并且發病率仍持續增長。目前他汀類等降脂藥物為臨床治療AS 的一線藥物,但研究發現長期口服此類藥物容易引起橫紋肌溶解、腎衰等不良反應,以及部分他汀不耐受患者無法超越6%原則[1-2],因此尋找更加有效低毒的抗AS 藥物具有重大意義。中藥在這方面顯示出明顯優勢,其組合協同作用和較低副作用的特點使其成為抗AS替代療法研究的熱點。
膽固醇逆轉運(reverse cholesterol transport)是指外周組織過量膽固醇經由高密度脂蛋白(high-densi?ty lipoprotein,HDL)介導,通過血液循環轉運至肝臟,最終排出體外的過程[3]。膽固醇逆轉運是體內維持膽固醇代謝的經典途徑,可有效防止膽固醇在肝外組織累積,促進動脈血管壁膽固醇酯和游離膽固醇的清除,在AS的防治中發揮重要作用[4]。
中醫證候調研顯示,痰證在現代炎癥性疾病中占比高[5-6],同時血脂代謝異常已明確為中醫痰證的物質基礎之一[7-9]。溫膽湯(Wendan decoction)是中醫化痰的經典代表方,其始載于《千金要方》,被后世醫家廣泛應用于臨床實踐。近年相關研究顯示,加減溫膽湯干預有效抑制AS性病變的進展[10-11]。本團隊前期對溫膽湯及其類方的系列研究表明,溫膽湯能夠調節異常血脂代謝,改善AS 性心臟病患者臨床癥狀及預后[12-14]。本研究基于高脂飼料喂養的載脂蛋白E 基因敲除(apolipoprotein E gene knockout,ApoE?/?)小鼠AS疾病模型,從膽固醇逆轉運角度探討溫膽湯抗AS 的作用機制,以期為溫膽湯的臨床應用提供更加全面的科學依據,并為進一步開發靶點明確的抗AS中藥新制劑奠定基礎。
材料和方法
1 動物
SPF 級8 周齡ApoE?/?雄性小鼠75 只,SPF 級8 周齡C57BL/6 雄性小鼠15 只,體重(25±2)g。小鼠購自北京華阜康生物科技股份有限公司,飼養于廣東省中醫院動物實驗中心SPF 級動物房,飼養環境溫度為(22±2)℃,濕度為50%~60%,所有小鼠均可自由進食和飲水。人工控制室內照明,保持12 h 光照和黑暗交替循環。實驗動物許可證號為SYXK(粵)2018-0094。本研究經廣東省中醫院實驗動物倫理委員會審查批準。
普通飼料由廣東省中醫院動物實驗中心提供。高脂飼料(含15%豬油、2%膽固醇和0.05%膽酸)購于廣東省醫學實驗動物中心。
2 主要試劑和儀器
法半夏、竹茹、枳實、茯苓、橘皮、炙甘草和生姜購自廣東省中醫院;辛伐他汀購自廣州南新生物制藥有限公司;水合氯醛、油紅O 粉末和脫脂奶粉購自Sigma-Aldrich;蘇木素染液和伊紅染液購自碧云天生物技術有限公司;BCA 蛋白濃度試劑盒、5×SDS蛋白電泳上樣緩沖液和HaltTMProtease Inhibitor Single-Use Cocktail 購自Thermo Fisher Scientific;PhosStop購自Roche;抗ATP 結合盒轉運體A1(ATP-binding cassette transporter A1,ABCA1)抗體、抗小窩蛋白1(caveolin-1)抗體、抗B 類I 型清道夫受體(scavenger receptor class B type I,SR-BI)抗體和抗分化簇36(cluster of differentiation 36,CD36)抗體購自Ab?cam;GAPDH rabbit mAb、anti-rabbit IgG/HRP-linked antibody、anti-rat IgG/HRP-linked antibody 和antimouse IgG/HRP-linked antibody 購自Cell Signaling Technology;Immobilon ECL Ultra Western HRP Sub?strate購自Millipore。
7180全自動生化測試儀(Hitachi);高速低溫離心機(Eppendorf);Multiskan FC 自動酶標儀和組織包埋機(Thermo Fisher Scientific);BT125D 電子天平(Sar?torius);石蠟切片機和H1220 型烤片機(Lecia);垂直電泳儀、蛋白轉膜系統和ChemiDoc XRS 凝膠成像系統(Bio-Rad);MB-102 振蕩恒溫金屬浴(杭州博日科技有限公司);MS 3 digital渦旋混合器(IKA)。
3 方法
3.1 藥物配制 根據唐代孫思邈《千金要方》中所載溫膽湯,按原經方比例配伍。每克生藥加入6 mL超純水,浸泡30 min,加熱煮沸后文火繼續煎煮30 min,過濾至濾液自然滴盡,收集藥液;每克藥渣加入4 mL 超純水,再次煎煮,方法同前,合并兩次收集的濾液;使用旋轉蒸發儀,將濾液濃縮成浸膏;預冷冷凍干燥機,放入浸膏,制成凍干粉。按人和動物間體表面積折算系數換算,以溫膽湯臨床給藥劑量的0.5、1 和2 倍換算,分別設為低、中、高劑量溫膽湯組。按小鼠灌胃劑量10 mL/kg,使用3%羧甲基纖維素鈉溶液配制低、中、高劑量溫膽湯藥劑。
以人最大臨床辛伐他汀用量40 mg,按人和動物間體表面積折算系數換算,小鼠的給藥劑量為5 mg/kg。將辛伐他汀分散片碾碎,制成粉末狀。按小鼠灌胃劑量10 mL/kg,使用3%羧甲基纖維素鈉溶液配制辛伐他汀藥劑。
3.2 分組及給藥 將ApoE?/?小鼠隨機分為模型(model)組、辛伐他汀組、低劑量溫膽湯(low-dose Wendan decoction)組、中劑量溫膽湯(middle-dose Wendan decoction)組和高劑量溫膽湯(high-dose Wendan decoction)組,每組15 只。15 只相同遺傳背景的C56BL/6 小鼠為對照組。常規飲食適應性喂養1 周后,所有小鼠首次稱重,此后每周連續稱重并記錄,共10 周。適應性喂養1 周后ApoE?/?小鼠給予高脂飼料喂養,對照組小鼠給予普通飼料喂養。各干預組每日給予相應藥物灌胃,模型組和對照組每日給予等量生理鹽水灌胃。給藥持續10周。
3.3 觀察指標和方法 末次給藥后,小鼠禁食12 h。按照10 mL/kg,使用10%水合氯醛腹腔注射麻醉;眼眶靜脈叢采集血液標本;取血后將小鼠腹部朝上,四肢固定于取材板,沿腹部中線縱向剖開,充分暴露腹腔和胸腔;沿左心室心尖部插入針頭,注入預冷的生理鹽水,灌注至流出的液體清亮;體視顯微鏡下分離主動脈,剝離血管外模周脂肪組織,取下小鼠主動脈(主動脈弓至雙髂動脈分支,保留部分弓部分支,包括頭臂干、左頸總動脈和左鎖骨下動脈);剪下連有心臟的部分胸段主動脈;收集小鼠肝臟。
3.4 血脂水平的測定 血液標本收集于離心管中,靜置4 h;預冷離心機,4℃、1 500 r/min 離心15 min。收集血清,標記信息;每組分別隨機選取6 只小鼠血清,采用全自動生化分析儀檢測小鼠血清甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,TC)和低密度脂蛋白膽固醇(low-density lipoprotein choles?terol,LDL-C)和HDL-C水平。
3.5 油紅O染色檢測主動脈整體斑塊形成的情況各組分別隨機選取5 只小鼠整體主動脈,生理鹽水浸洗,放入4%多聚甲醛,4℃固定24 h;體視顯微鏡下縱向剖開,PBS 浸洗10 min;置于60%異丙醇中10 min;加入油紅O 工作液,室溫染色2 h;60%異丙醇分化,鏡下觀察至無背景色為止,拍照留存。使用Image-Pro Plus 6.0 軟件分析圖像,計算斑塊占比。斑塊占比(%)=斑塊面積/主動脈內壁面積×100%。
3.6 HE 染色檢測主動脈根部斑塊形成的情況 各組分別隨機選取5 只小鼠胸段主動脈,生理鹽水浸洗,放入4%多聚甲醛,4℃固定24 h;清水沖洗1 h,采用梯度乙醇脫水;放入二甲苯中浸沒1 h;將組織放入60℃石蠟溶液中;石蠟包埋組織,冷卻凝固,室溫儲存備用;使用石蠟切片機切取厚度為5 μm的組織切片,60℃烤片1 h,室溫保存;將切片放入二甲苯中脫蠟30 min,經無水乙醇、梯度乙醇各5 min,脫水完成后,超純水浸潤切片5 min×3 次;滴加蘇木素染色10 min,0.5%鹽酸酒精分化1 s,鏡下觀察細胞核呈藍紫色,其余組織無色,流水沖洗切片20 min 返藍;將切片放入伊紅溶液染色2 min,流水沖洗多余伊紅溶液,鏡下觀察切片顏色,細胞核呈藍色,細胞漿呈紅色或粉紅色;無水乙醇脫水1 min×2次,自然風干后中性樹膠封片,顯微鏡觀察切片并拍照留存。使用Image-Pro Plus 6.0 軟件分析圖像,計算斑塊占比。斑塊占比(%)=斑塊面積/主動脈內壁橫截面積×100%。
3.7 Western blot檢測主動脈ABCA1和caveolin-1及肝臟SR-BI 和CD36 蛋白的表達 各組隨機選取6 只小鼠的主動脈進行ABCA1蛋白表達量檢測,選取7只小鼠的主動脈進行caveolin-1蛋白表達量檢測,選取7只小鼠的肝臟進行SR-BI 和CD36 蛋白表達量檢測。取各組主動脈和適量肝臟組織,稱重記錄,根據組織重量加入適量裂解液,加入磁珠勻漿,冰上放置30 min;4℃、12 000 r/min離心30 min,收集上清液;取適量上清液用于BCA法蛋白濃度檢測,根據各組蛋白總體積,調整各組蛋白濃度一致;恒溫金屬浴100℃煮10 min,于?80℃凍存備用;每組取30~50 μg 蛋白,于10%SDS-PAGE分離蛋白;轉膜后,5%脫脂奶粉封閉2 h,加入一定稀釋比例的Ⅰ抗,4℃孵育過夜;TBST洗膜3 次,加入對應Ⅱ抗溶液,室溫孵育2 h;ECL 化學發光試劑顯影曝光。以GADPH 蛋白為內參照,使用Image Lab 5.1.0軟件進行蛋白條帶灰度分析。
4 統計學處理
運用SPSS 19.0 軟件進行統計分析。服從正態分布的計量資料以均數±標準差(mean±SD)表示。多組間比較采用單因素方差分析,組間多重比較采用Bonferroni校正t檢驗或Tamhane′s T2檢驗。以P<0.05為差異有統計學意義。
結 果
1 溫膽湯對ApoE-/-小鼠體重的影響
如圖1A 所示,首次稱重各組小鼠體重基線水平的差異無統計學顯著性(P>0.05)。此后,模型組與對照組、各給藥組之間體重差距逐漸拉大(圖2)。至第10 周,末次稱重結果顯示,與對照組相比,模型組小鼠體重顯著增加(P<0.01),而辛伐他汀組和各劑量溫膽湯組小鼠體重與對照組相比差異無統計學顯著性(P>0.05);辛伐他汀及中劑量溫膽湯干預顯著降低高脂飼料喂養ApoE?/?小鼠體重,與模型組相比差異有統計學意義(P<0.05),而低、高劑量溫膽湯組ApoE?/?小鼠平均體重與模型組比較稍有降低,但差異無統計學顯著性(P>0.05);辛伐他組與各劑量溫膽湯組小鼠體重比較差異無統計學顯著性(P>0.05);各劑量溫膽湯組間比較,小鼠體重的差異無統計學顯著性(P>0.05),見圖1B。
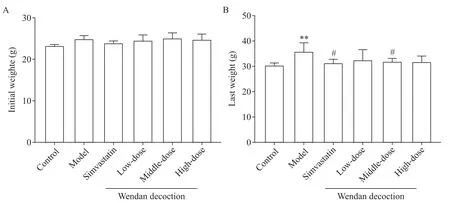
Figure 1.The initial weight and last weight of the mice.A:the initial weight of the mice after 1 week adaptation with general meals;B:the last weight of the mice before preoperative fasting.Mean±SD. n=15.**P<0.01 vs control group;#P<0.05 vs model group.圖1 小鼠初始體重和末次體重變化的比較
2 溫膽湯對ApoE-/-小鼠血清脂質水平的影響
如表1 所示,與對照組相比,模型組小鼠血清TG、TC 和LDL-C 水平均顯著增高,HDL-C 水平顯著降低(P<0.01);辛伐他組和各劑量溫膽湯組小鼠血清TC、LDL-C 和HDL-C 水平與對照組比較差異有統計學意義(P<0.05 或P<0.01),而TG 水平與對照組相比差異無統計學顯著性(P>0.05)。與模型組比較,辛伐他汀和各劑量溫膽湯均能夠顯著降低小鼠血清TG、TC和LDL-C水平(P<0.05或P<0.01),而辛伐他組和各劑量溫膽湯組血清HDL-C水平與模型組比較差異無統計學顯著性(P>0.05)。辛伐他組與各劑量溫膽湯組比較,中、高劑量溫膽湯降低TG 和TC水平的作用略優于辛伐他汀,辛伐他汀降低LDL-C水平的作用略優于各劑量溫膽湯,但差異無統計學顯著性(P>0.05)。各劑量溫膽湯組間差異無統計學顯著性(P>0.05),未表現出明顯的劑量依賴性。
3 溫膽湯對ApoE-/-小鼠主動脈整體斑塊形成的影響
如圖3所示,對照組C57BL/6小鼠主動脈內壁光滑,無明顯紅色著色斑塊;模型組小鼠主動脈內壁有明顯分散的紅色斑塊;辛伐他汀組和各劑量溫膽湯組小鼠主動脈內壁紅色斑塊面積較模型組減少。定量分析結果顯示,模型組小鼠主動脈整體平均斑塊占比達(29.90±4.48)%,辛伐他汀組平均斑塊占比(14.66±2.30)%,與模型組比較顯著降低(P<0.01);低、中、高劑量溫膽湯組小鼠主動脈平均斑塊占比分別 為(19.56±5.89)%、(14.86±4.47)%和(17.80±6.41)%,與模型組比較顯著降低(P<0.05 或P<0.01);各劑量溫膽湯組主動脈整體占比與辛伐他汀組比較差異無統計學顯著性(P>0.05);各劑量溫膽湯組間比較顯示,中劑量溫膽湯組主動脈整體斑塊占比最低,但各劑量組間的差異無統計學顯著性(P>0.05)。
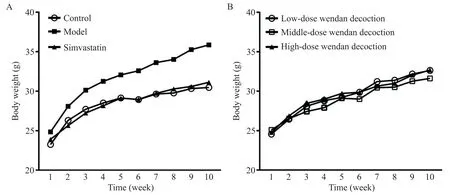
Figure 2.Changing trend of the mouse body weight.A:changing trend of the mouse body weight in control group,model group,and simvastatin group;B:changing trend of the mouse body weight in low-,middle-and high-dose Wendan decoction groups.Mean±SD. n=15.圖2 小鼠體重的變化趨勢
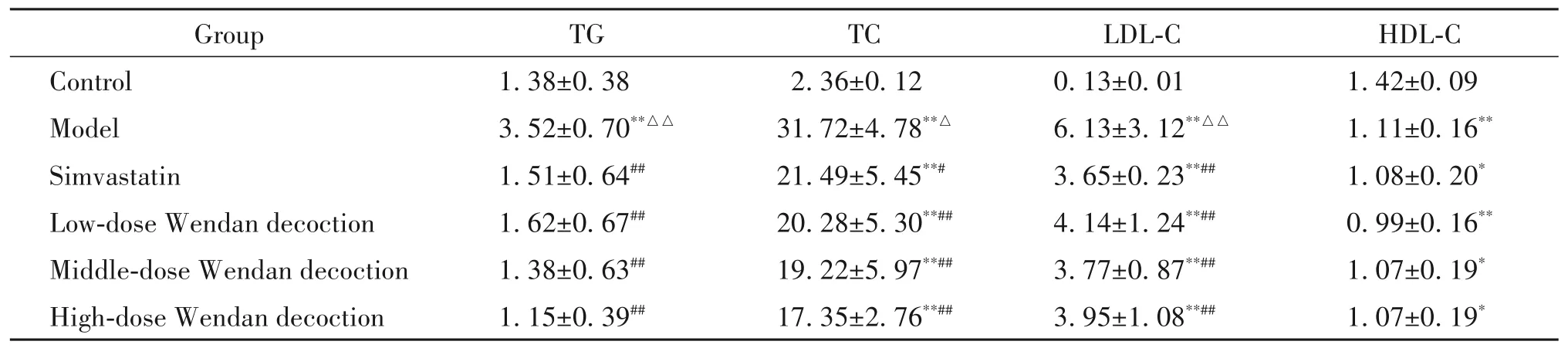
表1 小鼠血脂水平Table 1.Serum lipid levels of the mice(mmol/L.Mean±SD. n=6)
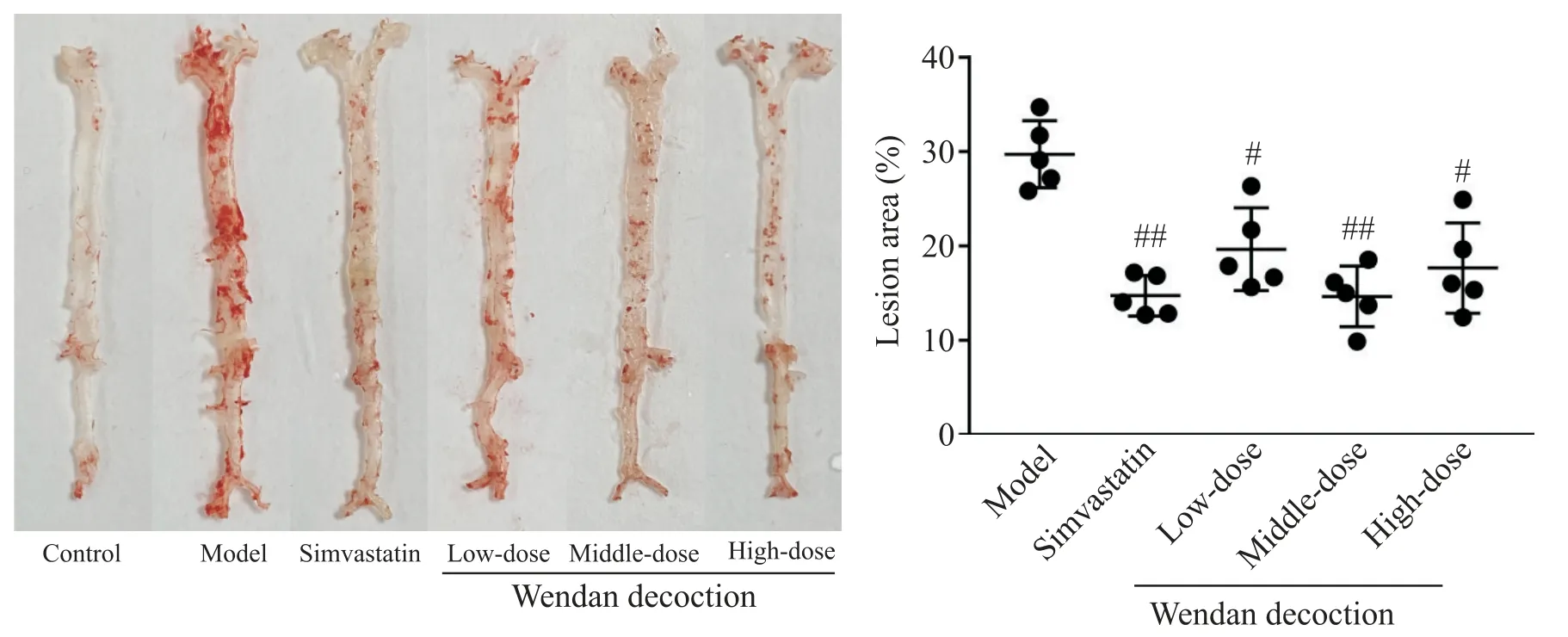
Figure 3.Atherosclerotic plaque buildup in whole aorta(oli red O staining)and quantitative analysis of lesion area.Mean±SD. n=5.#P<0.05,##P<0.01 vs model group.圖3 主動脈整體斑塊的油紅O染色和定量分析
4 溫膽湯對ApoE-/-小鼠主動脈根部斑塊形成的影響
如圖4 所示,對照組小鼠主動脈內壁邊緣平整,無斑塊;模型組小鼠主動脈內壁可見明顯斑塊凸起,斑塊內可見脂質空泡。定量分析結果顯示,模型組小鼠主動脈根部斑塊占比達(32.55±1.45)%;辛伐他汀組斑塊占比為(20.55±3.81)%,與模型組相比顯著降低(P<0.05);中、高劑量溫膽湯組斑塊占比分別為(20.98±1.87)%和(21.27±2.21)%,與模型組比較顯著降低(P<0.05),而低劑量溫膽湯干預后主動脈根部斑塊占比為(26.56±8.21)%,與模型組比較差異無統計學顯著性(P>0.05);辛伐他汀組與各劑量溫膽湯組比較差異無統計學顯著性(P>0.05);各劑量溫膽湯組中,中劑量組斑塊占比最低,低劑量組占比最高,但各劑量組間差異無統計學顯著性(P>0.05),見圖4。
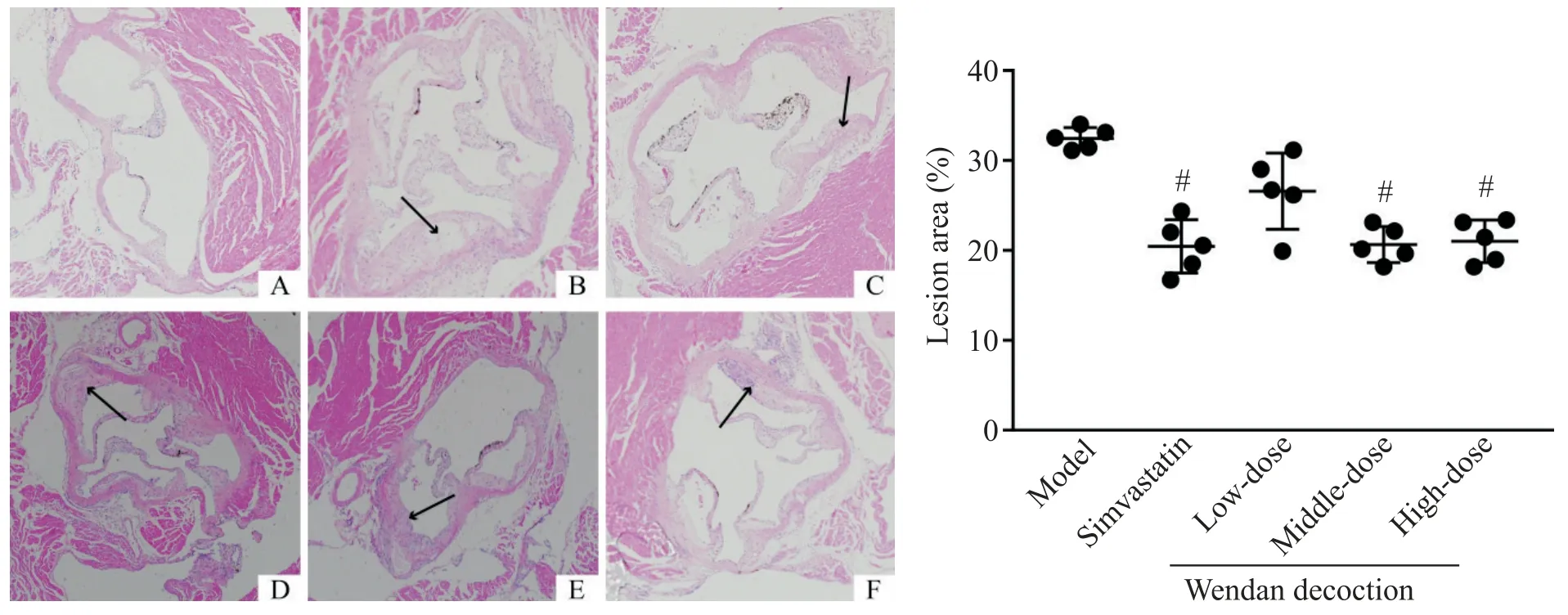
Figure 4.Atherosclerotic plaque buildup in aortic root(HE staining,×100)and quantitative analysis of the lesion area.A:control group;B:model group;C:simavastatin group;D:low-dose Wendan decoction group;E:middle-dose Wendan decoction group;F:high-dose Wendan decoction group.Black arrows indicated the atherosclerotic lesion.Mean±SD. n=5.#P<0.05 vs model group.圖4 主動脈根部斑塊的HE染色和定量分析
5 溫膽湯對ApoE-/-小鼠主動脈ABCA1和caveolin-1蛋白表達水平的影響
與對照組比較,模型組小鼠主動脈ABCA1 蛋白水平略微升高,但差異無統計學顯著性(P>0.05);辛伐他汀組和各劑量溫膽湯組ApoE?/?小鼠主動脈ABCA1 蛋白表達水平均顯著升高,與對照組和模型組比較差異均有統計學意義(P<0.01);各劑量溫膽湯組小鼠主動脈ABCA1 蛋白水平均高于辛伐他汀組,其中低劑量溫膽湯組與辛伐他組比較差異無統計學顯著性(P>0.05),而中、高劑量溫膽湯組與辛伐他汀組比較差異有統計學意義(P<0.05或P<0.01);各劑量溫膽湯組間比較結果顯示,中劑量溫膽湯提高ABCA1 蛋白表達水平的效果最佳,與低劑量溫膽湯組比較差異有統計學意義(P<0.01),但與高劑量溫膽湯組間的差異無統計學顯著性(P>0.05),見圖5A。
與對照組比較,模型組小鼠主動脈caveolin-1 蛋白表達水平顯著升高(P<0.01),而辛伐他汀組和各劑量溫膽湯組主動脈caveolin-1 蛋白水平與對照組比較差異無統計學顯著性(P>0.05);與模型組比較,辛伐他汀組和各劑量溫膽湯組caveolin-1 蛋白表達水平均顯著降低(P<0.01);辛伐他汀組與各劑量溫膽湯組小鼠主動脈caveolin-1 蛋白表達水平的差異無統計學顯著性(P>0.05);溫膽湯組間比較顯示,中劑量溫膽湯干預后小鼠主動脈caveolin-1 蛋白水平最低,但與低、高劑量溫膽湯組比較的差異無統計學顯著性(P>0.05),見圖5B。
6 溫膽湯對ApoE-/-小鼠肝臟SR-BI 和CD36 蛋白表達水平的影響
與對照組相比,模型組小鼠肝臟SR-BI蛋白表達水平的差異無統計學顯著性(P>0.05);辛伐他汀組和中、高劑量溫膽湯組小鼠肝臟SR-BI蛋白表達水平顯著升高,與對照組和模型組比較差異均有統計學意義(P<0.05或P<0.01),而低劑量溫膽湯組小鼠肝臟SR-BI 蛋白水平與對照組和模型組比較差異無統計學顯著性(P>0.05);辛伐他汀組與各劑量溫膽湯組比較差異無統計學顯著性(P>0.05);各劑量溫膽湯組間比較顯示,中劑量溫膽湯提高SR-BI蛋白水平的作用最顯著,但與低、高劑量溫膽湯組比較差異無統計學顯著性(P>0.05),見圖6A。
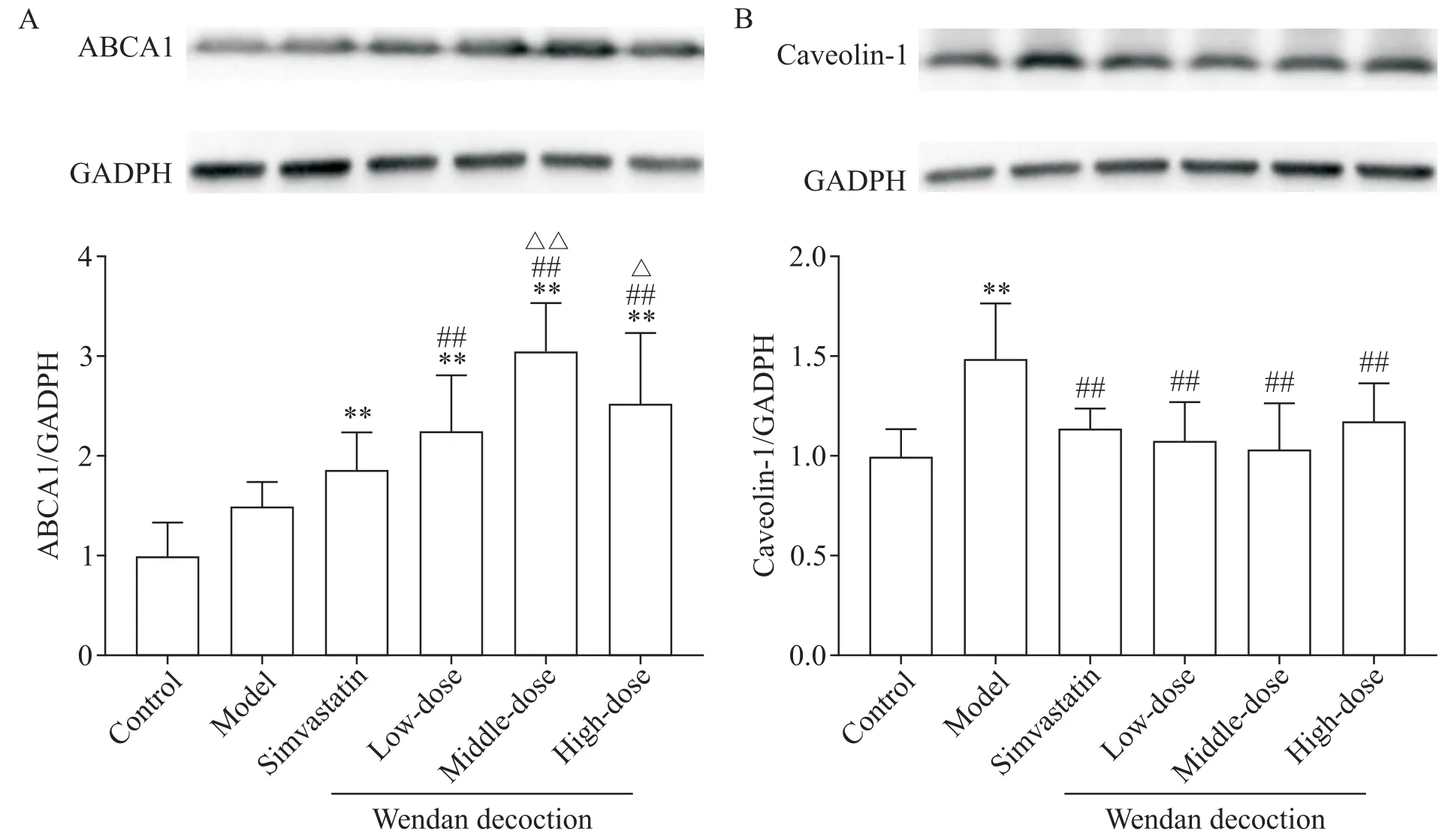
Figure 5.The protein levels of ABCA1(A)and caveolin-1(B)in the aorta of mice.Mean±SD. n=6 in A;n=7 in B.**P<0.01 vs control group;##P<0.01 vs model group;△P<0.05,△△P<0.01 vs simvastatin group.圖5 小鼠主動脈ABCA1和caveolin-1蛋白表達水平的比較
與對照組比較,模型組和各劑量溫膽湯組小鼠肝臟CD36 蛋白水平均顯著升高(P<0.05 或P<0.01),而辛伐他汀組與對照組比較差異無統計學顯著性(P>0.05);與模型組比較,辛伐他汀干預能夠明顯降低小鼠肝臟CD36蛋白表達水平,與模型組比較差異有統計學意義(P<0.05),而各劑量溫膽湯組與模型組比較差異無統計學顯著性(P>0.05);辛伐他組與各劑量溫膽湯組比較,差異無統計學顯著性(P>0.05);各劑量溫膽湯組間比較,差異無統計學顯著性(P>0.05),見圖6B。
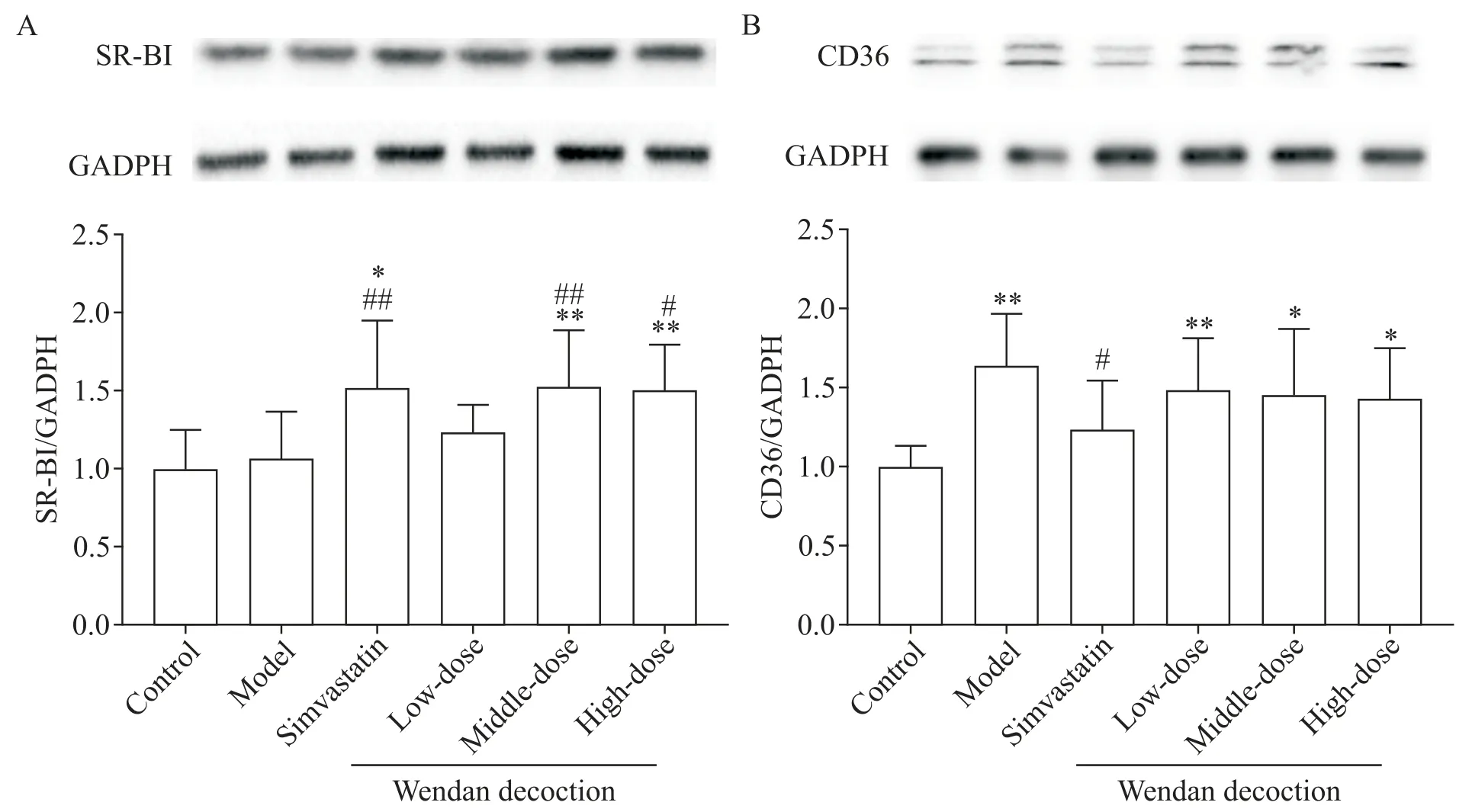
Figure 6.The proteins level of SR-BI(A)and CD36(B)in the liver of the mice.Mean±SD. n=7.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.圖6 小鼠肝臟SR-BI和CD36蛋白表達水平的比較
討 論
本研究發現,溫膽湯能夠抑制高脂飼料喂養的ApoE?/?小鼠體重增長;降低血清TG、TC 和LDL-C 水平,但對血清HDL-C水平無明顯影響;抑制主動脈整體及根部斑塊形成;能夠增加主動脈ABCA1 蛋白表達水平,降低主動脈caveolin-1 蛋白表達水平;并且增加肝臟SR-BI 蛋白表達水平,但對肝臟CD36 蛋白表達無明顯影響。
AS 是以巨噬細胞中脂質積聚并伴發炎癥為特征的病變過程。ApoE?/?小鼠的病理改變類似于人類Ⅱ型高脂血癥,AS 斑塊好發于主動脈瓣、主動脈弓、胸主動脈以及其他主動脈的主要分支點,且晚期病變斑塊易出現鈣化,ApoE?/?小鼠AS 病理改變可觀察到人類患者斑塊發展的所有階段,并且與臨床AS 患者病變特征十分相似,被廣泛運用于現代高脂血癥、冠心病及AS 疾病的研究中[15]。本研究中采用高脂飲食喂養的ApoE?/?小鼠作為AS 疾病模型,相同背景的C57BL/6 小鼠為對照組。小鼠正常飲食適應性喂養1 周后,首次稱量體重,結果顯示各組別小鼠初始體重基數無顯著差異;10周后,末次稱量體重結果顯示中劑量溫膽湯干預能夠抑制高脂飼料喂養ApoE?/?小鼠的體重增長。
對小鼠血清血脂水平檢測結果顯示,溫膽湯劑量依賴性降低ApoE?/?小鼠血清TG 和TC 水平。與模型組相比,高劑量溫膽湯組TG 水平降低78%,TC 水平降低46%,并且中、高劑量溫膽湯藥效有優于辛伐他汀的趨勢。同時,各劑量溫膽湯均顯著降低ApoE?/?小鼠血清LDL-C水平,以中劑量溫膽湯干預藥效最佳,與模型組相比降低了約39%。但各劑量溫膽湯干預對小鼠血清HDL-C 水平并未產生明顯影響。
此外,對各組小鼠主動脈整體和主動脈根部粥樣硬化斑塊的病理觀察結果顯示,溫膽湯能夠有效抑制主動脈整體及主動脈根部斑塊形成,以中劑量溫膽湯干預藥效最佳,與模型組相比斑塊占比分別降低了51%和36%。肥胖和高血脂是AS 疾病公認的危險因素,以上研究結果表明,溫膽湯能夠顯著抑制肥胖,調節血脂異常,并抑制AS病變的進展。
小窩是細胞膜上的特異性內陷結構,對膽固醇有很強的親和力。caveolin-1是研究小窩結構的標志性蛋白,廣泛表達于內皮細胞、平滑肌細胞、脂肪細胞和巨噬細胞等多種組織細胞表面,從而介導小窩結構的各種生物學功能[16]。研究顯示,caveolin-1 在調節胞內膽固醇平衡中發揮重要作用,caveolae 結構的缺失可能導致細胞內脂質和膽固醇的沉積,膽固醇外流減少,從而最終導致泡沫細胞形成[17]。然而有研究顯示,ApoE?/?小鼠中缺失caveolin-1,對其AS 斑塊的發展有抑制作用,當caveolin-1 在ApoE?/?小鼠內皮細胞中重新表達后,AS 病變范圍變大[18],其可能的原因是caveolin-1 介導的炎癥反應。多項研究均表明,caveolin-1 可以抑制多種炎癥因子的表達,抑制炎癥作用。而過量表達的caveolin-1 可促進單核細胞分化為巨噬細胞,促進內皮增生和炎癥反應,從而加速AS 病變進程[19-20]。有學者認為,caveo?lin-1所介導的小窩結構可能是炎癥應答和膽固醇逆轉運的共同分子平臺,脂質沉積可誘發炎癥反應,炎癥反應則加劇脂質積聚[21]。因此,維持caveolin-1 的正常表達水平尤為重要。我們研究發現,高脂飼料喂養10 周的ApoE?/?小鼠主動脈caveolin-1 表達水平異常增高,而溫膽湯能有效降低caveolin-1 蛋白表達水平,與對照組比較無顯著差異,說明溫膽湯能扭轉ApoE?/?小鼠主動脈caveolin-1蛋白的異常高水平表達狀態,有助于caveolin-1正常水平的維持。
ABCA1 也稱膽固醇流出調節蛋白,廣泛表達于參與脂質轉運的組織細胞中,如肝臟、小腸和巨噬細胞等,其以ATP 為能源介導細胞內膽固醇外流至外周HDL-C,從而密切參與細胞內脂質的清除[22]。研究顯示,ABCA1基因敲除小鼠盡管體內HDL-C 水平正常,其AS 病變仍持續加重[23]。而ABCA1基因過表達小鼠AS 病變減輕[24]。本研究發現,溫膽湯干預后,小鼠主動脈ABCA1 蛋白表達水平顯著增高,以中劑量組藥效最佳,約為模型組的2.2 倍。此外,模型組ApoE?/?小鼠主動脈ABCA1蛋白水平略高于對照組。已有研究表明,ABCA1 表達水平與細胞內膽固醇含量呈正相關,細胞內氧化型LDL 及乙酰化LDL均可促進ABCA1 mRNA和蛋白的表達,且AS早期病變處巨噬細胞聚集區可發現ABCA1的表達,而AS晚期病變處巨噬細胞聚集區則不表達ABCA1[25],所以我們推測模型組小鼠ABCA1 的增加可能是因為ApoE?/?小鼠體內高膽固醇水平引起ABCA1代償性上調的結果。
SR-BI是膽固醇雙向轉運蛋白,在巨噬細胞內表達,介導細胞內膽固醇外流至胞外HDL 處。而肝臟表達的SR-BI 能夠選擇性識別循環血流中的HDL,介導膽固醇轉運至肝臟,在機體膽固醇逆轉運過程發揮重要作用[26]。研究表明,肝臟過表達SR-BI可加速循環血流中HDL 的清除,并且促進機體膽固醇排泄,降低組織和血液循環中膽固醇水平,從而抑制AS 病變的進展[27]。本研究發現,中、高劑量溫膽湯能夠明顯促進ApoE?/?小鼠肝臟SR-BI蛋白表達,約為模型組的1.5 倍。同時我們認為溫膽湯對ApoE?/?小鼠血清HDL水平上調趨勢不顯著可能與其促進肝臟SR-BI表達有關。
CD36 也被認為是脂類和脂肪酸的受體,在相關的心臟活動中發揮作用[28]。在嚙齒類動物中,CD36依賴性的脂肪酸傳感已被發現,脂類傳感器是CD36的新功能。相關研究表明,CD36作為脂肪酸的轉運體主要參與長鏈脂肪酸的轉運,在CD36基因敲除小鼠中心臟、骨骼肌及脂肪組織長鏈脂肪酸的吸收量減少了約50%~80%,將CD36 重新轉入CD36基因敲除小鼠后一段時間,長鏈脂肪酸的吸收則恢復至正常水平[29]。在ApoE?/?小鼠肝臟CD36 蛋白水平的檢測中,我們發現溫膽湯并未明顯影響CD36蛋白的表達。還有研究表明,一些顯著促進膽固醇逆轉運過程的激動劑,如LXR 激動劑、PXR 激動劑等,由于將過量的脂類轉運集中至肝臟,并增加肝臟自身脂肪的合成,有誘發肝臟脂肪性病變的風險[30]。因此通過觀察肝臟脂肪酸轉運的主要蛋白CD36,可在一定程度上表明溫膽湯在促進ApoE?/?小鼠膽固醇逆轉運過程中誘發肝臟脂肪性病變副作用的風險,我們的研究結果顯示,各劑量溫膽湯組小鼠肝臟CD36蛋白水平與模型組相比有降低趨勢,說明溫膽湯在促進小鼠機體膽固醇逆轉運的同時,未表現出類似膽固醇激動劑上調CD36 蛋白而誘發肝臟脂肪病變的風險。
綜上所述,我們認為溫膽湯干預可有效降低高脂飼料喂養的ApoE?/?小鼠體重增長及血清TG、TC 和LDL-C 水平,并抑制主動脈粥樣硬化斑塊的形成。相關機制可能是:溫膽湯提高小鼠主動脈ABCA1 表達水平,維持主動脈caveolin-1 蛋白表達的正常水平,并且促進肝臟SR-BI 蛋白表達,從而促進主動脈病變處膽固醇逆轉運過程,抑制主動脈膽固醇沉積。此外,溫膽湯在促進膽固醇轉運至肝臟的同時,并未顯著增加小鼠肝臟CD36蛋白表達水平,可能在一定程度上避免現有膽固醇逆轉運相關激動劑誘發肝臟脂肪性病變的風險。

