溫陽化濁通絡方對系統性硬化病患者Th17 細胞增殖的影響
呂 芹韓 立 丁生晨 郭克磊臧文華張 鵬卞 華*
(1.南陽醫學高等專科學校,河南 南陽 473061;2.南陽理工學院張仲景國醫學院,河南 南陽 473004;3.河南省張仲景方藥與免疫調節重點實驗室,河南 南陽 473004)
系統性硬化病是一種以皮膚增厚和纖維化為主要表現的自身免疫性疾病,隨著疾病進展而累及多種內臟器官(如心、肺、腎、消化道等),10 年累積生存率為66.3%~77.5%[1],女性發病率約為男性的3~4 倍,治療方法以抗炎、改善血循環、抑制纖維化、免疫抑制及調節等為主,但均難以根治。目前認為,免疫學異常是系統性硬化病纖維化的一個重要因素,在其發病中起著主導作用[2],故從免疫調節角度開發有效的相關藥物是研究重點。
中醫認為,系統性硬化病屬“皮痹” “皮痹疽” 等范疇,病位在絡脈,與肺、脾、腎密切相關,以補肺健脾益腎治其本,化濁通絡治其標,具有療效好、不良反應少等優勢。溫陽化濁通絡方是課題組以黃芪桂枝五物湯、二仙湯、補肺湯等為基礎創制而成的,前期發現該方能降低系統性硬化病患者外周血輔助性T 細胞17 (Th17) 細胞及其分泌的細胞因子IL-17 水平,但其機制尚不明確[3]。Th17細胞參與機體免疫應答,在系統性硬化病進展和纖維化過程中發揮了重要作用[4];白細胞介素-6 受體(IL-6R) 是白細胞介素-6 (IL-6) 促進Th17 分化和增殖的重要因子,介導多種自身免疫性疾病的組織慢性炎癥反應,是治療系統性硬化病的潛在靶點[5-6];微小核糖核酸-155 (miR-155)可通過調節Th17 細胞增殖、分化、發育來介導自身免疫炎癥反應,并可調節機體IL-6 等細胞因子的分泌來調控Th17[7-8]。本實驗將考察溫陽化濁通絡方對Th17 細胞增殖的影響,探討其調控miR-155/IL-6R 通路治療系統性硬化病的作用機制。
1 材料
1.1 試劑與藥物 黃芪(產地山西)、黨參(產地山西)、山藥(產地河南)、熟地(產地河南)、淫羊藿(產地四川)、積雪草(產地云南)、桂枝(產地廣西)、白芥子(產地河南)、絲瓜絡(產地河南) 等溫陽化濁通絡組方藥材均購自河南省張仲景大藥房股份有限公司(南陽店),經南陽理工學院張超云副教授鑒定為正品,均符合2015 年版《中國藥典》 項下標準。人Th17 細胞磁性分選試劑盒(批號18F91695)、T Cell Exp Medium 無血清培養基(批號19C100395A),購自加拿大Stemcell 公司;miRNA Isolation Kit,購自美國Omega Bio-Tek 公司;All-in-OneTMmiRNA qRT-PCR Detection Kit,購自美國Genecopoeia 公司;RevertAid First Strand cDNA Synthesis 試劑盒(批號00591330)、LipofectamineTM3000 轉染試劑盒(批號1887047),購自美國賽默飛世爾公司;FastStart Universal SYBR Green qPCR 試劑盒(批號31598800),購自德國默克公司;miR-155 誘導劑agomir、miR-155 抑制劑antagomir,購自廣州銳博生物技術有限公司;PCR 引物、UNlQ-10 柱式Trizol 總RNA 抽提試劑盒(批號E613KA8742),購自生工生物工程(上海)股份有限公司;人IL-6、IL6-R 一抗及Alexa Fluor? 488(AF-488) -羊抗鼠、Alexa Fluor? 647 (AF-647) -羊抗兔二抗,購自美國Proteintech 公司。
1.2 動物 Wistar 大鼠60 只,雌性,體質量220~250 g,購自北京維通利華實驗動物技術有限公司,動物生產許可證號SCXK (京) 2016-0011,飼養及實驗操作均符合實驗動物倫理學要求。
1.3 儀器 ABI Veriti 96 W 梯度PCR 儀、ABI ViiA7 實時熒光定量PCR 儀,購自美國賽默飛世爾科技公司;CB160二氧化碳培養箱,購自德國Binder 公司;LSM800 激光共聚焦顯微鏡,購自德國蔡司公司。
2 方法
2.1 Th17 細胞分離 根據2013 年美國風濕病學會/歐洲風濕病學會聯合制定的系統性硬化病分類標準[9],選擇2018 年3 月至2019 年7 月在南陽市中心醫院治療的16 例系統性硬化病患者,男性2 例,女性14 例;平均年齡(51±13 歲);腎臟受累者3 例,抗核抗體陽性者15 例。患者簽署知情同意書后抽取外周血,密度梯度離心法分離外周血單核細胞(PBMC),Stemcell Th17 磁性分選試劑盒分離Th17 細胞,加到T Cell Exp Medium 無血清培養基中,于37 ℃、5% CO2條件下培養。本研究得到南陽市中心醫院倫理委員會的批準。
2.2 含藥血清制備 60 只大鼠隨機分為空白組及溫陽化濁通絡方低、中、高劑量組,每組15 只,空白組以等量生理鹽水灌胃,而溫陽化濁通絡方水煎濃縮至相當于原生藥1.5 g/mL 后,分別按15、30、60 g/kg 劑量每天灌胃,連續7 d。各組于末次灌胃給藥后60 min 內采血,分離血清,制備空白血清及不同劑量含藥血清,微孔濾膜過濾除菌,56 ℃下滅活30 min 后,-80 ℃冰箱保存備用。
2.3 含藥血清對Th17 細胞增殖的影響 調整Th17 細胞濃度為1×107/mL,根據文獻[10]報道的方法,采用追蹤活細胞分裂增殖過程的無細胞毒性熒光染料CFSE(5 μmol/L),在37 ℃下標記5 min,分為高、中、低劑量含藥血清組和空白血清組,加入不含ImmunoCult Hu CD3/CD28 T 細胞刺激劑的無血清T Cell Exp Medium 培養基,于37 ℃、5%CO2培養箱中培養,另設僅加入ImmunoCult Hu CD3/CD28 T 細胞刺激劑的陽性對照組。48 h 后收集細胞,通過流式細胞術檢測Th17 細胞中CFSE 熒光強度,Flowjo分析Th17 細胞增殖指數。
2.4 含藥血清對Th17 細胞miR-155 表達的影響 Th17 細胞以1×105/mL 濃度接種24 孔板,37 ℃、5% CO2條件下培養過夜。按照LipofectamineTM3000 轉染試劑盒說明書,分別轉染miR-155 誘導劑agomir (誘導表達陽性對照)、miR-155 抑制劑antagomir (抑制表達陽性對照),另設miR-155 干擾陰性對照組。轉染6 h 后,各轉染組分別加入10%低、中、高劑量含藥血清以及空白血清,48 h 后棄上清,PBS 緩沖液洗滌,按照miRNA Isolation Kit 說明書操作步驟提取miRNA,采用All-in-OneTMmiRNA qRT-PCR Detection Kit 逆轉錄,并以RT-qPCR 擴增miR-155,正向引物5′-GGGGGGTTAATGCTAATCGTG-3′,反向引物5′-TATGGTTGTTCACGACTCCTTCAC-3′;內參 RNAU6 正向引物 5′-CTCGCTTCGGCAGCACA-3′,反向引物 5′-AACGCTTCACGAATTTGCGT-3′,擴增條件為95 ℃預變性10 min,95 ℃變性30 s,60 ℃退火60 s,72 ℃延伸1 min,35 個循環。以RNAU6 為內參,通過2-△△Ct法計算各處理組miR-155 相對于對照組表達量的變 化,ΔΔCt=(Ct目標基因-Ct內參基因)處理組-(Ct目標基因-Ct內參基因)對照組。
2.5 含藥血清對Th17 細胞IL-6、IL-6R mRNA 表達的影響 Th17 細胞接種、培養、轉染、分組同上,轉染6 h 后各轉染組加入10% 低、中、高劑量含藥血清及空白血清,48 h后棄上清,PBS 緩沖液洗滌,按照UNlQ-10 柱式Trizol總RNA 抽提試劑盒說明書操作步驟提取總RNA,逆轉錄合成cDNA,RT-qPCR 擴增IL-6、IL-6R mRNA,IL-6 正向引物 5′-CCTGATCCAGTTCCTGCAGA-3′,反向引物 5′-GAACTCCTTAAAGCTGCGCA-3′;IL-6R 正向引 物 5′-GAATCTTGCAGCCTGATCCG-3′,反向引物 5′-GACCGTTCAGCCCGATATCT-3′。內參基 因GAPDH 正向引 物5′-GAGTCAACGGATTTGGTCGT-3′,反向引物5′-GACAAGCTTCCCGTTCTCAG-3′,擴增條件及IL-6、IL-6R 相對于對照組表達量的計算方法同上。
2.6 含藥血清對Th17 細胞中IL-6、IL-6R 蛋白表達的影響 分組及Th17 細胞接種濃度同上,各組細胞于37 ℃、5%CO2培養箱中孵育48 h 后棄去培養基,PBS 緩沖液洗滌,4%多聚甲醛固定5 min,PBS 緩沖液洗滌3 次,含0.5%Triton X-100 的PBS 通透10 min,含5%羊血清的PBS 室溫封閉1 h,按照說明書推薦比例加入IL-6、IL-6R 蛋白一抗,室溫下孵育1 h,0.01% Triton X-100/PBS 緩沖液洗滌3 次,加入與一抗對應的AF488 或AF647 熒光標記二抗,室溫下孵育1 h,含0.01% Triton X-100 的PBS 緩沖液洗滌3 次,DAPI 染細胞核5 min,PBS 緩沖液洗滌后滴加適量防熒光淬滅封片劑,在蔡司激光共聚焦顯微鏡下觀察拍照,通過Zen 軟件分析各組蛋白表達的平均熒光強度。
2.7 統計學分析 通過SPSS 25.0 軟件進行處理,計量資料以() 表示,組間比較采用單因素方差分析。以P<0.05 為差異具有統計學意義。
3 結果
3.1 含藥血清對Th17 細胞的增殖抑制作用 與空白血清組比較,經CD3/CD28 T 細胞刺激劑處理后Th17 細胞增殖指數升高(P<0.01),而經含藥血清處理后受到抑制(P<0.01),并呈劑量依賴性,見圖1。

圖1 含藥血清對Th17 細胞增殖指數的影響
3.2 含藥血清對miR-155 表達的影響 miR-155 agomir 誘導前,含藥血清可劑量依賴性地抑制miRNA 155 表達(P<0.01);miR-155 agomir 誘導后,與空白血清組比較雖然miR-155 表達升高,但含藥血清仍可部分抑制miR-155 表達(P<0.01);miR-155 antagomir 抑制miR-155 表達后,與空白血清組比較,含藥血清組對其表達無明顯抑制作用(P>0.05),表明miR-155 是含藥血清的潛在作用靶點,見圖2。
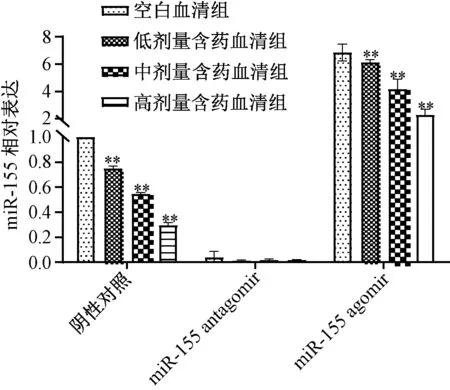
圖2 miR-155 agomir 誘導前后含藥血清對miR-155表達的影響
3.3 含藥血清對IL-6、IL-6R mRNA 表達的影響 miR-155 agomir 誘導前,含藥血清可劑量依賴性地抑制IL-6、IL-6R mRNA 表達;miR-155 agomir 誘導后,與空白血清組比較,含藥血清組仍可抑制兩者mRNA 表達(P<0.01);miR-155 antagomir 抑制miR-155 表達后,與空白血清組比較,含藥血清組對IL-6R mRNA 表達無明顯抑制作用(P>0.05),但仍劑量依賴性地抑制IL-6 mRNA 表達,提示IL-6R 可能是miR-155 的靶基因,含藥血清可能直接通過后者對前者mRNA 進行靶向調控,見圖3~4。
3.4 含藥血清對IL-6、IL-6R 蛋白表達的影響 與空白血清組比較,含藥血清組可劑量依賴性地抑制Th17 細胞中IL-6、IL-6R 蛋白表達,兩者平均熒光強度降低(P<0.05,P<0.01);miR-155 agomir 誘導miR-155 表達后,與空白血清組比較,含藥血清組仍對兩者蛋白表達具有一定抑制作用,平均熒光強度有一定程度的下降(P<0.01);miR-155 antagomir 抑制miR-155 表達后,與空白血清組比較,含藥血清組對IL-6R 蛋白表達無明顯抑制作用(P>0.05),但仍可抑制IL-6 蛋白表達(P<0.01),提示含藥血清對IL-6R 的調控可能與調控miR-155 有關,見圖5~7。

圖3 miR-155 agomir 誘導前后含藥血清對IL-6 mRNA 表達的影響

圖4 miR-155 agomir 誘導前后含藥血清對IL-6R mRNA 表達的影響
4 討論
系統性硬化病致病因素眾多,包括遺傳、感染、血管異常、免疫異常等,目前認為其主要發病機制為患者免疫系統受到致病因素干擾,使免疫細胞和淋巴系統失去正常功能。西醫治療系統性硬化病以藥物為主,但其療程較長,不良反應較多,易造成患者肝腎功能損害及并發癥,依從性差,從而影響其長期療效[11];中醫認為,系統性硬化病屬于“皮痹” 范疇,早在《素問·痹論》中就有記載,積累了豐富的臨床經驗,療效顯著,不良反應少。中藥復方具有多成分、多靶點的特點,在現代藥理研究中已證實其療效機制,如軟皮湯、溫陽除痹湯等在硬皮病模型小鼠中能抑制Ⅰ、Ⅲ型膠原合成,在皮膚成纖維細胞中可通過抑制增殖、誘導凋亡、改善其促纖維化表型來發揮抗纖維化作用[12-13];五痹膠囊能提高輔助性T 細胞的功能,降低免疫球蛋白表達[14]。
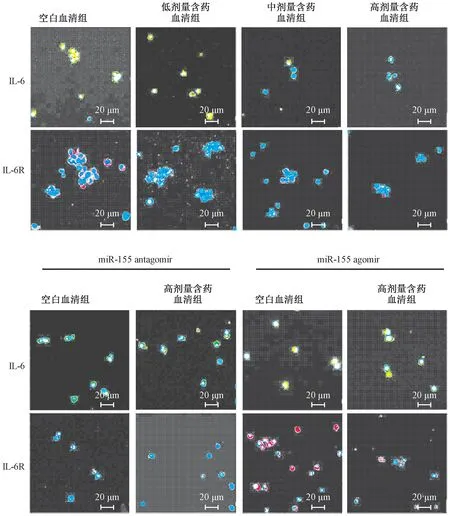
圖5 各組IL-6、IL-6R 蛋白表達的影響(400×)
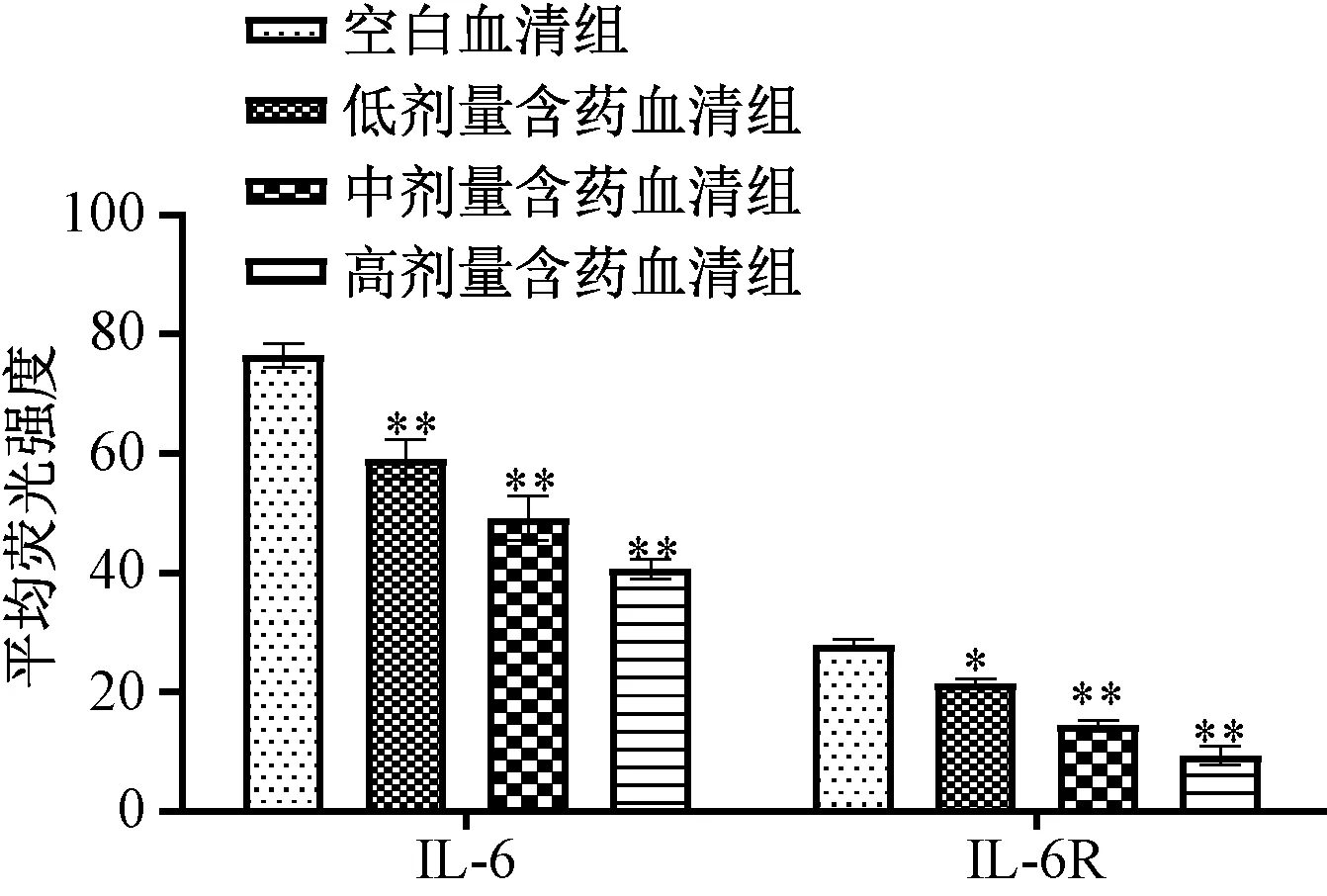
圖6 miR-155 agomir 誘導前含藥血清對IL-6、IL-6R 蛋白表達的影響
課題組前期研究發現,溫陽化濁通絡方可阻止系統性硬化病皮膚成纖維細胞周期由G1期進入S 期,下調凋亡抑制蛋白survivin、細胞周期蛋白cyclin D1 mRNA 及蛋白表達,具有促凋亡、抑制增殖作用,從而發揮其抗纖維化作用[15];Ebrahimiyan 等[16]發現,系統性硬化病患者外周血T 細胞中survivin 表達增高與成纖維細胞凋亡受抑、自身免疫反應和纖維化密切相關,miR-150-5p、miR-16-5p、miR-485-5p 與survivin 變異體(survivin-ΔEx3、survivin-2B、survivin-3B 等) 總表達呈負相關;Sandhu 等[17]發現,miR-155 高表達與B 細胞中cyclin D1、IL-6 表達增高密切相關,進而使B 細胞異常增殖,凋亡受到抑制,以上結果表明miR-155 及其他miR、IL-6 都可能參與了對survivin、cyclin D1 的調控,從而促進系統性硬化病進展。miR-155 可通過調節Th17 細胞的增殖、分化、發育來介導自身免疫炎癥反應;在CD4+T 淋巴細胞分化為Th17 細胞的過程中,IL-6首先與其受體IL-6R 結合,激活非受體型蛋白酪氨酸激酶,進一步啟動Th17 細胞因子IL-17 A/F 等反向相關基因表達[6],故抑制Th17 細胞異常增殖,靶向調控miR-155、IL-6 或IL-6R 是治療系統性硬化病的有效措施之一。
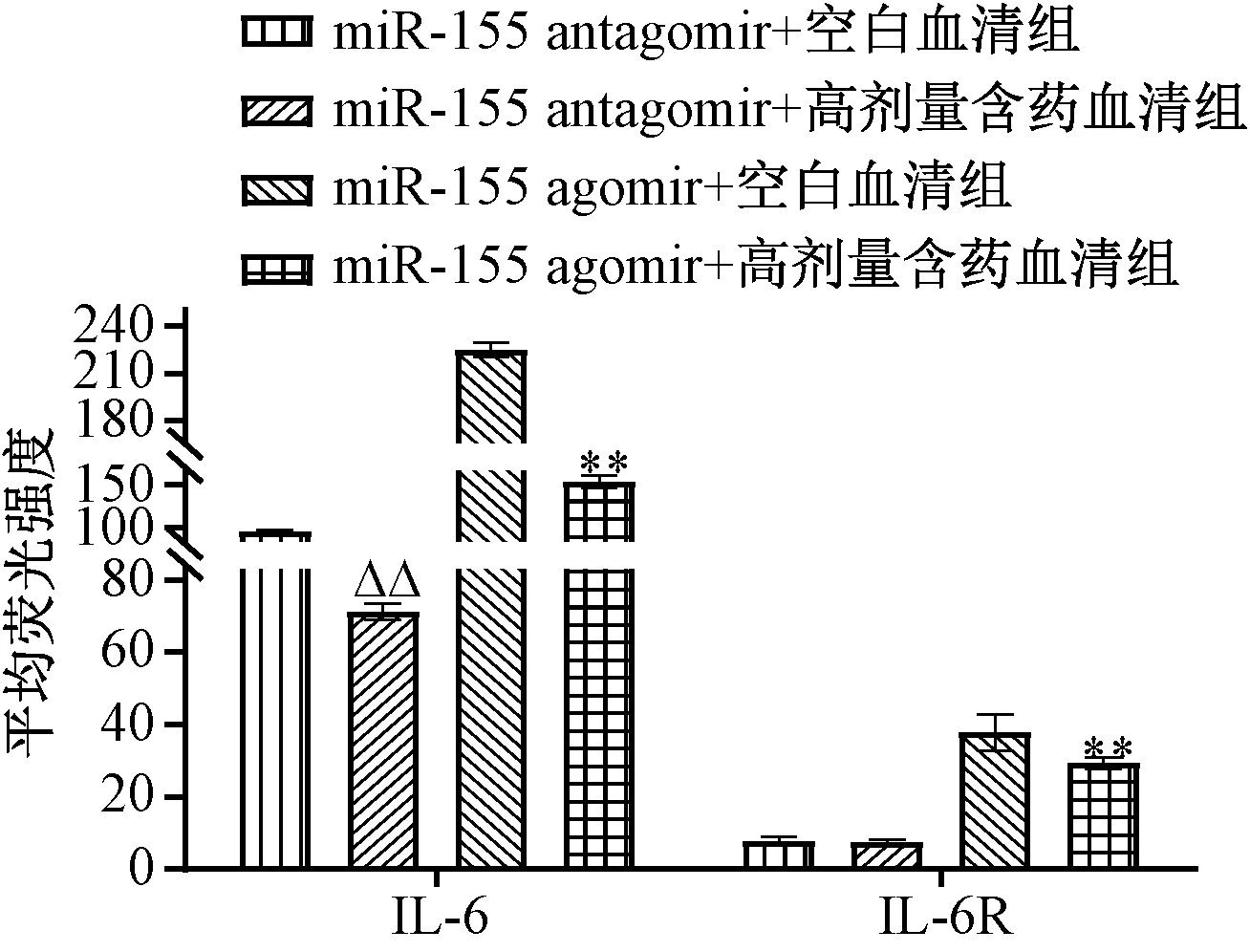
圖7 miR-155 agomir 誘導后含藥血清對IL-6、IL-6R 蛋白表達的影響
miR 是一種不編碼蛋白質的內源性小分子RNA,通過完全或非完全互補于靶基因的3′-非編碼區域(UTR),在轉錄后水平降解靶mRNA 或阻礙其翻譯,參與調節各種生物過程,包括促進免疫細胞的分化成熟、抗體產生、炎性介質釋放、參與炎癥信號通路等[18]。Antagomir 是根據miR成熟體序列設計,經過特殊標記與化學修飾的單鏈小RNA,通過與細胞內的成熟miR 強競爭性結合,阻止miR與其靶基因mRNA 的互補配對,抑制miR 發揮作用;Agomir 是經過特殊標記和化學修飾的雙鏈小RNA,通過模擬內源性的miRNA 來調節靶基因的生物學功能,本實驗通過miR-155 antagomir、agomir 分別阻斷、模擬miR-155 表達,探討溫陽化濁通絡方含藥血清是否通過miR-155 靶向調控IL-6 和IL-6R 的表達。結果表明,miR-155 antagomir阻斷miR-155 表達后,雖然IL-6、IL-6R mRNA 和蛋白表達均受到抑制,但含藥血清仍能降低IL-6 mRNA 和蛋白表達,表明對IL-6 的抑制可能部分地通過抑制miR-155 實現。而含藥血清對IL-6R 的抑制作用可能通過直接抑制miR-155實現,這與miR 數據庫Targetscan 預測IL-6R 是miR-155 靶基因一致。
綜上所述,溫陽化濁通絡方可劑量依賴性地抑制Th17細胞的增殖和miR-155 表達,從而發揮對系統性硬化病的免疫治療作用,其機制可能與抑制IL-6、IL-6R mRNA 和蛋白表達有關,而對IL-6R 的抑制作用可能與靶向調控miR-155 表達有關,但該方是否存在其他調控IL-6、IL-6R 通路的機制尚不明確,仍需作進一步研究來證實。

