苦參素對缺氧/復氧損傷乳鼠心肌細胞線粒體保護作用的研究
楊 超
線粒體是細胞有氧呼吸和能量轉化的主要場所,主要由雙層生物膜和嵴構成。缺氧/復氧(hypoxia/reoxygenation,H/R)導致線粒體電子傳遞鏈受阻,致使活性氧(reactive oxygen species,ROS)大量產生與過剩而引發氧化應激損傷,是各類缺血性心血管疾病共同的病理通路[1,2]。因此,保護線粒體對改善缺血性心血管疾病具有重要意義。苦參素(oxymatrine,OMT)又名氧化苦參堿,是中藥苦參的主要活性成分,化學結構屬于喹諾西啶類生物堿,具有良好的抗氧化活性[3]。目前臨床上主要用于慢性乙型病毒性肝炎及腫瘤放化療引起的白細胞減少癥的治療,近年來研究發現OMT對缺血性腦損傷后神經元線粒體具有保護作用[4]。本研究將通過建立體外H/R損傷乳鼠心肌細胞模型,探究OMT對H/R所致乳鼠心肌細胞線粒體損傷的保護作用及其可能的機制。
材料與方法
1.實驗動物:SPF級SD大鼠乳鼠(<24h),購自河北省實驗動物中心,實驗動物許可證號:SCXK(冀)2018-004。
2.藥物與試劑:OMT(純度≥98%)購自南京澤朗醫藥科技有限公司(批號:20190331);DMEM培養基、胰酶購自美國Gibco公司;胎牛血清、Annexin V-FITC/PI凋亡試劑盒購自美國Invitrogen 公司;二甲基亞砜(DMSO)購自國藥集團化學試劑有限公司;NADH脫氫酶(ND)、琥珀酸脫氫酶(SDH)、細胞色素氧化酶(CCO)、Na+-K+-ATP酶、Ca2+-ATP酶和ATP檢測試劑盒購自北京索萊寶科技有限公司;膜電位(△ψm)、膜通透性轉換孔(MPTP)開放度檢測試劑盒購自上海碧云天生物科技有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)檢測試劑盒購自北京博奧森生物科技有限公司。
3.乳鼠心肌細胞分離與體外培養:參照李雪麗等[5]報道的方法,無菌操作臺取乳鼠心臟心室組織,剪碎后加濃度0.625g/L胰酶和濃度0.05g/L的Ⅱ型膠原酶后恒溫37℃消化,細胞懸液過200目篩,1500r/min離心10min取沉淀,以DMEM培養液(含10%胎牛血清)重懸后,經37℃、5%CO2壁立1h,收集未貼壁細胞并調整細胞濃度為6×105個/毫升,接種于35mm培養皿,置于37℃、5%CO2、100%濕度細胞培養箱中72h后,細胞呈同步搏動,用于實驗。
4.乳鼠心肌細胞分組、給藥與H/R損傷細胞模型制備:取對數生長期乳鼠心肌細胞,消化、重懸后調整細胞濃度為6×105個/毫升,設正常組、H/R組和OMT低、中、高劑量(20、40、80μg/ml)組,每組設10皿;造模前30min給藥干預[6]。除正常組外,其余各組棄培養液并用無糖DMEM沖洗3遍,2毫升/皿加入無糖DMEM培養基(預充95%N2和5%CO2混合氣15min),置缺氧盒(通入95%N2和5%CO2混合氣,流速1L/min),15min后將缺氧盒置細胞培養箱2.5h為缺氧過程,然后取出培養皿棄上清液,2毫升/皿加入含糖DMEM培養基,置37℃、5%CO2、100%濕度細胞培養箱培養,即復氧。復氧2h后行各指標檢測。
5.線粒體提取:復氧2h后,取各組細胞,經0.25%胰酶消化后,4℃、650×g離心力離心5min收集細胞,加入4℃預冷裂解液于冰上裂解30min后,4℃、650×g離心力離心20min取上清液,然后4℃、7700×g離心20min取沉淀,即為線粒體,通過Lowry法檢測蛋白濃度。
6.線粒體生化指標檢測含量檢測:取1mg蛋白量線粒體,參照試劑盒操作說明進行處理后,采用比色法,通過紫外-可見分光光度計檢測線粒體ND、SDH、CCO活性和ATP含量。參照試劑盒操作說明進行處理后,通過紫外-可見分光光度計檢測線粒體Na+-K+-ATP酶、Ca2+-ATP酶活力;通過原子化學發光法檢測游離Ca2+濃度。參照試劑盒操作說明進行處理后,遵照△ψm和MPTP開放度檢測試劑盒說明,通過熒光酶標儀檢測△ψm水平(激發波長485nm,發射波長590nm)和MPTP開放度(激發波長540nm,發射波長580nm)。
7.線粒體超微結構觀察:復氧2h后,取各組細胞,經0.25%胰酶消化、無血清DMEM培養基洗滌3次后離心取細胞,置2.5%戊二醛固定2h、1%四氧化鋨固定15min后梯度乙醇脫水、丙酮沖洗、環氧樹脂包埋后行60nm超薄切片,醋酸鈉染色、檸檬酸鉛染色并晾干后,通過透射電子顯微鏡(TEM)觀察線粒體超微結構。
8.線粒體MDA含量和SOD、CAT活力檢測:經4℃、超聲波破碎線粒體后,遵照試劑盒操作說明,采用硫代巴比妥酸法檢測MDA含量,黃嘌呤氧化法、鉬酸銨法分別檢測SOD、CAT活力。
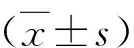
結 果
1.OMT對H/R損傷乳鼠心肌細胞線粒體呼吸酶活性和ATP含量的影響:與正常對照組比較,H/R組乳鼠心肌細胞線粒體ND、SDH、CCO活性和ATP含量均顯著降低,差異有統計學意義(P<0.01);與H/R組比較,OMT中、高劑量組ND、SDH、CCO活性和ATP含量均顯著升高,差異有統計學意義(P<0.05),詳見表1。

表1 OMT對H/R損傷乳鼠心肌細胞線粒體呼吸酶活性和ATP含量的影響
2.OMT對H/R損傷乳鼠心肌細胞線粒體Na+-K+-ATP酶、Ca2+-ATP酶活力和Ca2+濃度的影響:與正常對照組比較,H/R組乳鼠心肌細胞線粒體Na+-K+-ATP酶、Ca2+-ATP酶活力顯著降低,游離Ca2+濃度顯著升高,差異有統計學意義(P<0.01);與H/R組比較,OMT中、高劑量組Na+-K+-ATP酶、Ca2+-ATP酶活力顯著升高且游離Ca2+濃度顯著降低,差異有統計學意義(P<0.05),詳見表2。

表2 OMT對H/R損傷乳鼠心肌細胞線粒體Na+-K+-ATP酶、Ca2+-ATP酶活力和游離Ca2+濃度的影響
3.OMT對H/R損傷乳鼠心肌細胞線粒體△ψm和MPTP開放度的影響:與正常對照組比較,H/R組乳鼠心肌細胞線粒體△ψm顯著降低、MPTP開放度顯著升高,差異有統計學意義(P<0.01);與H/R組比較,OMT中、高劑量組△ψm顯著升高且MPTP開放度顯著降低,差異有統計學意義(P<0.01),詳見表3。

表3 OMT對H/R損傷乳鼠心肌細胞線粒體△ψm和MPTP開放度的影響
4.OMT對H/R損傷乳鼠心肌細胞線粒體超微結構的影響:TEM下可見,正常對照組乳鼠心肌細胞線粒體形態和線粒體膜、線粒體嵴等均未見異常;H/R組可見線粒體數量減少、膜腫脹破裂、膜磷脂層破壞、線粒體嵴溶解斷裂等超微結構病變;與H/R組比較,OMT處理組線粒體膜、嵴超微結構病變明顯改善,其中OMT高劑量組線粒體膜、嵴結構較為完整,優于其他組,詳見圖1。

圖1 OMT對H/R損傷乳鼠心肌細胞線粒體超微結構的影響(TEM,×10000)A.正常對照組;B.H/R組;C.OMT低劑量組;D.OMT中劑量組;E.OMT高劑量組
5.OMT對H/R損傷乳鼠心肌細胞線粒體MDA含量和SOD、CAT活力的影響:與正常對照組比較,H/R組乳鼠心肌細胞線粒體MDA含量顯著升高,SOD、CAT活力顯著降低,差異有統計學意義(P<0.01);與H/R組比較,OMT中、高劑量組MDA含量顯著降低,SOD、CAT活力顯著升高,差異有統計學意義(P<0.05),詳見表4。

表4 OMT對H/R損傷乳鼠心肌細胞線粒體MDA含量和SOD、CAT活力的影響
討 論
隨著高血壓、高血脂、高血糖等基礎疾病患病人群的增加,心肌梗死發生率呈逐年上升趨勢,及時疏通血管、恢復血氧供應是臨床搶救心肌梗死患者的關鍵,但恢復氧供后ROS大量釋放導致的氧化應激反應,是引發二次損傷并嚴重影響預后的重要因素[7]。線粒體是心肌細胞最重要的細胞器,缺氧/復氧導致其電子傳遞鏈受阻是ROS生成的主要原因,并且ROS將攻擊破壞線粒體膜和嵴結構,導致線粒體內細胞色素C釋放并誘導細胞凋亡與自噬,從而加重病情[8]。因此保護線粒體對改善缺血性心血管疾病預后至關重要。
有氧呼吸是實現能量轉換、產生ATP并為機體供給能量的主要途徑,而線粒體是實現該過程的場所。有氧呼吸過程依賴于線粒體內呼吸酶(ND、SDH、CCO)的催化作用。生理狀態下,體內ROS生成與代謝清除維持動態平衡,但缺氧/復氧將病理性刺激ROS大量釋放致使抗氧化酶(SOD、CAT)被過度消耗,不能及時代謝清除的ROS將攻擊破壞核酸、蛋白質等大分子,攻擊生物膜不飽和脂肪酸生成具有生物毒性的MDA[9,10]。正常的線粒體△ψm水平對維持線粒體功能至關重要,Alizadeh等[11]研究發現△ψm降低將直接影響ATP合成。MPTP開放度病理性升高將破壞離子平衡,導致ROS生成、△ψm下降、細胞色素C釋放,加重線粒體損傷[12]。
本研究通過分離并體外培養乳鼠心肌細胞,制備H/R損傷心肌細胞模型,發現模型細胞線粒體呈現數量減少、膜腫脹破裂、膜磷脂層破壞、線粒體嵴溶解斷裂等超微結構病變,該結果與陳克芳等[13]研究報道一致;造模前30min給予OMT進行干預,能夠明顯提高線粒體ND、SDH、CCO活性和ATP含量,降低MDA含量并提高SOD、CAT活力,明顯改善線粒體超微結構病變,提高線粒體△ψm并降低MPTP開放度,提示OMT對H/R所致乳鼠心肌細胞線粒體結構和功能損傷具有保護作用,可能與抑制氧化應激和維持線粒體膜穩定性有關。
線粒體具有儲存Ca2+并維持細胞內Ca2+動態平衡的作用,線粒體的吸收和釋放依賴Na+-Ca2+交換和Ca2+-ATP酶。ATP酶活力具有ATP依賴性,當線粒體結構和功能受損導致ATP合成受阻時將直接導致ATP酶活力降低。Ca2+-ATP酶活力降低將導致Ca2+泵出功能障礙,而Na+-K+-ATP酶活力降低將引發Na+-Ca2+交換使Ca2+大量進入線粒體,從而引發線粒體Ca2+超載[14]。過量的Ca2+能夠破壞線粒體氧化磷酸化過程使ATP合成受阻,進一步抑制ATP酶活性,從而形成“ATP合成受阻-Ca2+超載”的惡性循環,加重心肌組織損傷[15]。本研究發現,造模前30min給予OMT進行干預,能夠明顯提高Na+-K+-ATP酶、Ca2+-ATP酶活力并降低游離Ca2+濃度,提示抑制Ca2+超載可能是OMT保護H/R所致乳鼠心肌細胞線粒體損傷的重要機制之一。
綜上所述,OMT對H/R所致乳鼠心肌細胞線粒體結構和功能損傷具有一定的保護作用,作用機制可能與抑制線粒體Ca2+超載、抑制氧化應激和維持膜穩定性有關。

