抗抑郁藥物治療前后抑郁癥患者血清膠質纖維酸性蛋白的變化*
郭彥祥 杜向農 翟媛媛 李定杰 敖 磊 行養玲 朱俊艷 王 磊
抑郁癥是一種精神科常見的致殘性疾病,世界范圍內的發病率不斷提高。有研究顯示,在美國抑郁癥的終生患病率達到16%[1]。同樣是在美國,其他研究顯示近四分之一的女性和六分之一的男性在其一生中經歷過抑郁癥,其中多達65%的比例存在反復發作[2,3]。更為麻煩的是,許多抑郁癥患者從未接受過診斷或治療,只有30%~35%的成年人通過目前的治療方法獲得了緩解,增加了超過三分之二的疾病負擔[4]。關于抑郁癥發病機制的研究一直是精神科領域的熱點。
抑郁癥的發生涉及心理、人格、社會、文化、家庭、生理、生化、基因遺傳等一系列原因。近二十年來的研究證據顯示,星形膠質細胞(Ast)不僅參與大腦代謝、突觸間神經遞質傳遞和神經元之間溝通[5],也參與了許多神經精神疾病如抑郁癥的病理過程[6];而膠質纖維酸性蛋白(Glial Fibrillary Acidic Protein,GFAP)作為中樞神經系統Ast所獨有的細胞骨架蛋白,也是其活化的特征性標志物,Ast損傷后可以導致GFAP表達增加,并反映了中樞神經系統損傷的程度,也與抑郁癥等精神疾病的發病有關[7]。本研究通過探討抗抑郁藥物治療前后GFAP變化來明確其相互關系,為闡明抑郁癥的發病機理及其相關因素提供新的視角。
1 對象與方法
1.1 對象 研究組為2018年3月~2019年4月西安市精神衛生中心門診或住院患者。入組標準:(1)符合美國精神障礙診斷與統計手冊第4版(DSM-IV)抑郁癥診斷標準;(2)發病2周內從未接受過任何抗抑郁治療;(3)北方漢族,年齡16~55歲,性別不限,受教育年限≥6年;(4)漢密爾頓抑郁量表-24項(HAMD-24)評分≥20分。對照組入組標準:(1)西安市精神衛生中心體檢健康志愿者;(2)年齡16~55歲;(3)既往無精神病史,均為北方漢族。兩組排除標準:(1)有腦器質性疾病或頭部外傷史或意識喪失超過1 h,明顯智力低下,有癲癇發作史;(2)患者有其他嚴重的或尚未控制的軀體疾病;(3)酒精和藥物濫用;(4)篩選前1個月內參加過其他藥物臨床研究;(5)有抗抑郁藥物的禁忌證;(6)篩選基線實驗室檢查結果異常(除肝腎功能外,實驗室檢查結果大于正常值1.5倍);(7)妊娠或哺乳期婦女;(8)有聽力問題(正常交談情況下不能聽清或理解檢查者的言語);(9)紅、綠、藍或黃色盲或色弱。研究組共入組66例,最終完成45例,其中男18例,女27例;年齡(36.29±11.49)歲;文化程度小學6例,初中11例,高中/中專8例,大學及以上20例。對照組共入組43名志愿者,其中男15名,女28名;年齡(33.09±9.27)歲;文化程度小學2名,初中13名,高中/中專12名,大學及以上16名。兩組在性別、年齡、受教育程度等一般資料方面比較差異無統計學意義(P>0.05)。研究組隨機分為度洛西汀組(22例)和艾司西酞普蘭組(23例)。其中度洛西汀組男8例,女14例;年齡(38.32±13.19)歲;病程(4.67±5.11)年;文化程度小學5例,初中4例,高中/中專3例,大學及以上10例。艾司西酞普蘭組男13例,女10例;年齡(34.35±9.49)歲;病程(2.75±4.03)年;文化程度小學1例,初中7例,高中/中專5例,大學及以上10例。兩組在性別、年齡、病程、受教育程度等一般資料方面比較差異無統計學意義(P>0.05)。入組被試均征得患者或法定監護人或直系親屬的知情同意,并簽署知情同意書。
1.2 方法
1.2.1 治療方法 研究組隨機分為度洛西汀組(全部使用度洛西汀治療,劑量60 mg/d)和艾司西酞普蘭組(全部使用艾司西酞普蘭治療,劑量20 mg/d),治療期間可輔助使用勞拉西泮(最大劑量2 mg/d)、阿普唑侖(最大劑量0.8 mg/d)改善睡眠及焦慮,使用周期不超過2周。
1.2.2 血清GFAP檢測 研究組于入組時和治療后第2、4周末,早晨6:00空腹采肘靜脈血5 ml置于非抗凝真空采血管中,離心后抽取血清于-20℃低溫保存,待所有標本采集完成后統一采用酶聯免疫吸附(ELISA)方法測定血清GFAP濃度。對照組采用相同方法,僅在入組時采血1次。
1.2.3 量表評定 采血后24 h內完成相關量表的評定,包括:HAMD-24以及漢密爾頓焦慮量表(HAMA)。HAMD-24:包括焦慮/軀體化、體重、認識障礙、日夜變化、阻滯、睡眠障礙、絕望感等7項因子;HAMA:包括軀體化焦慮、精神性焦慮。

2 結果
2.1 研究組與對照組血清GFAP濃度比較 入組時,研究組與對照組血清GFAP濃度分別為(1 962.95±2 303.07)ng/L和(930.38±265.14)ng/L,研究組高于對照組(U=493.00,Z=-3.961,P<0.01)。
2.2 研究組治療前后量表評分和血清GFAP濃度變化 治療后,研究組HAMD、HAMA評分以及血清GFAP濃度均呈下降趨勢(P<0.01)。進一步兩兩比較發現,治療后第2、4周末,HAMD、HAMA評分以及血清GFAP濃度均較入組時降低(P<0.01);且治療后第4周末,HAMD、HAMA評分以及血清GFAP濃度均較治療后第2周末降低(P<0.01)。見表1。

表1 研究組治療前后量表評分和血清GFAP濃度變化
2.3 不同抗抑郁藥物對HAMD、HAMA評分及血清GFAP濃度影響的比較 治療后第2、4周末,度洛西汀組和艾司西酞普蘭組HAMD、HAMA評分以及血清GFAP濃度均較入組時降低(P<0.01),且治療后第4周末,兩組HAMD、HAMA評分以及血清GFAP濃度均較治療后第2周末降低(P<0.01)。見表2。

表2 不同抗抑郁藥物對HAMD、HAMA評分及血清GFAP濃度影響的比較
2.4 研究組治療前后一般資料及HAMD、HAMA評分與血清GFAP濃度的關系 研究組在入組時,血清GFAP濃度與HAMD評分呈正相關(P<0.05)。其他各時點,其余各項與血清GFAP濃度均無相關性(P>0.05)。見表3。
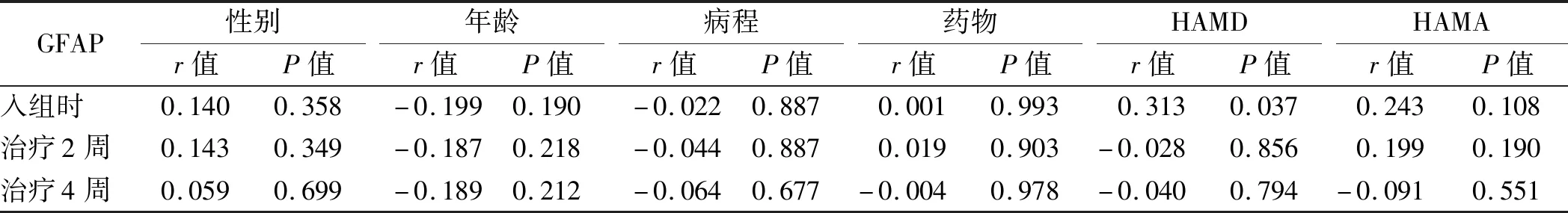
表3 研究組治療前后一般資料及HAMD、HAMA評分與血清GFAP濃度的關系
3 討論
研究組入組時血清GFAP濃度高于對照組(P<0.01),此結論和此前的研究結果一致。郭彥祥等[7]、李濤等[8]的研究均提示抑郁癥患者血清GFAP濃度高于健康對照組。動物實驗顯示,急性全身熱刺激(38℃,4 h)和跑輪運動(running-wheel)可以增加多個腦區的GFAP的免疫活性,海馬區反應性Ast的活化尤其明顯[9]。但是動物實驗的結果并不一致,比如慢性社會打擊(心理應激的一種)降低了雄性樹鼩相應腦區的GFAP免疫活性[10]。抑郁癥患者的尸檢結果也是相反的,在年輕抑郁癥患者的前額葉和前扣帶回,GFAP的免疫活性下降[11,12]。目前尚不能很好地解釋上述研究結果的差異,可能是試驗入組的對象不同所致,也和動物、人類實驗的不同有關,最有可能是外周血清GFAP濃度和相應腦區的GFAP的免疫活性并不能簡單類比,或者正因為中樞膠質細胞功能的障礙表現為GFAP的免疫活性下降,導致了外周血清GFAP濃度的升高。

本研究共使用了兩種抗抑郁藥物:度洛西汀和艾司西酞普蘭,將入組患者隨機分為度洛西汀組和艾司西酞普蘭組,試圖找到兩者對血清GFAP濃度的影響是否存在不同。度洛西汀和艾司西酞普蘭具有不同的藥理作用,度洛西汀對5-羥色胺(5-HT)和去甲腎上腺素(NA)再攝取具有很強的抑制作用,能使大腦和脊髓中的5-HT和NA濃度升高,可改善抑郁障礙患者的病情,并提高5-HT和NA兩種神經遞質在調控情感和對疼痛敏感程度方面的作用,提高機體對疼痛的耐受[16]。艾司西酞普蘭(S-西酞普蘭)是西酞普蘭的對映異構體,是對5-HT轉運體(SERT)選擇性最強的抗抑郁藥[17]。兩組患者入組時HAMD、HAMA評分差異沒有統計學意義,經過治療后兩組HAMD、HAMA評分均較入組時改善,但兩組之間比較差異不存在統計學意義(P>0.05),且兩組治療后血清GFAP濃度的對比差異也不具有統計學意義(P>0.05),說明兩類藥物對膠質細胞和血清GFAP濃度具有相同或類似影響,他們對抑郁癥狀的影響除了前面所述的途徑還存在通過影響膠質細胞來改善癥狀的可能。本研究進一步提高了膠質細胞在抑郁癥發病及治療方面的價值。
研究組在治療前,血清GFAP濃度與HAMD評分呈正相關(P<0.05),治療后,血清GFAP濃度與HAMD、HAMA評分之間沒有相關性(P>0.05),說明患者抑郁障礙的嚴重程度難以通過血清GFAP濃度來準確預測分析。研究組性別、年齡、病程、使用抗抑郁藥物與血清GFAP濃度均不存在相關性(P>0.05)。郭彥祥等[7]之前的研究提示,抑郁癥患者血清GFAP濃度與HAMD、HAMA總分及HAMD各因子分之間均無相關性(P>0.05),血清GFAP濃度與病程之間無相關性(P>0.05),與本次研究結果是一致的。
本研究進一步闡明了抑郁癥和血清GFAP濃度的關系,初步揭示了抗抑郁藥物治療后血清GFAP濃度的變化,為豐富抑郁癥發病機制的研究更新了材料。同時,由于樣本量較小,入組患者可能缺乏代表性,和既往的動物、尸檢研究結果還有不一致的地方,其解釋還需要進一步的研究驗證。

