Th9細胞對非小細胞肺癌患者CD8+T細胞抗腫瘤活性的調控作用
蘇艷麗,李 波
(湖北省棗陽市第一人民醫院呼吸與危重癥醫學科,湖北 棗陽 441200)
非小細胞肺癌(Non-small-cell lung cancer,NSCLC)占肺癌的80%,其1年生存率僅10%左右[1]。針對表皮生長因子受體的靶向藥物和針對免疫檢查點的抑制劑為NSCLC的治療提供了新的手段[2]。通過外源性刺激源刺激免疫細胞,可逆轉其衰竭的功能狀態,誘導機體產生有效的抗腫瘤免疫應答,可達到抑制NSCLC生長、減少復發和轉移的目的[3]。Th9細胞是一類新鑒定的CD4+T細胞亞群,表型為CD4+CCR4-CCR6-CXCR3-,主要在轉錄因子PU.1的調控下分泌白細胞介素-9(Interleukin-9,IL-9),可通過調控CD8+T細胞活性發揮抗腫瘤作用[4- 5]。但有關Th9細胞對肺癌患者CD8+T細胞調控作用的研究較少。本研究檢測NSCLC患者外周血及支氣管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)中Th9細胞比例和IL-9水平,利用體外細胞培養系統觀察Th9細胞對NSCLC患者CD8+T細胞抗腫瘤活性的影響。
1 資料與方法
1.1 一般資料 選擇2019年2-9月棗陽市第一人民醫院診斷為NSCLC的患者32例,其中男19例,女13例,年齡27~64歲,平均(48.7±13.1)歲。所有患者均進行了手術或肺活檢,經病理學檢查確診為NSCLC;其中鱗癌17例,腺癌15例。根據影像學結果,中央型肺癌16例(鱗癌9例,腺癌7例),周圍型肺癌16例(鱗癌8例,腺癌8例)。32例患者中,21例(鱗癌10例,腺癌11例)接受手術治療。排除標準:①合并活動性肝炎病毒或人類免疫缺陷病毒感染的患者;②合并嚴重肺部感染或敗血癥的患者;③合并心臟、腎臟、中樞神經系統等重要臟器功能不全的患者;④自身免疫性疾病或長期接收免疫調節劑治療的患者。患者在接受手術前均未進行放療、化療或免疫治療。同時,選擇2018年3-6月于棗陽市第一人民醫院進行健康體檢的、年齡和性別相匹配的健康對照者為對照組,其中男6例,女5例,年齡25~65歲,平均(47.2±11.8)歲。本研究通過棗陽市第一人民醫院倫理委員會批準(批準文號:市一倫20180819),入組者或家屬均簽署知情同意書。
1.2 研究方法
1.2.1 主要試劑和儀器:Ficoll淋巴細胞分離液(美國Sigma公司);CD4+T細胞分選試劑盒、CD8+T細胞分選試劑盒(德國美天旎公司);抗CCR4-PE、抗CCR6-PE、抗CXCR3-PE、抗CD3-PerCP、抗CD4-PE、抗IL-9-APC(美國BD公司);重組人IL-9、抗IL-9中和抗體(美國Peprotech公司);IL-9、干擾素-γ、腫瘤壞死因子-α(Tumor necrosis factor-α,TNF-α)酶聯免疫吸附實驗(Enzyme linked immunosorbent assay,ELISA)試劑盒(美國R&D公司);Trizol試劑(美國Invitrogen公司);PrimeScript反轉錄試劑盒、TB Green實時定量PCR試劑盒(北京寶日生物技術有限公司);CCK-8試劑盒、乳酸脫氫酶(Lactate dehydrogenase,LDH)細胞毒性檢測試劑盒(武漢碧云天公司);穿孔素、顆粒酶B酶聯斑點吸附實驗(Enzyme linked immunospot assay,ELISPOT)試劑盒(美國Abcam公司)。MCAS磁力分離架(德國美天旎公司);FACS Aria Ⅱ流式細胞儀(美國BD公司);微孔讀板儀(美國BioRad公司);ABI 7500實時定量PCR儀(美國Applied Biosystem公司);ELISPOT讀板儀(德國艾迪公司)。
1.2.2 血漿和外周血單個核細胞(Peripheral blood mononuclear cells,PBMCs)分離:于晨起空腹留取入組者抗凝外周血20 ml,于1000 g離心10 min收集上層血漿,-70 ℃冰箱凍存備用。下層血細胞使用Ficoll淋巴細胞分離液、采用密度梯度離心法分離PBMCs,調整細胞濃度至107個/ml,加入含10 % DMSO的胎牛血清(Fetal bovine serum,FBS),液氮凍存備用。
1.2.3 BALF制備:經活檢孔通過硅膠管向灌洗肺段注入利多卡因進行局部麻醉,將纖維支氣管鏡頂端緊密楔入腫瘤部位亞段支氣管開口處,經硅膠管快速注入37 ℃無菌生理鹽水,共灌洗4次,每次50 ml。用100 mmHg(1 mmHg=0.133 kPa)負壓吸引回收灌洗液,保證回收效率 >50%。用雙層無菌紗布過濾灌洗液,記錄總量,導入無菌離心管中,于4 ℃、1000 g離心10 min,收集上清,-70 ℃冰箱凍存備用。經離心沉淀的細胞成分使用Hank’s液洗滌2次,加入完全培養液(RPMI 1640培養液+10% FBS),調整細胞濃度至106個/ml。對于可耐受灌洗的肺癌組患者,對未發生腫瘤的肺部也進行灌洗,作為對照進行檢測。
1.2.4 原代NSCLC細胞的分離和培養:對于接受手術的17例肺癌組患者,取新鮮的NSCLC組織,加入適量Hank’s液,去除組織中的血液、結締組織和脂肪組織,保留腫瘤細胞豐富的區域,用Hank’s液洗滌2次后加入少量RPMI 1640培養液,將組織剪成約1 mm3大小的碎塊。將組織碎塊轉入離心管中,用Hank’s液洗滌數次,組織碎塊自動下沉后移除Hank’s液。將組織碎塊轉入培養瓶中,加入5 ml膠原酶,吹散,置37 ℃恒溫搖床、于150 次/min的速度下進行消化,每隔30 min于顯微鏡下觀察1次。待組織碎塊呈絮狀、且透光性良好后,轉入離心管中,于1000 g離心10 min后棄上清,加入Hank’s液洗滌數次,反復吹打后于1000 g離心10 min后棄上清,轉入培養板中,加入完全培養液,于37 ℃、5 % CO2條件下培養。
1.2.5 CD8+T細胞的純化:使用CD8+T細胞分選試劑盒對PBMCs和BALF中的CD8+細胞進行分選。取107個細胞于4 ℃、300 g離心10 min,加入40 μl緩沖液重懸細胞,再加入10 μl生物素標記的抗體雞尾酒,4 ℃孵育5 min,加入30 μl緩沖液和20 μl CD8+T細胞磁珠雞尾酒,4 ℃孵育10 min。用3 ml緩沖液浸潤置于MACS分離架上的分離柱,加入標記的細胞懸液,收集通過分離柱的細胞,即為CD8+T細胞。
1.2.6 Th9細胞(即CD4+CCR4-CCR6-CXCR3-細胞)的純化:首先使用CD4+T細胞分選試劑盒對PBMCs和BALF中的CD4+細胞進行分選。取107個細胞于4 ℃、300 g離心10 min,加入40 μl緩沖液重懸細胞,再加入10 μl生物素標記的抗體雞尾酒,4 ℃孵育5 min,加入30 μl緩沖液和20 μl CD4+T細胞磁珠雞尾酒,4 ℃孵育10 min。用3 ml緩沖液浸潤置于MACS分離架上的分離柱,加入標記的細胞懸液,收集通過分離柱的細胞,即為CD4+T細胞。隨后將純化的CD4+T細胞使用抗CCR4-PE、抗CCR6-PE和抗CXCR3-PE進行染色,室溫避光孵育30 min后使用PBS洗滌2次,使用FACS Aria Ⅱ流式細胞儀對細胞進行陰性分選,收集CCR4-CCR6-CXCR3-細胞,即為CD4+CCR4-CCR6-CXCR3-Th9細胞。
1.2.7 細胞培養:①取32例肺癌組患者PBMCs中分離的105個CD8+T細胞,接種于96孔板中,設立3個復孔,其中3個復孔加入200 μl 完全培養液,另外3個復孔加入含有重組人IL-9(5 μg/L)的完全培養液刺激培養,12 h后收集細胞進行后續檢測。②建立CD8+T細胞與原代NSCLC細胞直接接觸培養和間接接觸培養系統[6]。對21例接受手術治療的NSCLC患者收集其PBMCs和BALF中純化的CD8+T細胞,加入重組人IL-9(5 μg/L)刺激培養12 h,洗滌細胞2次,去除IL-9,再將105個CD8+T細胞與5×105個自體分離的原代NSCLC細胞共培養。在直接接觸培養系統中,CD8+T細胞與原代NSCLC細胞直接混合,并加入抗CD3/CD28抗體(1 μg/L)刺激培養。在間接接觸培養系統中,CD8+T細胞與原代NSCLC細胞分別接種于Transwell培養平板的上層小室和下層培養孔中,上層小室底部為孔徑直徑為0.4 μm的濾膜,僅可溶性細胞因子可以通過,細胞不能通過濾膜,向上層小室中加入抗CD3/CD28抗體。培養48 h后收集上清,進行后續檢測。③為評估Th9細胞對CD8+T細胞的調控作用,對21例接受手術治療的NSCLC患者,將外周血純化的Th9細胞及CD8+T細胞與原代NSCLC細胞,建立以下培養體系:①5×104個Th9細胞與5×105個自體分離的原代NSCLC細胞直接接觸共培養;②105個CD8+T細胞與5×105個自體分離的原代NSCLC細胞直接接觸共培養;③5×104個Th9細胞、105個CD8+T細胞與5×105個自體分離的原代NSCLC細胞共培養;④5×104個Th9細胞、105個CD8+T細胞與5×105個自體分離的原代NSCLC細胞共培養,同時加入抗IL-9中和抗體(5 μg/ml)。培養液中加入抗CD3/CD28抗體(1 μg/L)刺激培養。培養48 h后收集上清,進行后續檢測。
1.2.8 流式細胞術檢測Th9細胞:取106個PBMCs或BALF中分離的細胞,加入佛波酯(50 ng/ml)和伊烏諾霉素(1 μg/ml)刺激培養,同時加入莫能霉素(10 μg/ml)抑制蛋白轉運。培養6 h后,PBS洗滌2次,加入抗CD3-PerCP和抗CD4-PE進行表面染色,室溫避光孵育30 min。PBS洗滌2次,然后加入破膜固定液,4 ℃避光孵育15 min,PBS洗滌2次,加入抗IL-9-APC進行胞內染色,4 ℃避光孵育30 min,PBS洗滌2次。加入多聚甲醛固定,使用FACS Aria Ⅱ流式細胞儀獲取細胞,FlowJo V10軟件分析結果。
1.2.9 ELISA檢測細胞因子水平:使用商品化ELISA試劑盒對血漿、BALF及培養上清中的IL-9、干擾素-γ和TNF-α水平進行檢測。
1.2.10 實時定量PCR法檢測PU.1 mRNA相對表達量:取105個PBMCs或BALF中分離的細胞,使用Trizol試劑提取總RNA。反轉錄反應體系:5×緩沖液 2 μl、反轉錄酶混合物Ⅰ 0.5 μl、寡聚胸腺嘧啶引物 0.5 μl、隨機六核苷酸引物 0.5 μl、總RNA 1 μg,加入不含RNA酶的去離子水調整總體積至10 μl。反轉錄反應條件:37 ℃ 15 min,85 ℃ 5 s。TB Green實時定量PCR反應體系:TB Green預混Taq酶 10 μl、上游引物(10 μmol/L) 0.4 μl、下游引物(10 μmol/L) 0.4 μl、ROX參考染料 0.4 μl、cDNA 2 μl、滅菌水 6.8 μl。PCR反應條件:預變性:95 ℃ 30 s;PCR反應:95 ℃ 5 s,60 ℃ 30 s,共40個循環。應用2-ΔΔCT法對目的片段的相對表達量進行分析。引物序列:①PU.1上游:5’ GAT CCG CCT GTA CCA GTT CC 3’,下游:5’ CTC CTT GTG CTT GGA CGA GA 3’;②β-肌動蛋白上游:5’ TGG CAGC CAG CAC AAT GAA 3,下游:5’ CTA AGT CAT AGT CCG CCT AGA AGC A 3’。
1.2.11 細胞增殖試驗:使用CCK-8試劑盒按說明書操作。在培養的最后4 h,向培養孔內加入20 μl CCK-8反應液,檢測細胞培養液在450 nm處的吸光度,設立標準曲線,計算培養細胞的數量。
1.2.12 ELISPOT檢測穿孔素和顆粒酶B的水平:使用預包被的穿孔素或顆粒酶B ELISPOT試劑盒檢測CD8+T細胞分泌穿孔素及顆粒酶B的水平。向PVDF預包被的平板中每孔加入100 μl PBS,室溫孵育10 min,吸干平板中的液體。向平板中每孔加入105個無IL-9刺激或經IL-9刺激的CD8+T細胞,加入佛波酯(50 ng/ml)和伊烏諾霉素(1 μg/ml),同時設立無刺激的陰性對照孔,總體積為100 μl,于37 ℃、5% CO2條件下培養16 h,吸干平板中的液體,加入100 μl PBS-T,4 ℃孵育10 min,使用PBS-T洗板3次。向平板中每孔加入100 μl 1∶100稀釋的檢測抗體,室溫孵育90 min,使用PBS-T洗板3次。向平板中每孔加入100 μl 1∶5000稀釋的鏈霉親和素堿性磷酸酶,室溫孵育60 min,使用PBS-T洗板3次,使用流動水沖洗PVDF膜的兩面,吸干液體后加入100 μl BCIP/NBT堿性磷酸酶底物顯色液,室溫孵育15 min。流動水沖洗,吸干液體后使用ELISPOT讀板儀對斑點形成細胞(Spot forming cells,SFC)進行計數。
1.2.13 靶細胞死亡比例檢測:通過檢測培養上清中LDH計算原代NSCLC細胞的死亡比例。使用LDH細胞毒性檢測試劑盒檢測培養上清中LDH水平,以原代NSCLC細胞培養上清中的LDH水平作為“低水平LDH對照”,以Triton X-100處理的原代NSCLC細胞培養上清中的LDH水平作為“高水平LDH對照”,按以下公式計算靶細胞死亡比例:(樣本LDH水平-低水平LDH對照)/(高水平LDH對照-低水平LDH對照)×100%。

2 結 果
2.1 肺癌組和對照組外周血及BALF中Th9細胞比例、IL-9水平及PU.1相對表達量比較 肺癌組及對照組外周血CD3+CD4+IL-9的Th9細胞典型流式散點圖見圖1。肺癌組外周血Th9占CD4+T細胞的比例顯著低于對照組,但外周血Th9細胞比例在肺鱗癌和肺腺癌中的差異無統計學意義。腫瘤部位收集的BALF中Th9細胞比例顯著低于非腫瘤部位,但腫瘤部位收集的BALF中Th9細胞比例在肺鱗癌和肺腺癌中的差異無統計學意義。肺癌組外周血IL-9水平顯著低于對照組,但外周血IL-9水平在肺鱗癌和肺腺癌中的差異無統計學意義。腫瘤部位收集的BALF中IL-9水平顯著低于非腫瘤部位,但腫瘤部位收集的BALF中IL-9水平在肺鱗癌和肺腺癌中的差異無統計學意義。肺癌組PBMCs中PU.1 mRNA相對表達量顯著低于對照組,但PBMCs中PU.1 mRNA相對表達量在肺鱗癌和肺腺癌中的差異無統計學意義。腫瘤部位收集BALF分離的細胞中PU.1 mRNA相對表達量顯著低于非腫瘤部位,但腫瘤部位BALF分離的細胞中PU.1 mRNA相對表達量在肺鱗癌和肺腺癌中的差異無統計學意義。見表1。
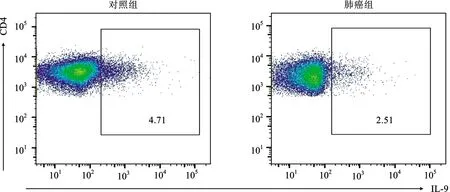
圖1 對照組和肺癌組外周血Th9細胞典型流式分析散點圖
2.2 IL-9刺激對肺癌組患者外周血CD8+T細胞增殖及分泌穿孔素、顆粒酶B的影響 經IL-9刺激的CD8+T細胞增殖顯著高于無IL-9刺激的CD8+T細胞,經IL-9刺激的CD8+T細胞分泌穿孔素和顆粒酶B的水平顯著高于無IL-9刺激的CD8+T細胞。見表2。
2.3 IL-9刺激對肺癌組患者外周血和BALF中CD8+T細胞功能的影響 經IL-9刺激后,無論外周血分離的CD8+T細胞還是BALF中分離的CD8+T細胞,其細胞殺傷功能均顯著高于無IL-9刺激的CD8+T細胞,表現為在直接接觸和間接接觸培養系統中,CD8+T細胞誘導原代NSCLC細胞死亡比率在經IL-9刺激的CD8+T細胞中均顯著高于無IL-9刺激的CD8+T細胞。無論外周血分離的CD8+T細胞還是BALF中分離的CD8+T細胞,在直接接觸和間接接觸培養系統中,經IL-9刺激后分泌干擾素-γ和TNF-α的水平均顯著高于無IL-9刺激的CD8+T細胞。見表3。
2.4 Th9細胞對肺癌組患者外周血CD8+T細胞功能的影響 Th9細胞誘導原代NSCLC細胞死亡比率極小,培養上清中檢測不到干擾素-γ和TNF-α。Th9細胞可增強肺癌組患者外周血CD8+T細胞的殺傷功能,表現為原代NSCLC細胞死亡比率升高,培養上清中干擾素-γ和TNF-α水平亦升高。而加入抗IL-9中和抗體則可抑制Th9細胞對CD8+T細胞殺傷功能的增強作用,表現為原代NSCLC細胞死亡比率降低,培養上清中干擾素-γ和TNF-α水平亦降低,見表4。
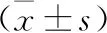
表1 對照組和肺癌組外周血BALF中Th9細胞比例、IL-9水平和PU.1相對表達量比較

表2 IL-9刺激對肺癌組患者外周血CD8+T細胞增殖及分泌穿孔素、顆粒酶B 的影響
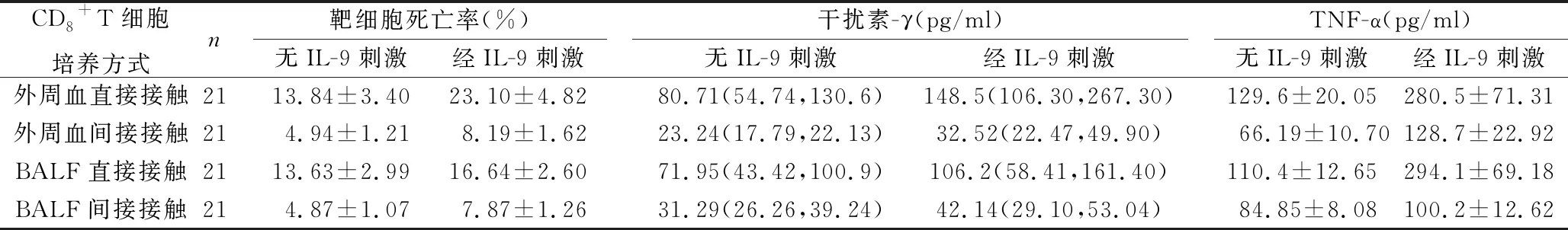
表3 IL-9刺激對肺癌組患者外周血和BALF中CD8+T細胞功能的影響
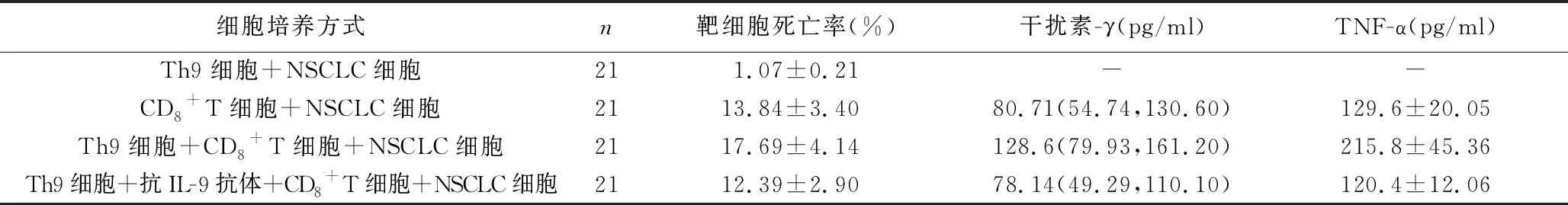
表4 Th9細胞對肺癌組患者外周血CD8+T細胞功能的影響
3 討 論
Th9細胞在多種實體腫瘤的發生發展中均發揮重要的免疫調控作用[6]。研究發現,腫瘤微環境中的Th9細胞可誘導肺癌細胞上皮間質細胞轉化,進而促進肺癌細胞的遷移和轉移性擴散[7],Th9細胞分泌的IL-9也可通過誘導血管生成促進NSCLC腫瘤形成[8]。相反,miR-208b-5p可通過IL-9介導的STAT3信號通路抑制NSCLC細胞的侵襲和遷移[9]。IL-9還可直接通過刺激抗腫瘤M1型巨噬細胞的活化抑制黑色素瘤肺轉移[10]。在黑色素瘤肺轉移小鼠模型中,抑制IL-9可促進腫瘤生長,腫瘤特異性Th9細胞可通過促進樹突狀細胞向腫瘤組織的募集增強CD8+T細胞抗腫瘤活性[11]。因此,Th9細胞及其分泌的IL-9在肺癌的發生發展中存在雙重功能,可能與不同腫瘤組織類型及不同疾病的免疫狀態有關[12]。本研究結果發現Th9細胞、IL-9和PU.1在NSCLC患者外周血和腫瘤局部的水平降低,這與既往在結腸癌組織中的發現的IL-9水平降低結果一致,但卻與宮頸癌患者腫瘤浸潤組織中所發現的IL-9 PU.1+T細胞水平升高的結果不盡相同[13],這是可能是由于不同的腫瘤細胞系對Th9細胞和IL-9刺激的應答存在差異造成的[14],NSCLC患者中Th9細胞和IL-9水平降低可能與機體免疫應答抑制有關。進一步的研究發現,NSCLC患者分離的Th9細胞與自體原代NSCLC細胞共培養后,誘導細胞死亡的水平很低,提示NSCLC患者的Th9細胞的直接殺傷功能極低。這可能與兩個方面的因素有關:一方面,CD4+T細胞的直接細胞殺傷功能較弱,特別是CD4+CCR4-CCR6-CXCR3-Th9細胞主要分泌IL-9和IL-21[15],不能發揮有效的細胞毒性作用。另一方面,NSCLC患者自身存在免疫功能不全甚至衰竭[16],Th9細胞分泌的IL-9不但存在數量減低,還可能出現功能障礙,從而不能有效發揮免疫調控作用。
Th9細胞通過分泌IL-9顯著增強黑色素瘤小鼠模型的免疫應答,抑制腫瘤生長[17]。IL-9還可直接調控T細胞和漿細胞的增殖和功能,通過多種途徑發揮免疫增強作用[18]。相反,IL-9還可通過抑制轉化生長因子和粒細胞-巨噬細胞集落刺激因子的分泌抑制單核細胞的功能,使機體免受過強的免疫應答的影響[19-20]。因此,Th9細胞和IL-9在腫瘤免疫調控中亦存在雙重功能。CD8+T細胞是重要的抗腫瘤免疫細胞,而CD8+T細胞在腫瘤患者中存在功能不全甚至功能衰竭,無法有效清除腫瘤細胞,造成腫瘤增殖和轉移。肺癌患者中亦存在CD8+T細胞功能衰竭[21],采用多種方式(如:免疫佐劑、直接刺激、基因編輯等)恢復CD8+T細胞功能已成為肺癌治療的研究熱點之一。在結腸癌中,Th9細胞可通過抑制CD8+T細胞中的PD-1/PD-L1信號通路促進CD8+T細胞克隆性增殖[5]。在乳腺癌中,Th9細胞可通過分泌IL-9和IL-21促進CD8+T細胞抗腫瘤活性[15]。但尚未見到有關Th9細胞及其分泌的IL-9對NSCLC患者CD8+T細胞功能調控作用的相關報告。本研究發現,雖然Th9細胞的毒性作用較弱,但Th9細胞可顯著增強NSCLC患者CD8+T細胞誘導的靶細胞死亡,抗IL-9中和抗體可抑制Th9細胞對CD8+T細胞功能的增強效應,提示Th9細胞主要通過分泌IL-9發揮調控NSCLC患者CD8+T細胞的抗腫瘤活性,這與在乳腺癌中的研究結果一致[15]。進一步對IL-9調控CD8+T細胞功能的機制進行研究。第一,IL-9可促進NSCLC患者CD8+T細胞的增殖,提示IL-9可通過促進細胞生長增加CD8+T細胞的數量。第二,利用直接接觸和間接接觸培養系統,觀察CD8+T細胞的直接殺傷和非直接殺傷的功能在抗NSCLC中的作用。直接接觸培養系統中,CD8+T細胞可通過依賴細胞間接觸的直接殺傷和分泌細胞因子介導的非直接殺傷之雙重功能發揮誘導靶細胞死亡的作用,在間接接觸培養系統中,CD8+T細胞僅通過細胞因子介導的非直接殺傷功能誘導靶細胞死亡[22]。IL-9刺激后,無論在直接接觸還是間接接觸培養中,NSCLC患者外周血和BALF中CD8+T細胞誘導靶細胞死亡的比例均增加,同時伴有干擾素-γ和TNF-α分泌水平增加,提示IL-9可直接促進NSCLC患者的CD8+T細胞通過分泌細胞因子介導的非直接殺傷活性。第三,IL-9可直接促進CD8+T細胞分泌穿孔素和顆粒酶B,穿孔素和顆粒酶B均為CD8+T細胞發揮直接殺傷功能活性的重要介質分子[23],提示IL-9還可增強NSCLC患者CD8+T細胞的直接殺傷功能。因此,Th9細胞分泌的IL-9可能通過多種機制發揮促進NSCLC患者CD8+T細胞活性的作用。但本研究僅進行了體外試驗,且入組樣本數量相對較少,還需進行動物試驗并擴大樣本量對結論進一步驗證。
總之,NSCLC患者中低表達的Th9細胞可能與NSCLC患者CD8+T細胞抗腫瘤活性降低有關,Th9細胞可能主要通過分泌IL-9增強NSCLC患者CD8+T細胞的抗腫瘤效應。

