教學(xué)不止于課堂
——從一個顯色實驗的準(zhǔn)備探討理論到實踐過程
趙子豪, 楊天嘉, 鄭 浩, 張 利, 馬 荔
(上海交通大學(xué)化學(xué)化工學(xué)院,上海200240)
0 引 言
為慶祝我校學(xué)化工學(xué)院建院90 周年,計劃設(shè)計一個變色實驗。在舞臺上,將1 瓶無色的液體加入量杯中,可以變?yōu)榧t、黃、綠、藍(lán)、紫5 種顏色的溶液。這5種顏色分別代表著責(zé)任與激情,理想與夢想,環(huán)保、和平與安全,寬廣的胸懷以及好奇心。一方面是學(xué)院對學(xué)生期望,另一方面也是響應(yīng)習(xí)總書記把思想政治教育貫穿教育全過程的指示[1-3],發(fā)揮好課堂教學(xué)主渠道作用,積極探索“課程思政”在基礎(chǔ)科學(xué)課堂中的形式。
作為一名化學(xué)專業(yè)的學(xué)生,自然想到的就是使用酸堿指示劑和酸堿溶液之間的變色反應(yīng)實現(xiàn)這一設(shè)想。同一種指示劑在不同的pH值條件下呈現(xiàn)出不同的顏色,但是由于指示劑的變色范圍一般較窄,因此通過控制恰當(dāng)?shù)膒H 值來控制顏色相對較難,且能夠出現(xiàn)的顏色有限[4]。因此設(shè)計了另一種方法:將幾種不同的指示劑混合,在不同的比例下,可以使同樣pH的溶液呈現(xiàn)出不同的顏色,而呈現(xiàn)出的顏色僅與指示劑的配比、用量有關(guān)[4]。
酸堿指示劑一般是有機弱酸或弱堿,當(dāng)溶液中的pH值改變時,指示劑由于結(jié)構(gòu)的改變而發(fā)生顏色的改變[5-6]。酸堿指示劑分子在不同酸堿性的溶液中因電離程度不同而產(chǎn)生顏色變化,其根本原因是分子結(jié)構(gòu)發(fā)生了改變,如圖1 所示[5-7]。如果在具有某pH值的溶液中加入兩種或兩種以上的酸堿指示劑,溶液中指示劑分子的結(jié)構(gòu)變化是互不干擾、分別進(jìn)行的,因此宏觀上就會顯現(xiàn)出兩種酸堿指示劑在此pH下所顯顏色的混合色[8]。如果對pH 值、酸堿指示劑配比等變量進(jìn)行控制,那么理論上可以根據(jù)美術(shù)中的調(diào)色原理得到各種顏色的溶液。
由于在堿性條件下,酚酞指示劑可使溶液顯粉紅~紫紅色(pH >9.1),對硝基苯酚指示劑可使溶液顯黃色(pH >7.4),百里酚藍(lán)指示劑可使溶液顯藍(lán)色(pH >8.9),與美術(shù)三原色(紅、黃、藍(lán))相近。因而以酚酞、對硝基苯酚和百里酚藍(lán)3 種指示劑為基礎(chǔ),按一定比例混合即可調(diào)配得到堿性條件下顯各種顏色的混合指示劑。
因此選定了NaOH溶液、酚酞試劑、對硝基苯酚試劑以及百里酚藍(lán)試劑,進(jìn)行實驗。
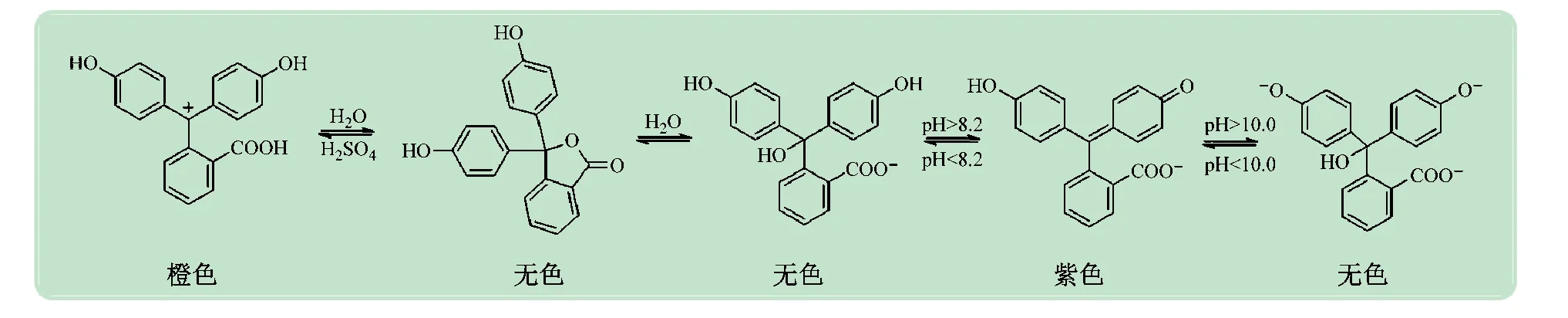
圖1 酚酞顯色與其分子結(jié)構(gòu)變化的關(guān)系[5-7]
1 實驗室常規(guī)實驗確定酸堿指示劑配比和NaOH溶液的濃度
盡管確定了所需試劑及指示劑,但是隨即發(fā)現(xiàn),所得溶液的顏色不僅受pH 值和酸堿指示劑的影響,在不同的容器中,肉眼所見同一種溶液的顏色也不完全相同。這是由溶液本身的透明性和形狀的可塑性造成的。對于透明物質(zhì),在外界光源照射下,有一部分波長的光被物質(zhì)吸收,另一部分波長不被吸收的光而得以透射,這部分透射光的顏色即為透明物質(zhì)的顏色,因此在不同的外界光源下,物質(zhì)的顏色也會發(fā)生變化。這些外界環(huán)境因素給顏色的調(diào)配帶來了新的困難。
實驗原本僅設(shè)計為通過調(diào)控酸堿指示劑的比例和加入量而得到不同顏色(紅、黃、綠、藍(lán)、紫)的堿性溶液,用于趣味實驗的展示活動。但是在準(zhǔn)備過程中發(fā)現(xiàn),不僅酸堿指示劑的比例和加入量對溶液的顏色有著顯著影響,外界的光源和盛裝液體的容器等外界環(huán)境條件也對溶液的顏色產(chǎn)生了干擾。因而依據(jù)實驗展示處的環(huán)境對溶液顏色進(jìn)行了進(jìn)一步校正:對于容器形狀的影響,選擇通過微調(diào)酸堿指示劑的加入量進(jìn)行校正;而對于外界光源的影響,選擇通過控制溶液的pH值(堿濃度)進(jìn)行校正。校正完畢之后,得到了理想的展示效果。
從一個簡單的指示劑顯色實驗設(shè)計,到發(fā)現(xiàn)意料之外的問題,再到根據(jù)實際情況提出猜想解決問題,并最終總結(jié)解決通用思路,體現(xiàn)了完整的實驗創(chuàng)新思維。
實驗計劃配制紅、黃、綠、藍(lán)、紫5 種顏色的溶液(理論上配制其他顏色的溶液亦可),其中黃色溶液可以直接通過加入對硝基苯酚指示劑、藍(lán)色溶液可以直接通過加入百里酚藍(lán)指示劑配制得到,無需進(jìn)行不同指示劑的配比實驗,但是仍然需要確定對應(yīng)指示劑的加入量。此處需要注意的是,紅色溶液不可以通過直接加入酚酞指示劑得到,因為酚酞指示劑在堿性下呈現(xiàn)紫紅色,并非所要求的正紅色。
2 實驗室中確定酸堿指示劑配比和用量
預(yù)實驗一般可認(rèn)為是小試實驗,重點是用少量的試劑確定實驗條件,選擇先在20 mL量杯中進(jìn)行調(diào)色實驗。為了讓實驗?zāi)軌蚝苊烙^展示給所有的觀眾,計劃選用500 mL量杯進(jìn)行顯色實驗。
根據(jù)調(diào)色原理,初步確定了配制5 種顏色溶液所需的酸堿指示劑種類。并通過實驗確定了對應(yīng)不同顏色指示劑的配比。根據(jù)在20 mL量杯中的用量成比例計算得到在500 mL量杯中的用量(見表1)。
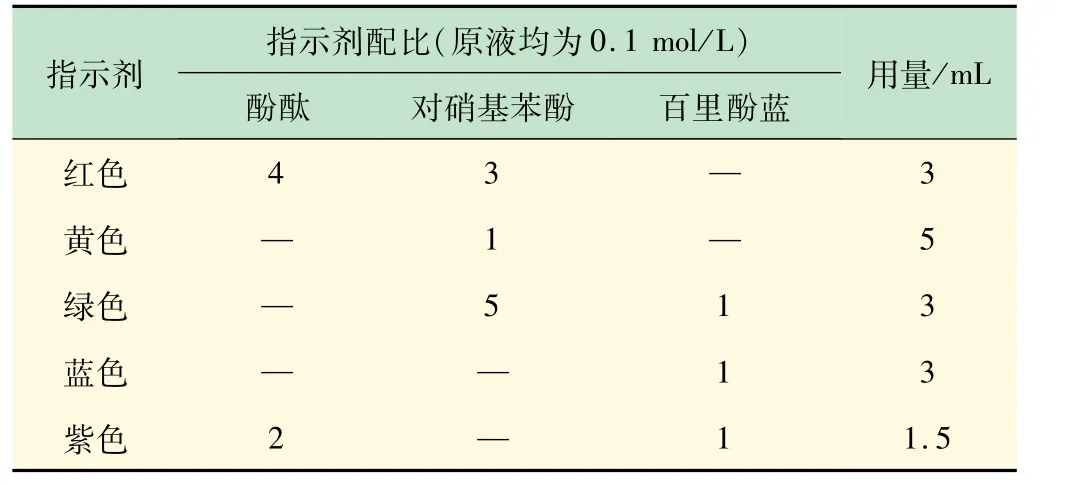
表1 不同顏色溶液所需指示劑的對應(yīng)配比
按照表1 所示的配比,即可配制所需要的5 種顏色對應(yīng)的指示劑。根據(jù)用量取指示劑,并加入定量的NaOH溶液即可得到所需的5 色溶液,如圖2 所示。

圖2 以20 mL量杯為容器的5色溶液
3 容器對溶液顏色的影響
如前所述,在20 mL量杯中進(jìn)行預(yù)實驗得到理想的顏色,確定了酸堿指示劑的配比,并計算確定了在500 mL量杯中所需各指示劑的體積,對應(yīng)的酸堿指示劑濃度和pH 值相同,所以溶液的顏色也應(yīng)當(dāng)與預(yù)實驗相同。但是使用500 mL 量杯進(jìn)行實驗時卻發(fā)現(xiàn)并非如此,對應(yīng)的溶液顏色與20 mL量杯中溶液相比較淺(見圖3)。

圖3 以500 mL量杯為容器的5色溶液
這是由于溶液是澄清透明的,且形狀具有可塑性,因此在不同容器中光的透過性不同,相同容器的不同部位光的透過性也不同,造成視覺上溶液的深淺程度不同。
根據(jù)物質(zhì)的吸收定律[9-10]:
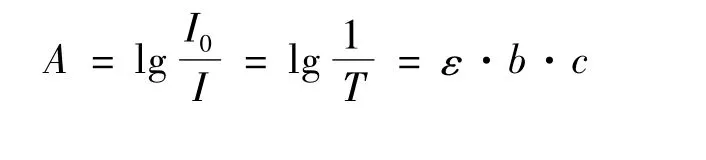
式中:I0/I 為透過率;b 為溶液的厚度;c 為溶液的濃度。
可見,人眼觀察的溶液顏色與光透過的情況有關(guān)系的,而光透過的情況與溶液的厚度有密切關(guān)系,因此容器的大小和形狀對光的透過情況有極大的影響。這也可以解釋觀察到的現(xiàn)象。但是經(jīng)觀察發(fā)現(xiàn),后一種因素導(dǎo)致的溶液深淺差異較小,可以忽略不計。分析原因是500 mL量杯體積遠(yuǎn)大于20 mL量杯,進(jìn)入前者的光量大,也就是能夠進(jìn)入其中的光子數(shù)多,使得溶液得以被“照亮”,相比于20 mL量杯,溶液的顏色較淺。
容器的影響對紅色、黃色、綠色溶液較為顯著,而對于顏色較深的藍(lán)色和紫色溶液,雖然顏色變淺,但由于溶液本身顏色較深,因而影響不大。于是,又使用500 mL量杯進(jìn)行實驗,對酸堿指示劑的配比和用量進(jìn)行了校正,數(shù)據(jù)見表2。
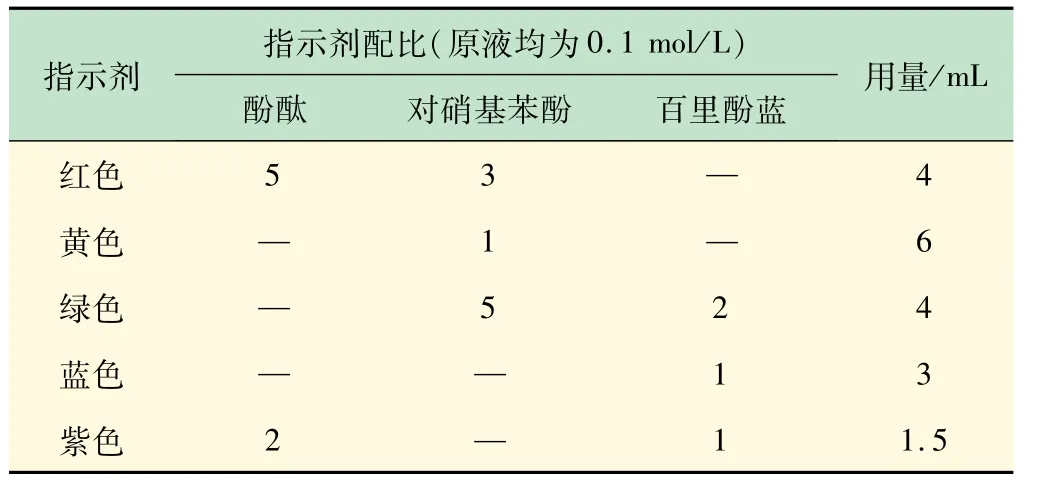
表2 不同顏色溶液所需指示劑的對應(yīng)配比校正
4 光源對溶液顏色的影響
預(yù)實驗所采用的光源為自然光(白光),但是實驗展示場地的照明燈光為色彩偏黃的筒燈,且光強非常大,這又使得溶液的顏色出現(xiàn)了偏差。紅色溶液的顏色偏向堿性環(huán)境下酚酞的粉紅色;綠色溶液則偏藍(lán),呈現(xiàn)藍(lán)綠色,導(dǎo)致和藍(lán)色溶液之間沒有顯著的色彩差異;而黃色溶液的色彩則幾乎無法被明顯地觀察到,近乎無色。藍(lán)色溶液和紫色溶液雖然顏色與自然光下有少許不同,但是并未出現(xiàn)較大的色彩偏差。
如前所述,對透明物質(zhì)來說,在外界光源照射下,有一部分波長的光被物質(zhì)吸收,而另一部分波長的光不被吸收而得以透射,這部分透射光的顏色即為透明物質(zhì)的顏色。根據(jù)這一原理,對上述5 種溶液進(jìn)行了紫外-可見吸收光譜測試(見圖4)。譜圖中,譜峰所在位置的波長對應(yīng)溶液自身顏色的補色。讀出譜峰所在波長,將一條譜線中多個譜峰對應(yīng)的顏色混合而成的顏色即為溶液顏色在色環(huán)中的補色[4](見圖5),由此可以判斷溶液的顏色(即透射光顏色)。以綠色溶液的譜圖為例,該譜線在紫色和橙色光處有峰,將紫色與橙色光調(diào)和之后為玫紅色光,其對應(yīng)補色光恰為綠色光。同理可以利用紫外-可見吸收光譜圖解釋其他的幾種顏色溶液。因此可以判斷,紫外-可見吸收光譜可用來表征本實驗中5 種溶液的顏色。
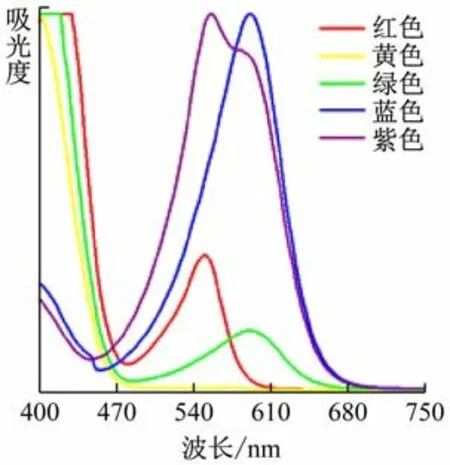
圖4 5色溶液的紫外-可見吸收光譜圖

圖5 顏色互補色環(huán)
為了排除場地?zé)艄庹丈鋾r溶液中出現(xiàn)化學(xué)反應(yīng)的可能性,將5 種溶液置于場地?zé)艄庀抡丈湟欢螘r間后,再將各色溶液置于白光下觀察,肉眼發(fā)現(xiàn)顏色與預(yù)實驗時一致。再進(jìn)一步對它們進(jìn)行紫外-可見吸收光譜測試,譜線并未出現(xiàn)明顯差異,見圖6,證明溶液中沒有發(fā)生化學(xué)變化。
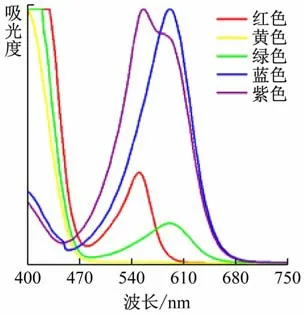
圖6 場地?zé)艄庹丈浜蟮?色溶液紫外-可見吸收光譜圖
結(jié)合所加入酸堿指示劑的種類考慮,紅色溶液所含酸堿指示劑為酚酞和對硝基苯酚,綠色溶液為百里酚藍(lán)和對硝基苯酚,而黃色溶液全部為對硝基苯酚。在偏黃的燈光照射下,此3 種溶液中對硝基苯酚的顏色均沒有很好地顯現(xiàn)出來,而呈現(xiàn)出類似不含對硝基苯酚時的堿性溶液顏色。可以認(rèn)為,由于場地的光源色彩偏黃,使得整個場地均呈現(xiàn)出偏黃的色彩。因此對硝基苯酚在堿性下所顯現(xiàn)出來的黃色在整個場地的映襯下不夠鮮明,因而難以被觀察到。此外,本身不含有對硝基苯酚指示劑的藍(lán)色和紫色溶液受到場地?zé)艄庥绊懖淮螅匀怀尸F(xiàn)較為理想的顏色,這一實驗現(xiàn)象證明了對實驗結(jié)果的預(yù)計。
接著對紅色、黃色和綠色溶液的顏色進(jìn)行校正。由于對硝基苯酚的顏色不夠鮮明,因此首選調(diào)整酸堿指示劑配比和加入量來提高對硝基苯酚在溶液中所占的比重。對于紅色和綠色溶液,提高對硝基苯酚所占的比例;對于黃色溶液,則選擇增加對硝基苯酚的加入量。校正之后發(fā)現(xiàn),提高對硝基苯酚比例對綠色溶液的效果較好,所得色彩較為理想,但是對于紅色和黃色溶液卻收效甚微。因此對于紅色和黃色溶液,不再提高對硝基苯酚比例,而選擇提高堿液濃度(pH 值)。在紅色和黃色溶液中,使用0.1 mol/L NaOH 溶液,這使得溶液色彩加深效果大大提高,取得了理想的效果。而對于綠色、藍(lán)色和紫色溶液,若使用0.1 mol/L NaOH溶液,會使得溶液顏色過深,影響展示效果。
另外,由于展示現(xiàn)場光強遠(yuǎn)大于預(yù)實驗時的自然光強,使得各色溶液色彩均產(chǎn)生了一定程度的變淺。因此對酸堿指示劑的加入量也進(jìn)行了微調(diào),得到滿意的結(jié)果。最終配比和用量如表3 所示。
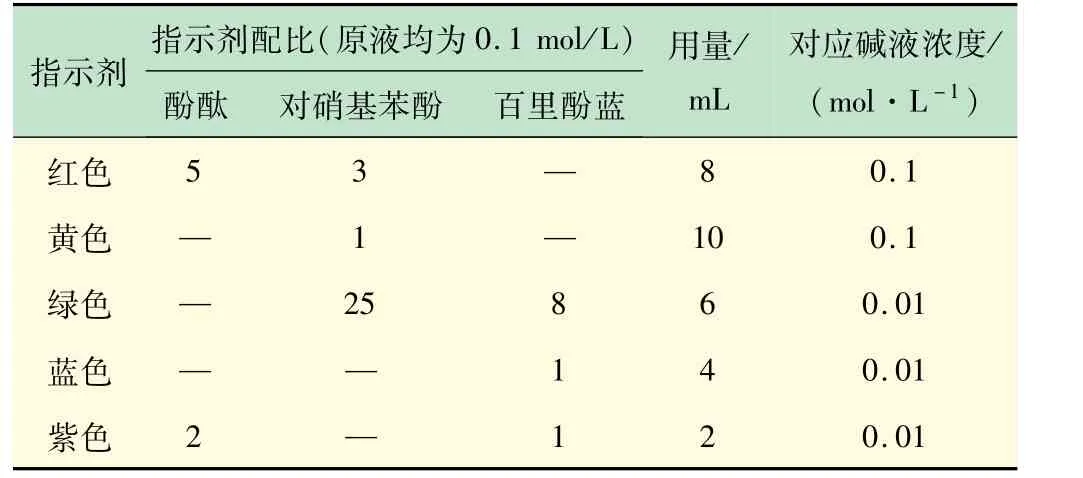
表3 偏黃燈光下不同顏色溶液所需指示劑的對應(yīng)配比校正
5 結(jié) 語
本實驗的出發(fā)點原本為一個簡單的酸堿指示劑變色實驗,創(chuàng)新點在于將酸堿指示劑按照不同的比例和用量混合,使用類似美術(shù)調(diào)色的方法,可以在堿性條件下配制出理論上各種顏色的溶液,用于趣味實驗展示。但是在實驗準(zhǔn)備階段發(fā)現(xiàn),有諸多因素會對人眼觀察溶液的顏色產(chǎn)生影響。因此不僅對酸堿指示劑的配比和用量對溶液顏色的影響進(jìn)行了研究,還對容器形狀、外界光源等因素對溶液顏色的影響進(jìn)行了討論,并通過調(diào)控酸堿指示劑配比、指示劑用量以及堿濃度(pH值)等參量得到了各種環(huán)境下理想的溶液顏色。
本實驗不僅能讓學(xué)生了解化學(xué)知識,培養(yǎng)學(xué)生學(xué)會發(fā)現(xiàn)問題、思考問題、解決問題的方法,學(xué)會學(xué)習(xí),形成創(chuàng)新精神和實踐能力等,并且通過動手探究的過程,進(jìn)一步把握化學(xué)學(xué)科所蘊含的思政人文精神。通過實驗,學(xué)生從內(nèi)心確立起對科學(xué)之美的價值追求。這也是將育人貫穿于專業(yè)課程教學(xué)的全過程,將學(xué)生為中心的理念貫穿教學(xué)全過程[12-13]。
化學(xué)學(xué)科中蘊含著豐富的思政元素,只有善于挖掘出思政元素,才能實現(xiàn)與課堂內(nèi)外的自然融合[15-16],用辯證唯物主義思想去分析問題,反思實驗,不僅有助于學(xué)生專業(yè)知識的學(xué)習(xí)和動手操作技能的培養(yǎng),更有助于學(xué)生形成科學(xué)的思維方式[16]。
本實驗盡管化學(xué)原理簡單,但實驗過程伴隨著物理因素影響,無形中產(chǎn)生了新的現(xiàn)象,是實驗前始料未及的。該實驗反映了麻雀雖小,五臟俱全,囊括了提出設(shè)想、遭遇問題、探究原理、解決問題等許多學(xué)術(shù)實驗中遇到的常見過程。不僅體現(xiàn)的是實驗室基本實驗到應(yīng)用于實際的過程,還體現(xiàn)了物理、化學(xué)、美術(shù)等多學(xué)科的原理對一個展示實驗的影響,對一個簡單的趣味實驗追根溯源,體現(xiàn)了化學(xué)實驗中的許多探究和創(chuàng)新方法,是一個完整的實驗探究過程。這一實驗的探索過程,反映了在科研探究中應(yīng)當(dāng)采取的態(tài)度,對探索基于化學(xué)學(xué)科的課程思政和培養(yǎng)學(xué)生對化學(xué)實驗的興趣有著重要意義,同時也為廣大化學(xué)工作者帶來了啟迪。

