大黃酸對肝纖維化大鼠肝臟α-SMA、MMP-13及TIMP-1 mRNA表達的影響
郭 冶,盛延良,盧鳳美,羅文哲,孟慶媛,殷 悅,劉東璞
(佳木斯大學基礎醫學院,黑龍江 佳木斯 154007)
南北朝醫家陶弘景有云:“大黃,其色也。將軍之號,當取其駿快也。”中藥大黃最早作為瀉下藥,大黃酸是大黃的主要有效成分之一,在抗氧化應激中清除超氧陰離子自由基能力最強[1]。盧鳳美等[2]通過探討基質金屬蛋白酶-13(MMP-13)及α-平滑肌肌動蛋白(α-SMA)表達量的研究結果顯示,中藥大黃酸聯合紅景天可抑制肝纖維化的進展。肝纖維化是肝臟疾病必經的可逆動態病理過程[3-4],是在炎癥、病毒、寄生蟲等病因作用下引起肝細胞發生炎癥及壞死等變化,大量炎癥細胞趨化聚集,活化靜止的肝星狀細胞,生成釋放α-SMA的肌成纖維細胞,導致細胞外基質合成與降解失調,使肝內纖維結締組織異常沉積的病理過程[5-7]。肝纖維化早期階段膠原沉積在竇周間隙內皮下,使間隙變小甚至完全消失,進而肝竇毛細血管化,肝細胞間物質運輸受阻,終因缺血、缺氧、變性壞死導致功能障礙[8];晚期階段(即肝硬化)形成假小葉及結節,嚴重者甚至發展至肝癌、肝衰竭等,唯一的根治途徑仍是去除有害刺激和肝移植[9]。大黃酸藥代動力學研究結果顯示,人體內最高安全劑量為600 mg/(kg·d)[10];也可選擇不同的給藥方式,如口服給藥、保留灌腸給藥等[11]。本研究采用大黃酸經口灌胃給藥方式。
1 材料與方法
1.1材料
1.1.1動物 2019年3月選取健康成年SPF級SD雄性大鼠60只,體重180~220 g。由佳木斯大學實驗動物中心提供,實驗動物生產許可證號:SCXK(遼)2015-0001,使用許可證號:SYXK(黑)2016-014。本研究經本院倫理委員會審核通過。
1.1.2儀器與試劑 熒光定量聚合酶鏈反應(PCR)儀(美國ABI公司,型號:7300)、PCR儀/基因擴增儀(美國ABI公司,SimpliAmp)、瓊脂糖水平(核酸)電泳儀(中國北京六一,型號:DYCP-31CN)、Gel Doc XRTM凝膠成像系統(美國Bio-Rad公司,型號:Universal Hood Ⅱ)、-80 ℃超低溫冰箱(日本SANYO,MDF-U32V)等。大黃酸購于江蘇省淮安市巍偉植化研究所,秋水仙堿(國藥準字H20113208)購于廣東彼迪藥業有限公司,逆轉錄聚合酶鏈反應(RT-PCR)試劑盒購于FOREGENE公司。
1.2方法
1.2.1動物飼養及分組 將60只大鼠飼養于避強光照、僻靜、室溫(22±2)℃、相對濕度(55±5)%條件下,在遵從大鼠正常生物鐘的前提下標準飼養,自由飲水,科學觀察3 d后采用完全隨機抽樣法分為空白對照組(N組)、四氯化碳(CCl4)模型組(M組)、秋水仙堿組(C組)、大黃酸低劑量組(RL組)和大黃酸高劑量組(RH組)。每組12只。
1.2.2肝纖維化模型創建及給藥 肝纖維化模型制備:M、C、RL、RH組大鼠腹腔注射40%CCl4與花生油混合物3 mL/kg,每周2次。N組大鼠腹腔注射等體積花生油。造模3周后C組大鼠給予秋水仙堿,劑量為0.2 mg/kg灌胃,RL、RH組大鼠給予大黃酸,劑量分別為50.0、100.0 mg/kg,上述藥品溶于生理鹽水中,形成的混懸液給予灌胃,N、M組大鼠給予等體積生理鹽水,每周3次,共灌胃4周。
1.2.3RT-PCR檢測肝臟α-SMA、MMP-13及金屬蛋白酶組織抑制劑-1(TIMP-1)mRNA表達 按RT-PCR試劑盒從肝臟中提取總RNA,再以此為模板合成cDNA,再進行擴增,進行RT-PCR,通過觀察循環數(Ct)值,計算2-ΔΔCt值進行靶基因細胞因子定量分析。引物由通用生物系統(安徽)有限公司合成,引物設計見表1。

表1 引物設計
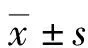
2 結 果
2.1各組大鼠肝臟病理學檢查結果比較 N組大鼠肝小葉結構排列整齊,肝細胞形態正常;與N組比較,M組大鼠肝小葉結構紊亂,肝小葉間大量纖維膠原組織增生,較寬,延伸入小葉間,有少量形成完整假小葉間隔,肝條索間隙增寬,伴肝細胞脂肪變及氣球樣變;與M組比較,C、RL、RH組大鼠纖維結締組織明顯減少,其中RH組大鼠纖維化程度最輕。見圖1。

圖1 各組大鼠肝臟病理學檢查結果比較(蘇木精-伊紅染色,200×)
2.2各組大鼠肝臟α-SMA、MMP-13及TIMP-1 mRNA表達情況比較 與N組比較,RH、C、RL、M組大鼠肝臟α-SMA、TIMP-1 mRNA表達量逐漸升高,MMP-13 mRNA表達量逐漸降低,且RH、C、RL、M組間比較,差異均有統計學意義(P<0.05)。見表2。

表2 各組大鼠肝臟α-SMA、MMP-13及TIMP-1 mRNA表達情況比較
3 討 論
大黃酸作為一種天然自噬調節因子,可通過調節AMP依賴的蛋白激酶/哺乳動物雷帕霉素靶蛋白信號途徑有效抑制腎小管細胞自噬活性[12];通過轉化生長因子β(TGF-β)/Smad蛋白和Wnt/β-聯蛋白信號通路顯著降低腎細胞中TGF-β引起的克洛索基因啟動子轉錄,從而起到抗腎纖維化作用[13]。大黃酸在治療慢性移植腎腎病時肝細胞生長因子及骨形態發生蛋白表達明顯升高,且移植腎組織間質纖維化減輕[14]。TAN等[15]研究表明,大黃酸能顯著抑制腎小球系膜細胞TGF-β1和p38絲裂原活化蛋白激酶活化,減少纖維連接蛋白的生成和分泌,進而減少細胞外基質合成而抑制纖維化的發生,從而達到防治糖尿病腎病的作用。大黃酸抑制微小RNA-21及干預TGF-β1/Smad7通路的研究證實,其具有抗肺纖維化的作用[16]。GUO等[17]通過CCl4造模大鼠肝纖維化后檢測TGF-β1和α-SMA的表達,給予大黃酸高、低劑量,從大黃酸抗炎、抗氧化及抑制肝星狀細胞活化,以及抑制TGF-β1作用等可能相關角度考慮,從而驗證了大黃酸抗肝纖維化的作用。血小板衍生生長因子-D未能增加α-SMA的產生,具有上調TIMP-1表達的能力[18]。γ-干擾素、腫瘤壞死因子α和表皮生長因子均能通過刺激Smad7蛋白表達而抑制TGF-β/Smad誘導的包括肝纖維化的反應[19]。TSANG等[20]發現,SHh/GLI1信號傳導是TGF-β依賴性纖維發生過程中核因子κB的轉錄靶標,是因為調節胰腺星狀細胞活化和細胞外基質產生的中心信號級聯反應。
本研究通過腹腔注射CCl4成功制作了肝纖維化大鼠模型,經藥物干預后結果顯示,M組大鼠肝臟α-SMA、TIMP-1 mRNA表達量較N組明顯升高,與大鼠肝纖維化程度呈正相關,RH組大鼠肝臟α-SMA、TIMP-1 mRNA表達量相對少于M組;RH組大鼠肝臟MMP-13 mRNA表達量最高,肝纖維化程度相對較輕,與大鼠肝纖維化程度呈負相關。截至目前,大黃酸已是治療多臟器纖維化的選用藥物之一,本研究再次表明,肝臟可能成為大黃酸抗纖維化作用的再一個靶標。

