SAM和GSH發酵聯產過程中合成關鍵酶的作用機制
馬瑞 何鑫
(寧夏回族自治區森林病蟲防治檢疫總站,寧夏 銀川 750001)
引言
SAM在生物體內是重要的中間代謝物質,參與多種生化反應,在臨床上應用十分廣泛,在藥用方面有很大的應用前景,受到越來越多的生命科學領域和醫藥領域人士的關注。
GSH是細胞內非蛋白巰基的主要組成部分,在生物體內具有維持適宜氧化還原環境、作為抗氧化劑保護酶和蛋白的硫氫基、防止自由基的氧化損傷等重要功能,使其在臨床、食品、體育運動等多個領域有廣泛的應用前景[1]。目前生物合成法即酶法和微生物發酵法較受研究者關注,而微生物發酵法因其發酵微生物(細菌或酵母)培養簡單,生產工藝和方法不斷改善,成為了目前工業化生產SAM和GSH的普遍方法[2]。
SAM和GSH均是含硫化合物代謝網絡中的重要節點物質,具有共同的代謝途徑[3]。因此研究不同可控條件下的SAM和GSH聯合高產,具有重要的理論和生產價值。ATP的存在為SAM和GSH合成提供了能量,而ATP主要是由細胞呼吸作用產生的。因此可以通過改變發酵條件影響細胞的呼吸,進而影響細胞的能量代謝途徑,最終實現GSH和SAM的聯合高產。本文通過設置不同溶氧控制條件(15%、30%、45%、60%以及對照組恒轉速)探究不同溶氧條件對發酵聯產產量影響,對比得出最佳溶氧控制條件。
1 材料與方法
菌種為C.utilis CCTCC M 209298,由蘇州大學基礎醫學與生物科學學院微生物工程實驗室篩選并保存。
1.1 培養基
種子培養基(g·L-1):葡萄糖20,蛋白胨10,酵母粉10,pH6.0。
發酵培養基(g·L-1):葡萄糖35,NH4SO410,KH2PO412.3,MgSO40.05,CaCl20.05,L-Met 4.6。
1.2 培養方法
1.2.1 一級種子培養
-70℃冷凍保藏的種子活化后接入準備好的一級種子培養基中,搖床轉速200r·min-1,恒溫30℃培養24h。
1.2.2 二級種子培養
以10%(v/v)接種量將新鮮種子液接種入二級種子培養基中,恒溫30℃,200r·min-1搖床培養20h。
1.2.3 分批發酵培養
將新鮮二級種子液按10%接種量接入裝液量為3L的5L在位發酵罐中,控制溫度30℃,初始通氣量1vvm,pH5.0(在pH電極的檢測下,通過2mol·L-1的H2SO4和2mol·L-1的NaOH自動流加控制),初始攪拌轉速350r·min-1。發酵過程中,當溶氧降低到一定值后,通過手動調節轉速和通氣量來控制恒定發酵溶氧水平,培養時間30h。
1.3 取樣方法
取樣自發酵起始0h、3h、6h、9h、12h、15h、18h、21h、24h、27h、30h從發酵罐中吸取發酵液50mL至量筒中,吹打混勻后分裝至離心管中,10mL 3管,5mL 4管。低速離心機3500rpm離心10min后,收集2mL上清進行發酵液殘糖測定,酵母泥放入-70℃冰箱保存。
1.4 分析方法
1.4.1 細胞干重(DCW)[4]
取10mL發酵罐培養液,3500rmp離心10min,蒸餾水洗滌3次后進行離心,收集菌體沉淀,70℃烘干至恒重后稱量。
1.4.2 殘糖濃度測定[5]
取轉化后的菌液離心,取10mL上清液,適當稀釋后取2mL,加入1.5mL DNS,沸水浴5~7min,再冷水浴冷卻至室溫,定容至25mL,520nm處測OD值,通過標準曲線對比得出殘糖濃度。
1.4.3 GSH測定[6]
離心所得酵母泥在-70℃冷凍過夜后,第2天用40%酒精25mL搖床30℃振蕩萃取2h后,3500r·min-1離心10min,取上清進行胞內GSH測定。獲得的樣品胞內稀釋25倍后采用DTNB-谷胱甘肽還原酶循環法進行定量測定。
在2mL體積的比色皿中按順序依次加入100μL DTNB,700μL NADPH和經適當稀釋的樣品200μL(胞內稀釋25倍,胞外稀釋100倍)。室溫下加入10μL谷胱甘肽還原酶啟動反應,在412nm處測定反應體系的初始OD值和反應3min后的OD值。
1.4.4 SAM的提取和測定
10mL發酵液離心取細胞沉淀,向沉淀中加10mL 0.35M稀硫酸,4℃靜置萃取2h,3500r·min-1離心10min,上清液經0.22μm膜過濾即得樣品(約需1mL)。得到的樣品采用HPLC法進行分析。色譜柱為反相SunFireC18柱(4.6nm×250nm),流動相為0.5mol·L-1的甲酸銨(化學純,用甲酸溶液調pH至4.0)溶液,流速0.8mL·min-1,檢測波長254nm,柱溫25℃,檢測池溫度30℃,進樣量20μL[7]。
1.4.5 輔因子定量分析
離心得到的酵母泥,液氮處理1min后放入-70℃超低溫冰箱中保存。將濕細胞重新懸浮在5mL 0.2mol·L-1磷酸緩沖液(pH7.0)中,超聲波破碎10min(功率22%,破碎10s,間隔10s),離心后得到的上清液作為待測樣品,采用HPLC法檢測輔因子含量[8]。
1.5 酶活測定
1.5.1 γ-谷氨酰半胱氨酸合成酶(γ-GCS)酶活測定
微量定磷法,使用南京建成γ-GCS檢測試劑盒(A091-2)測定。
1.5.2 SAM合成酶酶活測定
發酵過程中SAM合成酶的酶活水平是通過測定體外酶促反應液的SAM含量來監控[9]。
2 結果與討論
2.1 不同溶氧控制條件對細胞生長和SAM、GSH產量影響
對于發酵,溶解氧既屬于營養因素,又屬于環境因素,特別是對于本次實驗SAM和GSH的生產代謝過程中,DO的改變會影響產朊假絲酵母呼吸鏈中的氧化還原,同時也會對酵母細胞的生長和SAM、GSH形成產生影響。由于在發酵的不同階段,細胞對溶氧的需求水平并不相同,恒定轉速的發酵很容易造成發酵過程中溶氧的不足或過剩,使得菌體發生厭氧代謝或氧中毒,對發酵產生不利的影響[10]。為此本實驗將設定恒定溶氧,研究恒溶氧對發酵過程的影響,探究菌體生長的最佳溶氧水平。
為了探究不同溶氧條件下對SAM和GSH產量代謝影響,本實驗將溶氧條件分別設定為15%恒溶氧、30%恒溶氧、45%恒溶氧、60%恒溶氧以及對照組恒轉速(不控溶氧)5個批次來分別對比細胞生長情況(見圖1)。由圖1可見,各溶氧控制條件細胞量均在15h達到最大值,此時葡萄糖基本耗盡;各溶氧條件下,細胞量水平相似,在發酵前15h內,30%恒溶氧發酵的細胞量水平較高;此時細胞合成已經停止,但因為一些中間代謝物質的存在,目標產物SAM和GSH仍在繼續合成[2]。由圖2可見,對GSH和SAM合成有利的溶氧控制條件分別為30%恒溶氧和60%恒溶氧;在30%恒溶氧的控制條件下,GSH的積累量在18h達到了最大值376.6mg·L-1,與實驗對照組恒轉速相比提高了46%;在60%恒溶氧的控制條件下,SAM的積累量在30h時達到最大值243.8mg·L-1,與實驗對照組恒轉速條件相比提高了26%。
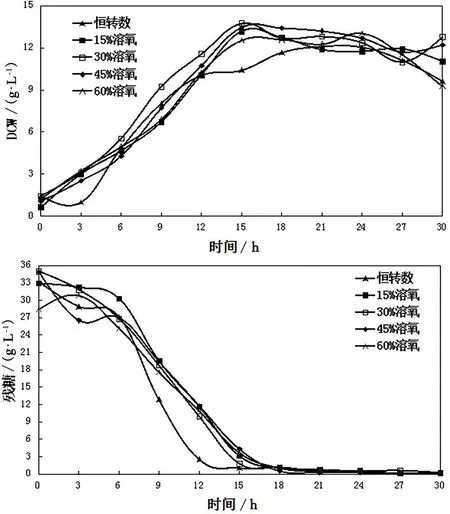
圖1 不同溶氧下細胞量和殘糖量

圖2 不同溶氧下SAM、GSH以及兩者聯合產量
進一步將SAM和GSH聯產積累量作圖分析可以看出,綜合2種目標產物的聯產量,在30%恒溶氧控制的條件下產量最高,在27h達到最大值594mg·L-1,與實驗對照恒轉速組相比提高了38%。為了更加直觀地關注GSH、SAM發酵過程中的生產效率,本實驗將發酵過程中的各指標參數列于表1。從表中各指標參數綜合對比來看,30%恒溶氧的參數與各實驗組參數指標相對比,其各項發酵指標均較為理想。對于此實驗結果,以下將從GSH、SAM的發酵過程中的酶活角度來闡述和分析。
2.2 不同溶氧控制條件下GSH和SAM發酵過程分析
在上一節中,通過圖表直觀地了解到30%恒溶氧發酵條件下GSH和SAM的聯產量達到最高,與對照組相比提高了38%。在發酵過程中,與GSH、SAM合成緊密聯系的是γ-谷氨酰半胱氨酸合成酶和SAM合成酶,其酶活程度直接決定了GSH和SAM的產量高低。從圖2可見18h后GSH幾乎不再合成,GSH胞內含量逐漸下降,分析原因有2點:GSH合成速度逐漸慢于GSH降解速度,使得GSH胞內含量逐漸趨于平緩甚至下降;培養基內谷氨酸供給缺乏,谷氨酸是GSH合成必須的前體物質。在對不同溶氧條件下γ-GCS酶活數據分析(圖3),在15h時酶活達到最高。此時細胞的葡萄糖基本耗盡,酶活逐漸降低,GSH的積累量逐漸持平甚至降低。從圖3中可以看出,30%的恒溶氧條件下,γ-GCS的酶活明顯高于其它實驗組,由此可以得出30%恒溶氧條件的GSH產量高是由于γ-GCS的酶活最高。
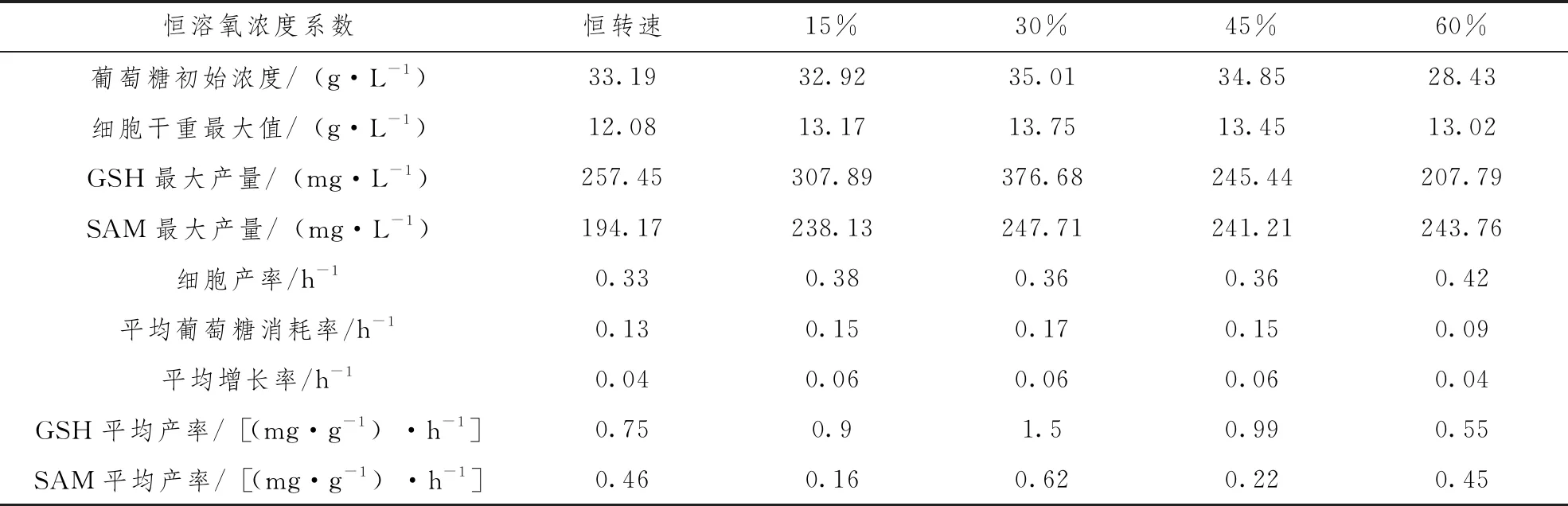
表1 不同溶氧條件下GSH和SAM聯產發酵過程參數
與SAM合成密切相關的是SAM合成酶,在整個發酵過程當中60%恒溶氧發酵的胞內含量高于其它溶氧控制條件的實驗組,與起始胞內含量相比,SAM的胞內提高了104%。綜合其它組的SAM合成規律發現細胞在15~18h之后合成速度明顯加快,SAM胞內含量急速上升,這與SAM合成酶的聯系十分緊密。從圖3中可知15h后SAM合成酶的酶活由之前的下降趨勢逐漸開始上升,隨著其上升的趨勢,SAM在胞含量逐漸提高。這是由于15h之后,GSH基本不再合成,而SAM是GSH合成中的前體物質,GSH不再合成,SAM的消耗量降低,由此得到了一定量的積累。在30%恒溶氧的發酵過程當中,γ-GCS酶活始終保持著明顯高于其它組的活性,其GSH合成十分旺盛,使得其相應的SAM消耗也高于其它實驗組,因此在SAM合成產量方面并沒有優于其它組。從圖3可見,30%恒溶氧18h后SAM合成十分旺盛,與起始SAM胞內含量相比提高了300%。

圖3 不同溶氧條件下的γ-GCS、SAM合成酶活性
從γ-GCS和SAM合成酶角度可分析得出30%恒溶氧發酵的SAM和GSH聯產量之所以高于其它實驗組,是由于其γ-GCS酶活明顯高于其它組別,并且SAM胞內含量處于上升階段時SAM合成酶亦處于活躍階段,酶活程度的高低直接影響到目標產物產量高低。
3 結論
本實驗過程中,通過對實驗數據的分析得出由于15h葡萄糖基本耗盡,細胞在這時停止合成,最高生物量達到13.75g·L-1。
不同溶氧條件下,SAM和GSH聯產發酵產量不同,30%恒溶氧最利于GSH合成,較對照組提高了46%,在18h達到376.4mg·L-1;60%恒溶氧最利于SAM合成,較對照組提高了26%,在30h達到243.8mg·L-1。綜合2者合成量進行對比,30%恒溶氧最利于SAM、GSH發酵聯產,較對照組產量提高了38%,在27h達到594mg·L-1。
SAM、GSH合成關鍵酶酶活直接影響SAM、GSH產量,酶活高有利于SAM和GSH合成。對γ-GCS酶活數據分析,在15h時酶活達到最高,30%恒溶氧的γ-GCS酶活明顯高于其它實驗組,使得其GSH含量最高。SAM合成隨SAM合成酶的酶活升高而加速,并且由于18h后GSH合成逐漸減慢,SAM消耗減少,因此積累量增多。

