5-氮雜-2′-脫氧胞苷對人甲狀腺乳頭狀癌細胞DNA甲基化及DAPK基因表達的影響
梁書卿,魏 楓,孫洪莉,鄭 朦,王曉艷,李冉浩,馬玉博
甲狀腺癌是內分泌系統中最常見的惡性腫瘤,在過去幾十年的發病率呈逐年上升趨勢[1]。腫瘤的發生涉及基因的多種復雜變化及基因表型的改變,其中,表觀遺傳學改變在腫瘤的發生發展中起了重要的作用,DNA甲基化是一種由DNA甲基轉移酶(DNA methyltransferases,DNMTs)介導的化學修飾,與腫瘤的發生發展密切相關[2-4]。死亡相關蛋白激酶基因(death-associated protein kinase,DAPK)啟動子區域甲基化促進多種腫瘤的發生,但在甲狀腺乳頭狀癌上少有報道,是目前研究的熱點之一[5-6]。因此,抑制DNMTs可能作為治療甲狀腺癌的靶點,5-Aza-CdR是一種甲基轉移酶抑制劑,研究[7-8]顯示該藥已經成功作用于肺癌、白血病等腫瘤,而在甲狀腺癌中作用尚不清楚。該文以甲狀腺乳頭狀癌細胞系及甲狀腺正常細胞系為研究對象,通過體外給予5-Aza-CdR來觀察細胞系中DAPK、DNMT1、DNMT3A、DNMT3B mRNA和蛋白表達的情況,為研究甲狀腺癌的發生發展機制及治療提供理論依據。
1 材料與方法
1.1 材料人正常甲狀腺細胞(Nthy-ori-3)、人甲狀腺乳頭狀細胞(TPC-1)均購自復旦細胞庫;去甲基化制劑5-Aza-CdR購自美國Sigma公司;1640培養基、胎牛血清、PBS均購自美國Gibco公司;反轉錄試劑盒購自日本Toyobo公司;一抗GAPDH、DNMT1、DNMT3A、DNMT3B均購自美國CST公司;DAPK抗體購自英國Abcam公司;抗兔辣根過氧化酶(HRP)Ig G二抗購自北京中杉金橋技術有限公司;引物均由上海生物技術公司合成;RealSYBR Mixture購自北京康為世紀生物科技有限公司。
1.2 方法
1.2.1Nthy-ori-3、TPC-1細胞的培養及細胞模型的制備 Nthy-ori-3、TPC-1細胞在含10%胎牛血清的1640培養基,37 ℃、 5%CO2孵育箱中培養,2~3 d傳代。根據實驗要求,將細胞分別接種于培養皿或孔板中,取對數生長期細胞進行下一步實驗。培養Nthy-ori-3、TPC-1細胞,待其狀態穩定,形態飽滿,達到指數生長期,融合度約為60%~70%時換液,實驗組加入10 μmol/L的5-Aza-CdR,對照組加入完全培養基繼續培養,整個實驗分為甲狀腺正常細胞未加藥組Nthy-ori-3(-)、甲狀腺正常細胞加藥組Nthy-ori-3(+)、甲狀腺乳頭狀癌未加藥組TPC-1(-)、甲狀腺乳頭狀癌加藥組TPC-1(+),繼續置于37 ℃、5%CO2培養箱中培養48 h。
1.2.2Real-time PCR檢測各組DAPK及DNMTs的mRNA表達 采用TRIzol 法提取各實驗組細胞總RNA,使用NanoDrop-2000檢測提取的RNA濃度,使用Toyobo反轉錄試劑盒按照說明書操作進行DNA反轉錄,在ABI7900上進行Real-time PCR,引物序列見表1。反應體系均為:Mix 10 μl,cDNA 2 μl;上下游引物各0.5 μl;去離子水7 μl;擴增均在不同的管中進行,擴增反應條件:95 ℃預變性5 min,95 ℃變性30 s(DAPK:59℃,DNMT1、DNMT3A、DNMT3B:60℃,GAPDH:59℃)退火30 s,72 ℃延伸30 s共40個循環,最后72 ℃繼續5 min讓反應充分,4 ℃暫時保存,實驗重復3次。
所有反應設置3個復孔,目標基因的CT值通過GAPDH的CT值均一化,即ΔCT=CT目標-CTGAPDH,而目標基因mRNA相對豐度值以 ΔΔCT 值(DD value)表示,ΔΔCT=2-ΔCT。通過比較各組目標基因 ΔΔCT,分析其表達的變化。

表1 熒光定量RCR引物序列
1.2.3Western blot檢測各實驗組DAPK及DNMTs的蛋白表達 收集藥物作用前后的細胞,用RIPA細胞裂解液(強)裂解細胞,提取各組蛋白,BCA蛋白定量法測提取蛋白的濃度。20 μg蛋白定量,用SDS-PAGE(5%~10%)分離,再轉到PVDF膜上。用5%脫脂奶粉封閉1.5 h,加入一抗體(1 ∶1 000),4 ℃孵育過夜,再在與辣根過氧化物酶標記的二抗(1 ∶3 000)室溫孵育2 h。每步完成都要用TBST洗滌3次,每次10 min。ECL發光液處理,圖像通過Tanon-5800成像系統獲得,以GAPDH為內參。
2 結果
2.1 Real-time PCR上機實驗加樣上機進行Real-time PCR實驗,擴增曲線不同顏色代表4個分組:甲狀腺正常細胞未給藥組Nthy-ori-3(-)、甲狀腺正常細胞給藥組Nthy-ori-3(+)、甲狀腺乳頭狀癌細胞未給藥組TPC-1(-)、甲狀腺乳頭狀癌細胞給藥組TPC-1(+),曲線共同抬頭于第20循環,反應良好,見圖1。
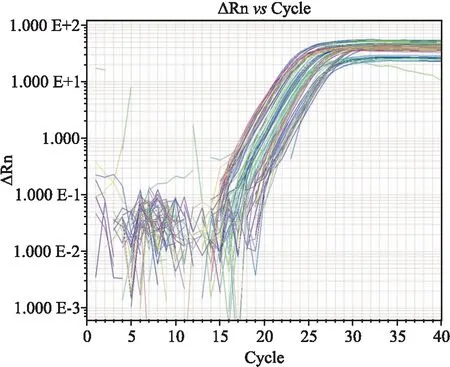
圖1 Real-time PCR擴增曲線圖
2.2 Real-time PCR分析各組DNMTs mRNA的表達DNMT1、DNMT3A、DNMT3B的mRNA表達水平以GAPDH mRNA為內參得到各組相對值,與正常甲狀腺細胞未給藥組相比,甲狀腺乳頭狀癌細胞未給藥組的DNMT1、DNMT3A、DNMT3B的mRNA的表達量較高,差異有統計學意義(P<0.05)。與甲狀腺乳頭狀癌細胞未給藥組相比,甲狀腺乳頭狀癌給藥組經5-Aza-CdR處理48 h后,DNMT1、DNMT3A、DNMT3B的mRNA 表達量均下降(F=9.381、17.009、4.867,P=0.005、0.001、0.033),差異有統計學意義(P<0.05)。見圖2。
2.3 Real-time PCR分析各組DAPK mRNA的表達Real-time PCR結果顯示,各組DAPK mRNA的表達存在差異(F=10.790,P=0.003)。在人正常甲狀腺細胞中DAPK表達甚少,且加藥后無改變,差異無統計學意義(P=0.999);甲狀腺乳頭狀癌細胞經5-Aza-CdR處理48 h后,DAPK基因mRNA的表達升高,差異有統計學意義(P=0.024)。見圖3。
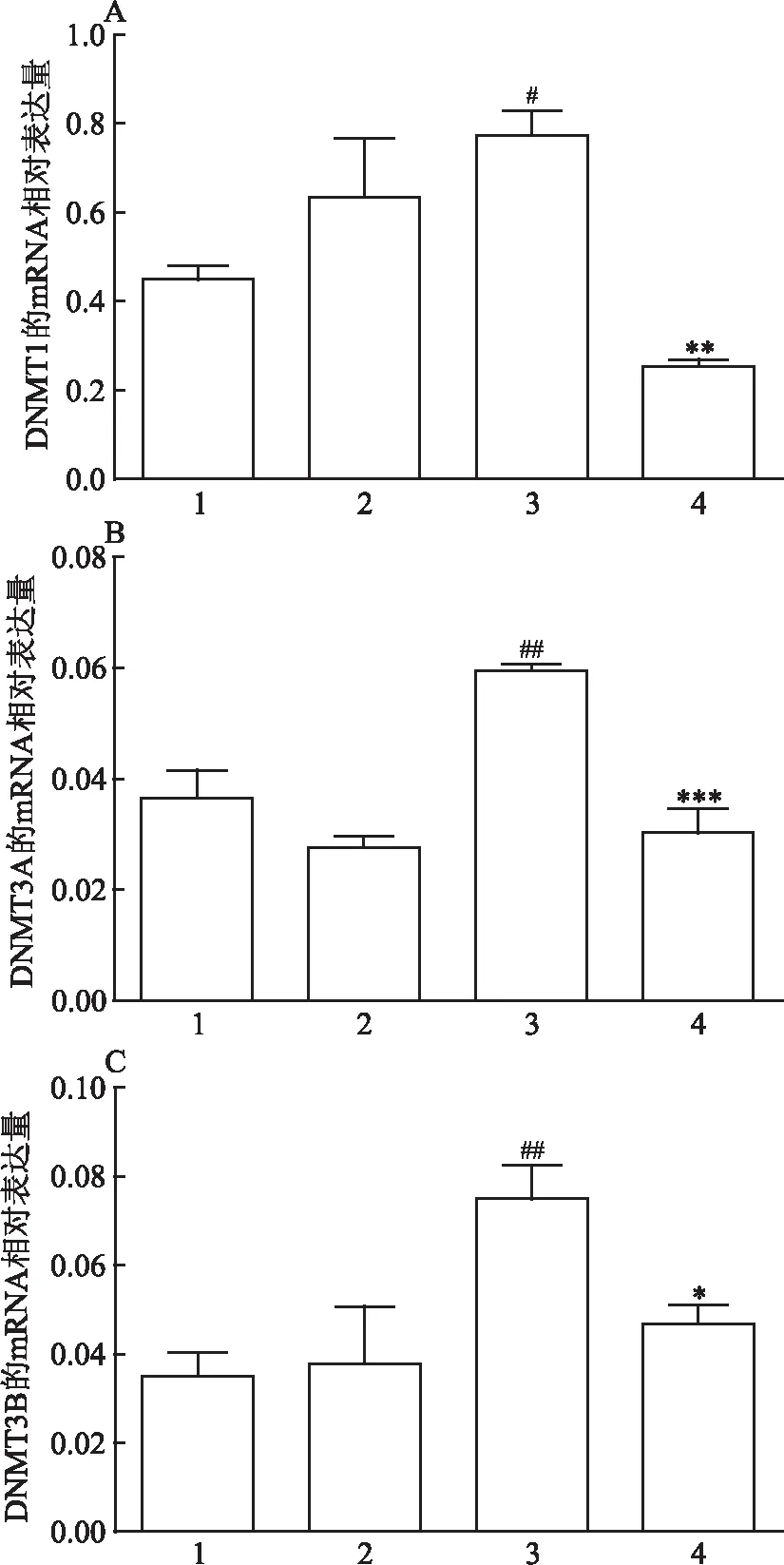
圖2 各實驗組甲基轉移酶mRNA的相對表達量
2.4 Western blot分析各組DNMTs蛋白的表達Western blot結果顯示,各組DNMT1、DNMT3A、DNMT3B蛋白水平表達存在差異(F=7.642,P=0.010;F=4.983,P=0.031;F=13.446,P=0.002)。正常甲狀腺細胞無論給藥前后,DNMTs的蛋白表達均無差異(P>0.05)。與人正常甲狀腺細胞未給藥組相比,甲狀腺乳頭狀癌細胞未給藥組中DNMT1、DNMT3A和DNMT3B的蛋白表達量高,差異有統計學意義(P<0.05)。與甲狀腺乳頭狀癌細胞未給藥組相比,5-Aza-CdR處理48 h后DNMT1、DNMT3A和DNMT3B的蛋白表達量下降,差異有統計學意義(P<0.05)。見圖4。
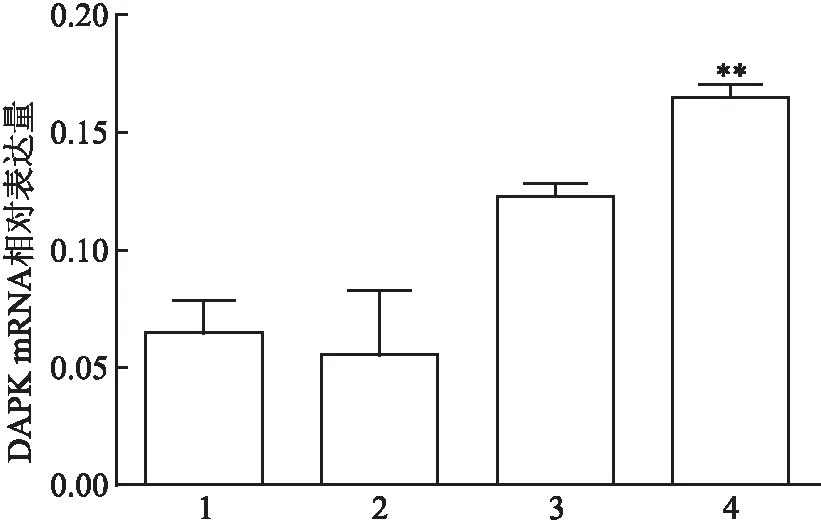
圖3 DAPK mRNA相對表達量
2.5 Western blot分析各組DAPK基因蛋白的表達Western blot結果顯示,各組DAPK蛋白表達水平存在差異(F=7.954;P=0.009)。在正常甲狀腺細胞中抑癌基因DAPK蛋白有表達,且加藥前后無改變,差異無統計學意義(P=0.485);與正常甲狀腺細胞未給藥組相比,甲狀腺乳頭狀癌細胞未給藥組抑癌基因DAPK蛋白表達低,差異有統計學意義(P=0.006),經5-Aza-CdR處理48 h后,人甲狀腺乳頭狀癌細胞中DAPK基因蛋白表達升高,差異有統計學意義(P=0.002)。見圖5。
3 討論
DAPK最早發現于1995年,是一種鈣調蛋白(calmodulin,CaM)調節的絲氨酸/蘇氨酸蛋白激酶,參與凋亡、自噬和炎癥等多種細胞過程[9-10],是凋亡的正性調節因子之一。Jing et al[11]研究發現通過抑制miR-34a-5p阻止p53-DAPK軸的破壞,上調DAPK的表達,從而抑制腎透明細胞癌的進展。DAPK作為一種腫瘤抑制基因,其啟動子區域GpG島的高甲基化致使基因轉錄沉默而失去功能,參與腫瘤的發生發展。已經在乳腺癌、非小細胞肺癌、膀胱癌、胃癌、宮頸癌等腫瘤中發現DAPK基因啟動子區域因不同程度的高甲基化導致其表達低。在哺乳動物細胞中, 目前已知有3種DNMT(DNMT1、DNMT3A、DNMT3B)參與了DNA的甲基化修飾過程,DNA 啟動子區域GpG島甲基化后并不會改變核酸的序列,只是部分堿基發生甲基化的修飾,因此基因的甲基化是一種可以被逆轉的表觀遺傳學修飾過程。使用甲基轉移酶抑制劑可以逆轉啟動區域的高甲基化,使DAPK重新表達[12-13]。徐雅娣 等[14]研究發現,DNMT1抑制劑通過調控增殖及侵襲相關蛋白的表達抑制膠質瘤細胞的增殖和侵襲。5-Aza-CdR是一種典型DNMT抑制劑,已經有研究[12,15-16]報道5-Aza-CdR通過沉默甲基轉移酶誘導肺癌、乳腺癌、食管癌等細胞株的DAPK mRNA的重新表達。但是目前國內外尚未發現5-Aza-CdR作用在人甲狀腺乳頭狀癌細胞株DAPK基因表達影響的相關報道。研究顯示甲狀腺乳頭狀癌細胞系TPC-1中DNMTs表達上調,其抑癌基因DAPK的表達水平很弱。使用去甲基化藥物5-Aza-CdR處理TPC-1細胞后,DNMTs的mRNA及蛋白表達水平降低,而DAPK的mRNA及蛋白表達水平升高,提示5-Aza-CdR可能通過沉默甲基轉移酶而降低抑癌基因DAPK啟動子區域的甲基化水平從而誘導其重新表達。
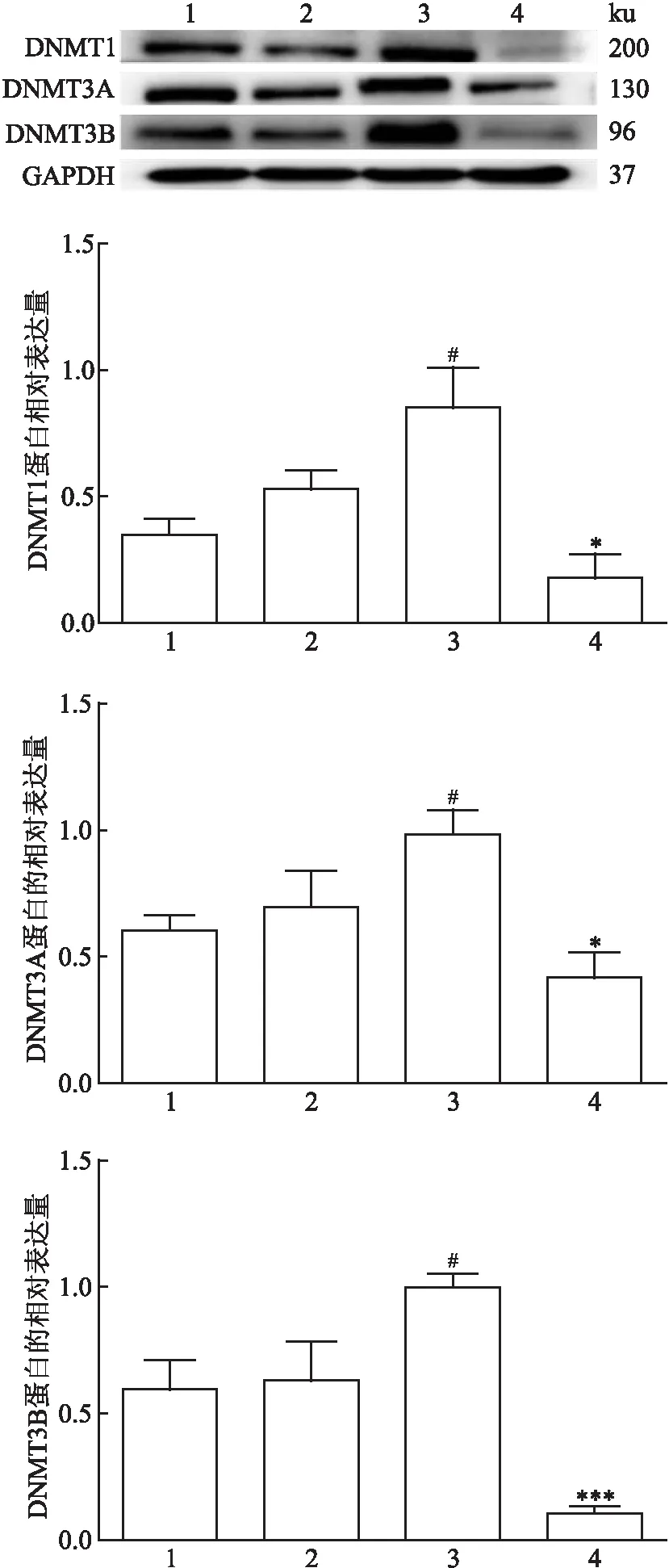
圖4 Western blot法檢測各實驗組甲基轉移酶的蛋白相對表達量
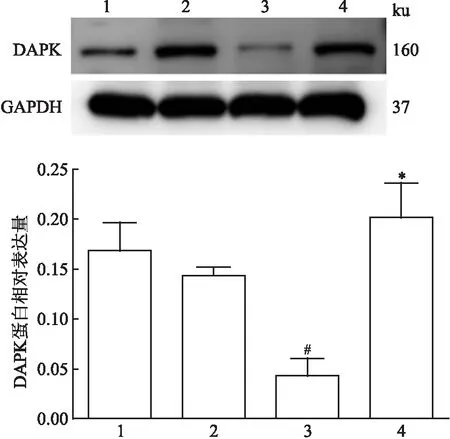
圖5 Western blot法檢測各實驗組DAPK的蛋白相對表達量
綜上所述,本研究結果表明DNMTs表達上調可能通過影響甲狀腺乳頭狀癌細胞抑癌基因DAPK的過度甲基化,使其轉錄表達過程沉默,促進甲狀腺乳頭狀癌的發生發展,5-Aza-CdR可以通過沉默甲基轉移酶而誘導DAPK 的重新表達,進而發揮對甲狀腺乳頭狀癌的防治作用。

