微小RNA-34a抑制SIRT1對滋養細胞增殖和凋亡的影響
李 紅,王 萍,黃晨曦,劉 靈,李根霞
子癇前期(preeclampsia,PE)是妊娠20周后出現的特發性高血壓綜合征[1]。PE的病因和發病機制尚未完全闡明,研究[2]發現胎盤滋養細胞凋亡過多可引起胎盤淺著床,螺旋動脈重鑄失敗,進而導致PE等妊娠疾病的發生。微小RNAs(miRNAs)是一類內源性非編碼單鏈小分子RNA,可通過對mRNA的轉錄后調控影響細胞增殖、分化、凋亡等多種生物學功能[3-4]。沉默信息調節因子1(silent information regulator 1,SIRT1)是III類組蛋白去乙酰化酶,具有抗氧化應激、抗凋亡和延長壽命等作用[5]。研究[6]發現SIRT1與滋養細胞分化以及胎盤形成相關。在腫瘤細胞中miR-34a可靶向調控SIRT1影響腫瘤細胞的增殖和凋亡[7]。然而miR-34a通過調節SIRT1影響滋養層細胞增殖和凋亡尚未見報道。該研究旨在通過探討miR-34a對SIRT1表達的調控作用及對HTR-8/SVneo細胞增殖和凋亡的影響, 為PE發病機制的研究和治療提供新的思路。
1 材料與方法
1.1 實驗材料
1.1.1組織收集 收集2018年5月—2019年 6 月于鄭州大學第三附屬醫院行剖宮產手術的30例PE患者,和同期在我院行剖宮產的30例正常足月孕婦的胎盤組織。PE的診斷標準嚴格按照第8版《婦產科學》。排除標準為孕婦患有慢性高血壓、妊娠糖尿病、心血管疾病、肝炎、胎兒染色體異常或其他妊娠并發癥。2組孕婦孕周、收縮壓、舒張壓、蛋白尿、胎兒出生體質量比較, 差異有統計學意義(P<0.05)。2組孕婦年齡、體質量指數, 差異無統計學意義(P>0.05)。本研究經鄭州大學第三附屬醫院倫理委員會批準,患者均知情同意。
1.1.2細胞株 人孕早期絨毛外滋養細胞HTR-8/SVeno購自美國典型培養物保藏中心。
1.1.3主要試劑 DMEM高糖培養基購自美國Hyclone公司;胎牛血清購自杭州四季青生物公司;Lipofectamine 3000轉染試劑購自美國Invitrogen公司;Opti-MEM培養基購自美國Gibco公司;凋亡試劑盒購自美國BD公司;逆轉錄試劑盒購自日本東洋紡公司;熒光定量PCR試劑盒購自北京康為世紀公司;兔抗人SIRT1單克隆抗體和兔抗人GAPDH單克隆抗體均購于美國Abcam生物技術有限公司;miR-34a模擬物、miR-34a抑制物及模擬物陰性對照、抑制物陰性對照均由中國上海吉瑪公司設計并合成;SIRT1 siRNA和NC siRNA由廣州銳博生物公司設計并合成。miR-34a模擬物: sense:5′-UGGC AGUGUCUUAGCUGGUUGU-3′;antisense: 5′-AACC AGCUAAGACACUGCCAUU-3′; 模擬物陰性對照:sense: 5′-UUCUCCGAACGUGUCACGUTT-3′;antisense:5′-ACGUGACACGUUCGGAGAATT-3′;miR-34a抑制物:5′-ACAACCAGCUAAGACACUGCCA-3′;抑制物陰性對照:5′-CAGUACUUUUGUGUAGUACA-3′;SIRT1 siRNA作用于SIRT1 mRNA 的靶序列為CCTTAAAACTAGAGATCAA。
1.2 實驗方法
1.2.1標本采集及處理 胎盤分娩后30 min內,于胎盤母體面剪取1 cm×1 cm×1 cm的組織塊若干,用生理鹽水沖洗后將其分為2份,一份放入含RNA儲存液的凍存管中,一份直接放入凍存管,并立即放入液氮冷凍10 min,隨后置于-80 ℃保存,以供qRT-PCR和Western blot實驗使用。
1.2.2細胞培養 HTR-8/SVneo細胞置于含10%胎牛血清不含雙抗的DMEM高糖培養基,于37 ℃,5%CO2培養箱培養。當細胞融合至80%~90%時, 進行消化傳代。
1.2.3實驗分組 ① 觀察miR-34a對SIRT1表達及細胞增殖和凋亡的影響時,HTR-8/SVneo細胞共分為4組:模擬物組、模擬物對照組、抑制物組、抑制物對照組;② 觀察SIRT1對HTR-8/SVneo細胞增殖和凋亡的影響時,細胞共分為2組: si-SIRT1組和si-NC組。
1.2.4qRT-PCR TRIzol法提取胎盤組織和轉染48 h后各組細胞的總RNA。利用紫外分光光度計的方法測定其濃度和純度。按照逆轉錄試劑盒操作流程進行逆轉錄。qPCR Mix 試劑盒進行qRT-PCR檢測,反應條件為:95 ℃預變性10 min; 95 ℃,15 s;60 ℃,60 s,40個循環進行擴增。miR-34a和SIRT1分別采用U6和GAPDH作為內參,采用 2-△△Ct計算目的基因相對表達量。引物序列見表1。

表1 qRT-PCR引物序列
1.2.5Western blot 用預冷PBS將轉染48 h后的各組細胞洗滌3次,使用RIPA裂解液冰上裂解30 min,提取總蛋白,BCA定量法測定蛋白濃度。5%濃縮膠和10%分離膠進行凝膠電泳,濕轉300 mA 1 h進行轉膜;5%脫脂牛奶室溫封閉2 h,SIRT1一抗(1 ∶2 500)和GAPDH一抗(1 ∶5 000)4 ℃孵育過夜; 二抗室溫孵1 h。ECL發光法和AI600 images成像系統對條帶進行掃描,采用Image J 軟件進行灰度值分析。
1.2.6MTS法檢測細胞增殖 將生長至對數期的HTR-8/SVneo細胞按照8×103細胞/孔,接種于96孔板, 每組6個復孔,每孔含100 μl完全培養基, 細胞密度達到40%~50%后進行轉染,48 h后更換含有0.5 mg/ml MTS的無血清培養基,37 ℃孵育1 h。酶標儀檢測490 nm處吸光度。
1.2.7流式細胞術檢測細胞凋亡水平 收集6孔板中轉染后的細胞, 預冷1×Binding Buffer洗滌細胞3次,用100 μl 1×Binding Buffer懸浮細胞,加入5 μl Annexin V-FITC和5 μl PI染色,室溫避光孵育15 min,上機前加入400 μl 1×Binding Buffer, 流式細胞儀檢測細胞凋亡情況,實驗重復3次。
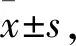
2 結果
2.1 胎盤組織中miR-34a和SIRT1 mRNA的表達及相關性PE組胎盤組織miR-34a表達水平高于對照組,SIRT1 mRNA表達水平低于對照組,差異均有統計學意義(t=8.787、-8.731,P<0.001),見圖1A。Pearson相關性分析顯示miR-34a和SIRT1的表達呈負相關(r=-0.707 4,P<0.05),見圖1B。
2.2 轉染 miR-34a模擬物和抑制物后,HTR-8/SVeno細胞中miR-34a和SIRT1的表達水平① qRT-PCR技術檢測結果顯示miR-34a在miR-34a模擬物組細胞中表達水平高于模擬物對照組, 差異均有統計學意義,(t=14.947,P<0.001),在 miR-34a抑制物組中表達水平低于抑制物對照組,差異有統計學意義(t=-9.662,P<0.01),見圖2A。SIRT1 mRNA 在 miR-34a 模擬物組細胞中的表達水平低于模擬物對照組,在miR-34a 抑制物組中的表達水平高于抑制物對照組,差異有統計學意義(t=-3.942、4.214,P<0.05),見圖2B。② Western blot印跡法結果顯示, 與模擬物對照組相比,miR-34a模擬物組SIRT1蛋白表達水平降低,與抑制物對照組相比,miR-34a抑制物組中SIRT1蛋白表達水平升高,差異有統計學意義(t=-5.126、6.571,P<0.01),見圖2C。
2.3 miR-34a對HTR-8/Sveno細胞增殖和凋亡的影響MTS結果顯示,轉染48 h后,miR-34a模擬物組細胞的增殖受到抑制。miR-34a抑制物組細胞的增殖水平增加,差異均有統計學意義(t=-10.964、15.670,P<0.001),見圖3A。流式細胞術結果顯示,轉染48 h后,miR-34a模擬物組細胞凋亡增多,差異有統計學意義(t=6.868,P<0.01)。miR-34a抑制物組細胞凋亡減少,差異均具有統計學意義(t=-16.711,P<0.001)見圖3B、C。
2.4 沉默SIRT1對HTR-8/SVeno細胞SIRT1 mRNA和蛋白表達的影響與si-NC組相比,si-SIRT1組中SIRT1 mRNA和蛋白的表達水平降低,差異有統計學意義(t=-7.077、-12.111,P<0.05),見圖4。
2.5 沉默SIRT1對HTR-8/SVeno細胞增殖和凋亡的影響MTS結果顯示,轉染48 h后,SIRT1 siRNA組HTR-8/SVeno細胞的增殖受到抑制,差異有統計學意義(t=-19.709,P<0.05),見圖5A。流式細胞術結果顯示,SIRT1 siRNA組HTR-8/SVeno細胞的凋亡水平增加,差異有統計學意義(t=4.951,P<0.05),見圖5B、C。
2.6 miR-34a結合SIRT1 mRNA靶點位置預測通過在線靶基因預測網站mircroRNA(http://www.mircrorna.org/)預測到miR-34a與SIRT1 mRNA具有靶向結合位點,見圖6。

圖1 胎盤組織中miR-34a和SIRT1 mRNA的表達及相關性

圖2 miR-34a對HTR-8/SVeno細胞中SIRT1 mRNA和蛋白表達的影響
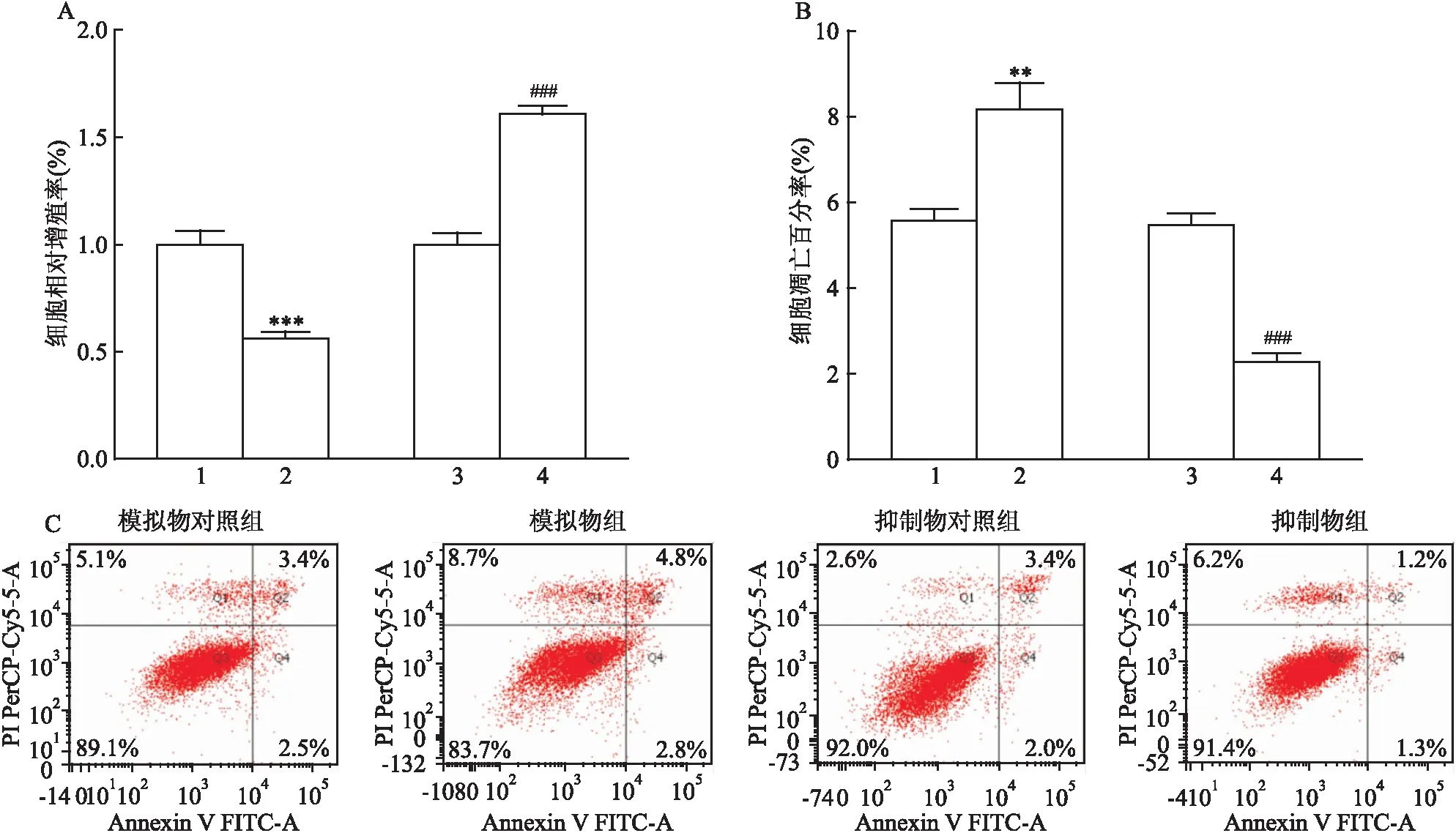
圖3 miR-34a對HTR-8/SVeno細胞增殖和凋亡的影響
3 討論
miR-34a是一種腫瘤抑制基因,位于染色體1p36,與細胞增殖、凋亡、遷移等多種生物學功能有關。研究[8-10]發現miR-34a可通過調控Notch信號通路和靶向作用MYC、Smad4等下游基因抑制滋養細胞侵襲,也可通過靶向Bcl-2促進滋養細胞凋亡,進而參與PE的發生發展。本研究顯示,與健康孕婦胎盤組織相比,miR-34a 在 PE 胎盤組織中升高,這與既往報道相一致。胎盤滋養細胞增殖能力降低,凋亡增加可引起胎盤淺著床,螺旋動脈重鑄不足,導致胎盤形成不良,是PE發生的一個重要因素。HTR-8/SVeno細胞中過表達 miR-34a可抑制細胞增殖,促進細胞凋亡。相反,抑制miR-34a的表達,促進了細胞的增殖,并抑制細胞凋亡,進一步證實了miR-34a在PE的發生發展中可能發揮重要的作用。

圖4 沉默SIRT1對HTR-8/SVeno細胞SIRT1 mRNA和蛋白表達的影響
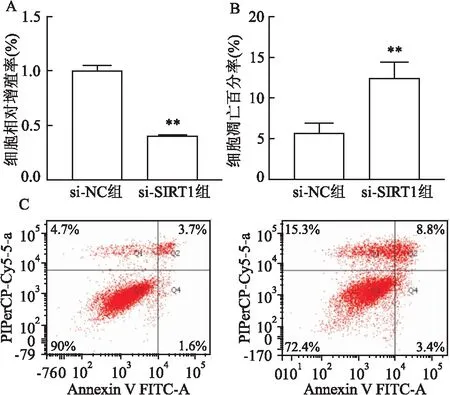
圖5 沉默SIRT1對HTR-8/SVeno細胞增殖和凋亡的影響

圖6 miR-34a結合SIRT1 mRNA的靶向位點預測
SIRT1可去乙酰化其下游基因p53,調控p53依賴的細胞凋亡途徑,也可通過去乙酰化Nrf2、PCG-1α等抗氧化基因緩解氧化應激誘導的細胞損傷和凋亡,還可通過調節細胞自噬相關基因來抑制細胞凋亡[11-12]。SIRT1主要位于人類胎盤合體滋養細胞層和細胞滋養細胞、羊膜上皮、絨毛滋養細胞層和蛻膜細胞,對滋養細胞的分化和胎盤形成具有重要的調控作用。NDRG1與SIRT1/p53信號相互作用可減輕人滋養細胞缺氧損傷[13]。本研究顯示,PE組胎盤組織中SIRT1 mRNA表達降低。體外實驗表明抑制SIRT1表達后,HTR-8/SVeno細胞的增殖能力下將,凋亡水平增加。提示SIRT1可能通過調控細胞增殖和凋亡水平參與PE的發病機制。
有研究[7]表明SIRT1是miR-34a的一個靶標, 生物信息學網站也表明二者存在靶向結合位點,理想的mirSVR score應該小于等于-0.1,圖6結果顯示二者結合不夠穩固(mirSVR score為-0.274 7)。但是使用miR-34a模擬物,可抑制SIRT1 mRNA和蛋白表達;使用miR-34a抑制物,SIRT1 mRNA和蛋白表達上調;組織實驗也顯示SIRT1與miR-34a的表達呈負相關。這些結果表明miR-34a可能通過調控SIRT1的表達參與PE的發生發展。但miR-34a是否能夠直接靶向作用于SIRT1進而影響HTR-8/SVeno細胞的增殖和凋亡能力,參與PE的發生發展,還需深入研究。
miR-34a和SIRT1 可能參與了PE的發病過程,其分子機制可能是miR-34a 通過抑制SIRT1 mRNA 和蛋白表達,抑制滋養細胞的增殖、促進滋養細胞凋亡,進而促進PE的發生發展,這為PE的發病機制提供了新的思路和方法,為PE的預防和治療提供了新的視角。

