脊髓過表達KCC2對大鼠嗎啡耐受中NMDAR和PKC表達的影響
閔繼斌,葉先才,王志堅,劉勝兵
(1.嘉善縣中醫院,浙江 嘉興 314100;2.嘉興學院醫學院,浙江 嘉興 314000)
嗎啡及其衍生物是臨床解除疼痛的主要藥物,是臨床應用廣泛的鎮痛藥,長期應用嗎啡后其鎮痛效果會漸弱,出現嗎啡耐受,甚至痛覺過敏。KCC2參與Cl-穩態,成熟神經元胞內的氯離子外排作用可以使成熟神經元胞內保持低氯離子濃度,從而使γ成氨基丁酸離子型受體發揮抑制性作用。KCC2參與各種病因導致的痛覺過敏,脊髓損傷可以引起神經系統KCC2表達改變[1]。脊髓損傷等可以導致脊髓中運動神經元胞膜的KCC2表達下調,引起Cl-在細胞內聚集。研究發現脊髓KCC2表達變化與炎性痛或一些病理性疼痛相關[2-3]。大鼠嗎啡處理后,KCC2在脊髓的表達可明顯降低。基因治療是作為靶向性的生物基因治療方法,其具有較強的靶向性。用編碼人類神經營養因子3腺相關病毒(AAV-NT3)治療脊髓T9段受傷的大鼠,AAV-NT3基因治療同運動結合減緩脊髓損傷后肌肉痙攣[4]。通過在脊髓鞘內注射病毒包裝的KCC2,從而在脊髓過表達KCC2,從而有效緩解神經損傷導致的疼痛過敏。脊髓過表達KCC2后是否對嗎啡耐受產生影響及相關機制尚未有研究[5]。本研究通過大鼠脊髓鞘內遞送KCC2,使其在脊髓過表達,檢測相關通路蛋白表達,探討KCC2過表達延緩嗎啡耐受的相關機制。
1 材料與方法
1.1 材料
DMEM培養基和胎牛血清(Gibco),invitrogen lipofectamine 2000 轉染試劑盒(Invitrogen),苯巴比妥鈉(上海上藥新亞藥業有限公司),嗎啡(東北制藥集團沈陽第一制藥有限公司),250-300g雄性SD大鼠(浙江省實驗動物中心),KCC2抗體、NMDAR抗體和PKC抗體(Cell signaling technology)。
1.2 方法
1.2.1 過表達腺病毒載體構建,轉染細胞:構建腺病毒載體后,將對數生長期的293T細胞制成細胞懸液,計數,接種接種于24孔培養板(細胞數為2×104)37℃、5%CO2培養箱培養至細胞融合度達到約80%。根據invitrogen lipofectamine 2000轉染試劑使用說明,加入適量質粒和轉染試劑。6 h后觀察細胞狀態,更換為新鮮的完全培養基。轉染24~48 h后觀察質粒上熒光標記基因的表達情況。
1.2.2 腺病毒感染后的表達檢測:取不同劑量腺病毒原液,加入到HEK293細胞中,24~48小時后觀察細胞生長情況,收集細胞、提取蛋白,供western blot檢測實驗使用。
1.2.3 實驗分組及脊髓插管模型制備:30只SD雄性大鼠隨機分為三組,Ⅰ組為KCC2基因治療組,Ⅱ組為GFP對照組,Ⅲ組為空白對照組,每組大鼠為10只。戊巴比妥鈉(4 mg/100g)腹腔注射,待麻醉后固定四肢,消毒頸部去毛后,在兩耳中線下分離肌肉到寰枕后膜,針頭挑破后,見腦脊液。PE-10導管經寰枕后膜插入至脊髓腰椎膨大部止,PE-10管體外部分用石蠟封口,防止腦脊液流出。Ⅰ組大鼠鞘內注射病毒上清液(108/ml)20μL,Ⅱ組鞘內注射control vector20μL,Ⅲ組鞘內注射生理鹽水20μL。2周后,各組通過脊髓置管嗎啡,每日2次。嗎啡注射量為15 ug/kg,連續7 d。
1.2.4 Western檢測脊髓KCC2、NMDAR和PKC表達:取各組大鼠4只,苯巴比妥鈉經腹腔注射麻醉,冰上迅速分離脊髓,取脊髓L4/5段,超聲破碎脊髓,常規方法提取組織蛋白;SDS-PAGE凝膠電泳后,蛋白轉移到PVDF膜上(100 V,120 min),5%脫脂牛奶封閉1 h,孵育一抗(KCC2)兔抗,4℃過夜,TBST洗一抗(5 min/次,3次),孵育二抗(羊抗兔,37℃,2 h),TBST洗二抗(5 min/次,4次),ECL試劑盒曝光顯色。
1.3 統計學處理
統計學分析用SPSS 19.0軟件進行,正態分布的計量資料用均數±標準差(±s)表示,結果用t檢驗,P<0.05為差異有統計學意義。
2 結 果
轉染24~48 h后觀察質粒上熒光標記基因的表達情況,熒光率大于80%。見圖1,圖2。

圖1 15 ul(100×)
圖2 30 ul(100×)
取不同劑量腺病毒原液,加入到HEK293細胞中,24~48小時后觀察細胞生長情況,收集細胞、提取蛋白,western blot檢測。用Flag抗體檢測到130-180KD之間存在特異性條帶,KCC2基因融合蛋白大小:127 KDa。見圖3。

圖3
KCC2腺病毒包裝KCC2基因鞘內注射2周后,western blot檢測,脊髓KCC2表達明顯升高。見圖4。

圖4
嗎啡處理后,KCC2基因脊髓鞘內注射組,western blot檢測,NMDAR表達下降。見圖5。

圖5
嗎啡處理后,KCC2基因脊髓鞘內注射組,western blot檢測PKC表達下降。見圖6。
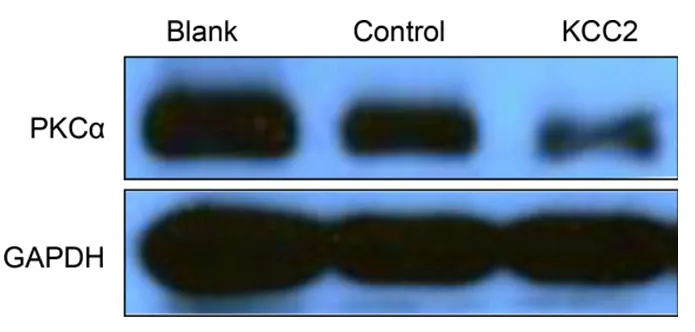
圖6
3 討 論
研究發現,通過脊髓鞘內注入慢病毒包裝的KCC2,在脊髓過表達KCC2后,可以恢復神經損傷而影響的Cl-穩態,恢復Cl-穩態抑制由于神經損傷導致的脊髓NMDAR活化,從而有效緩解神經損傷導致的疼痛過敏[5]。脊髓過表達KCC2后是否對嗎啡耐受產生影響的研究,可以有效聯系疼痛過敏與嗎啡耐受,具有現實意義。興奮型氨基酸(Excitatory amino acid,EAA)是中樞神經系統重要的神經遞質,NMDAR是一種EAA受體,由不同亞單位組成四聚體或五聚體,NMDAR通常高表達在嗎啡耐受中,NMDAR參與了脊髓鞘內嗎啡耐受中的作用,NMDAR參與嗎啡耐受的過程與胞內胞漿Ca2+釋放及PKC激活有關,并對G蛋白的表達產生一定的影響,Ca2+激活PKC、PKA及CaMKII等。有研究表明抑制PKC或其他蛋白激酶的激活能夠延緩或減輕大鼠因重復給藥導致的嗎啡耐受和依賴[6-7]。阿米替林可以通過PSD-95/NMDAR /nNOS/PKC通路緩解嗎啡耐受,表現為突觸NMDAR的表達下調,抑制PKC的表達[8]。嗎啡耐受過程中NMDAR活化,故通過KCC2基因脊髓鞘內注射,在脊髓過表達KCC2來抑制嗎啡耐受中NMDAR的活化。本研究發現,KCC2過表達后進行嗎啡耐受處理,NMDAR和PKC表達下調,初步說明NMDAR和PKC參與KCC2過表達后的嗎啡耐受調節,其更深的機制,還需進一步探討。

