新型鐵鈰復合氧化物催化臭氧氧化工藝去除對硝基苯酚
靳志豪,黃遠星,付小潔,胡守訓,楊俊豪,余 柳
(上海理工大學環境與建筑學院,上海 200093)
對硝基苯酚(4-硝基酚,p-nitrophenol,4-NP)是一種重要的有機合成原料,其應用范圍涉及醫學、農業、工業產品等許多領域[1]。作為一種典型的內分泌干擾物,4-NP進入生物體后會造成激素分泌失衡,影響生物正常的新陳代謝,其對水環境的影響程度也越來越高[2-3]。此外,作為醫藥和染料工業的重要中間體,4-NP具有難降解、毒性大等特點。美國環境保護局(EPA)已經將其列為水體中的優先污染物[4],同時它也是我國飲用水水質標準中的污染物控制指標之一[5]。目前,文獻中報道過的去除4-NP的方法主要有氧化還原法[6]、生物降解法[7]、吸附法[8]、光催化法[9]等。
臭氧具有極強的氧化能力,不僅在消毒滅菌、除臭等方面具有顯著優勢,同時對于難降解有機廢水具有極強的氧化降解能力[10]。臭氧易攻擊有機物中的不飽和鍵,但與飽和有機物的反應速率較低,且難以將有機物徹底礦化成二氧化碳和水。催化臭氧法利用特定催化劑催化臭氧分解,產生具有極強氧化能力、無選擇性的羥基自由基,從而快速將有機物徹底氧化,被廣泛用于水中難降解有機污染物的深度去除中[11]。目前,催化臭氧技術主要是均相催化臭氧和非相催化臭氧。在反應體系中,常用到的均相催化劑一般為過渡金屬離子,有Fe2+、Mn2+、Ni2+、Co2+、Cd2+、Cu2+、Ag+等。非均相催化劑制備過程簡單,較易回收,且催化劑的催化活性很高,成本較低,較均相催化臭氧技術而言,具有明顯的優勢。金屬氧化物可以作為非均相催化臭氧氧化的主要催化劑。常見的金屬氧化物有TiO2、MnO2、Al2O3、ZnO及鐵氧物等。其中,鐵基材料由于毒性低、來源廣、成本低及高穩定性等優點,涉及到眾多領域。
本文采用水熱法制備鐵鈰復合氧化物,并將之作為催化劑,催化臭氧氧化去除水中的4-NP,目的在于提高4-NP的礦化率,通過改變試驗條件,以期研究臭氧濃度、催化劑投加量、初始pH、不同鐵鈰摩爾比對水中4-NP去除效果的影響,為含4-NP實際廢水的處理提供理論基礎。
1 材料及方法
1.1 材料及儀器
儀器:臭氧發生器(KX-S10型,上海康孝環保設備有限公司),馬弗爐(SX2-4-13 N型,上海一恒科學儀器有限公司),總有機碳/總氮(TOC/TN)測定儀(Muliti N/C 3100型,德國耶拿公司),X射線衍射儀(D8 Advance 型,德國布魯克公司),電子天平(PL-203型,梅特勒-托利多公司),真空干燥箱(DZF-6020型,上海一恒科學儀器有限公司),離子計(PXSJ-226型,上海儀電科學儀器股份有限公司)。
對硝基苯酚(4-NP,>99.0%),其他化學試劑[如Ce(NO3)3·6H2O、Fe(NO3)3·9H2O等]均為分析純,購自國藥集團化學試劑有限公司。
1.2 復合氧化物的制備
選用水熱法制備復合氧化物,將所稱得一定量的Ce(NO3)3·6H2O和Fe(NO3)3·9H2O溶于去離子水中,攪拌均勻后得到不同摩爾比的金屬鹽溶液。然后,將配好的溶液置于磁力攪拌器上,緩慢滴入5 mol/L的氨水,保持體系pH值在10左右。穩定后,將60 mL混合溶液轉移到100 mL不銹鋼高壓釜中,180 ℃條件下反應48 h。冷卻后,用蒸餾水洗滌樣品數次至中性,并將復合氧化物在烘箱中烘干。最后,在500 ℃煅燒10 h,即可得到所需紅色Fe2O3/CeO2復合氧化物。
1.3 臭氧試驗
在室溫下,試驗反應溶液總體積為1.0 L,將0.8 g 4-NP溶于去離子水中,然后將溶解的4-NP溶液定溶于1 L的容量瓶中作為4-NP儲備液,使用時按需求稀釋相應的倍數。向初始濃度為20 mg/L的4-NP溶液中投加1.0 g的催化劑,打開臭氧發生器,由曝氣頭向反應溶液中通入臭氧/空氣混合氣體,并立即計時。臭氧氣體流量可通過分流裝置調節,以調節具體每個試驗的臭氧投加量,溶液中的臭氧濃度采用靛藍法檢測[12]。然后,設置不同鐵鈰摩爾比催化臭氧氧化與單獨臭氧氧化進行對比,確定最優鐵鈰摩爾比。通過控制變量法,改變試驗條件,進行催化臭氧氧化4-NP的試驗。每個反應過程持續60 min,分別在0、10、20、40、60 min取樣。通入惰性氣體吹脫水樣中的臭氧后,經0.45 μm濾膜過濾去除固體催化劑,隨即利用TOC分析儀測定水樣TOC。所有試驗均重復3次,最終數據取3次試驗的平均值。表1為催化臭氧試驗不同條件參數。

表1 催化臭氧試驗不同條件參數Tab.1 Different Conditional Parameters of Catalytic Ozonation Test
2 結果與討論
2.1 催化劑的XRD表征
圖1是在相同條件下改變鐵鈰摩爾比合成的鐵鈰復合氧化物的X射線衍射圖。由圖1可知,所合成的材料衍射峰分別在2θ=24.1°、33.1°、35.6°、49.4°和54.0°以及在2θ=28.5°、33.0°與標準卡片Fe2O3(JCPDS No.33-0664)、CeO2(JCPDS No.34-0394)的X射線衍射圖相吻合,說明合成的材料均是鐵鈰復合氧化物,且無其他雜峰的出現,即水熱法制備的復合氧化物純度較高。
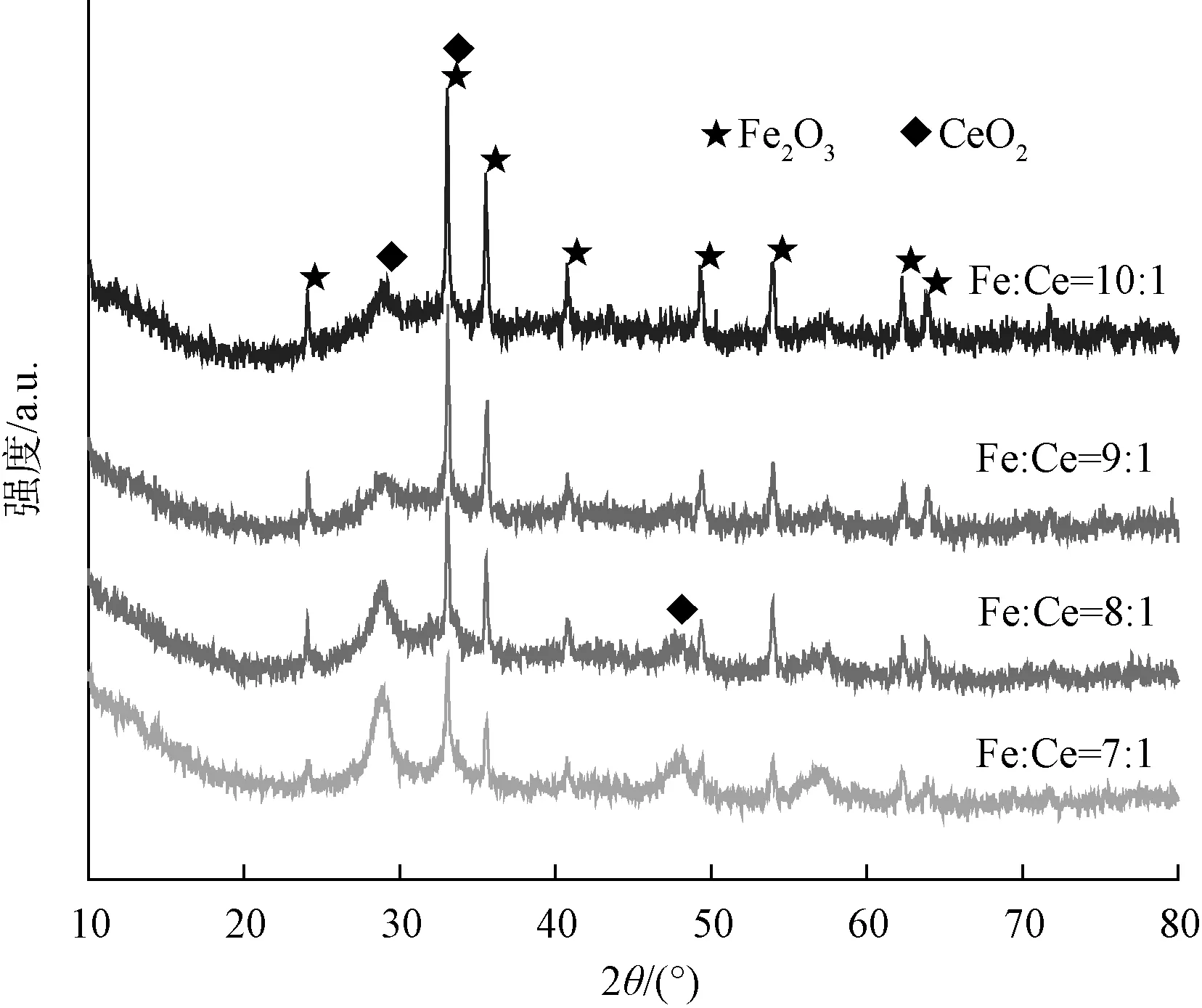
圖1 鐵鈰復合氧化物的XRD圖Fig.1 XRD Pattern of Fe-Ce Composite Oxide
2.2 不同催化臭氧氧化反應體系對4-NP去除效果的影響
在表1中①的試驗條件下,研究復合氧化物吸附、單獨臭氧氧化、氧化鐵催化臭氧氧化(O3/Fe2O3)以及復合氧化物催化臭氧氧化(O3/Fe2O3/CeO2)4種反應體系對4-NP去除效果的影響。
如圖2(a)所示,復合氧化物在60 min內對4-NP的吸附幾乎無作用,此結果與Fe2O3/CeO2(7∶3)的表面性質相關。陳忠林等[13]的研究表明,催化劑表面的羥基基團易與親電性的有機物吸附。然而,在未通入臭氧的情況下,催化劑表面無羥基基團和合適的吸附位點,其對4-NP幾乎無吸附和降解作用。其余3種體系對4-NP的去除具有明顯的效果。反應60 min內,單獨臭氧氧化體系中,TOC的去除率為54.0%。在氧化鐵催化臭氧氧化(O3/Fe2O3)體系下反應60 min,TOC的去除率為66.7%。在復合氧化物催化臭氧氧化體系下,TOC的去除率提高到了81.3%,比O3/Fe2O3體系時增加了14.6%。如圖2(b)所示,不同摩爾比復合氧化物的降解曲線可通過一級動力學反應模型擬合出來。單獨臭氧氧化、氧化鐵催化臭氧氧化以及復合氧化物催化臭氧氧化反應體系下對應的降解曲線的反應速率常數分別為0.013、0.015、0.024 min-1。復合氧化物催化臭氧氧化體系對4-NP的去除具有很好的效果,Fe2O3/CeO2(7∶3)的加入明顯提高了對4-NP的降解率。研究表明[14],在催化臭氧氧化反應體系下,復合氧化物加入后,臭氧在催化劑表面生成了強氧化性的羥基自由基(·OH),臭氧的利用效率明顯提高,生成了更多的·OH。在反應40 min之后,降解效率趨于平緩,說明并不能將水中的有機物完全降解為水和二氧化碳,而是小部分有機物轉變成了中間產物。

圖2 不同催化臭氧氧化反應體系對4-NP去除效果的影響(a)及一級動力學反應速率常數(b)Fig.2 Effects of Different Catalytic Ozonation Reaction Systems on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
2.3 不同鐵鈰摩爾比對催化效果的影響
通過改變鐵鹽和鈰鹽的摩爾配比,合成Fe∶Ce為7∶3、8∶2、9∶1、10∶1這4種不同金屬摩爾配比復合氧化物。在表1中②的試驗條件下,分析比較4種不同摩爾比氧化物對4-NP去除效果的影響。
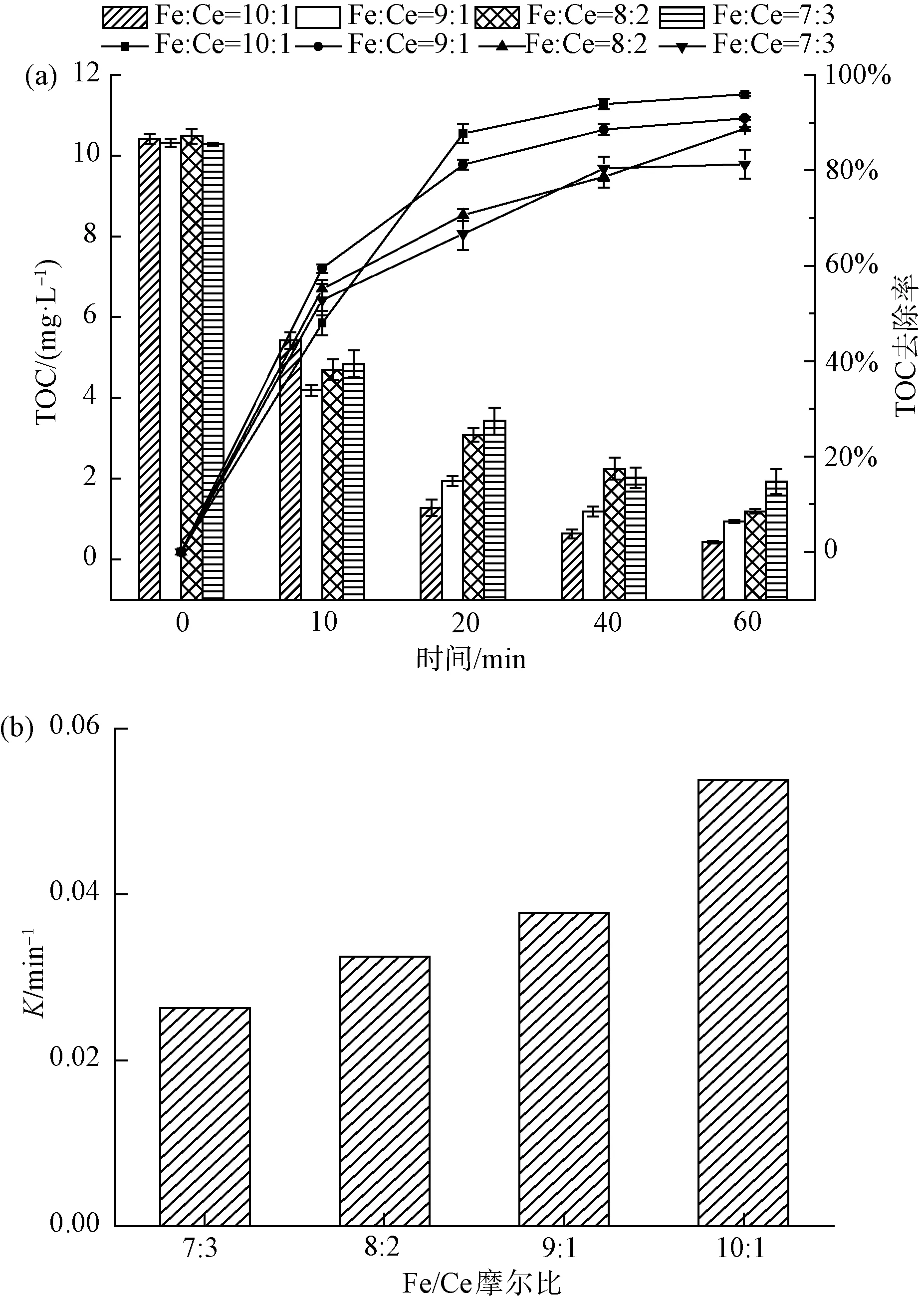
圖3 不同鐵鈰摩爾比對4-NP去除效果的影響(a)及一級動力學反應速率常數(b)Fig.3 Effects of Different Fe-Ce Molar Ratios on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
如圖3(a)所示,隨著鐵鈰摩爾比的增加,4種復合氧化物對4-NP去除率也逐漸增加。其中,在催化臭氧氧化體系下反應60 min,當Fe∶Ce=7∶3時,TOC的去除率為81.3%;當Fe∶Ce=8∶2時,TOC的去除率為88.7%;當Fe∶Ce=9∶1時,TOC的去除率為90.9%;當Fe∶Ce=10∶1時,TOC的去除率提高到最大,為95.9%。此外,如圖3(b)所示,不同摩爾比復合氧化物的降解曲線可通過一級動力學反應模型擬合出來,當Fe∶Ce為7∶3、8∶2、9∶1、10∶1時,降解曲線的反應速率常數分別為0.026、0.033、0.038、0.054 min-1,反應速率隨著鐵鈰摩爾比的增加而加快。Li等[15]的研究表明,在一定范圍內鐵鈰摩爾比增加,CeO2很好地分散在Fe2O3上,2種氧化物之間形成了很強的相互作用,在催化臭氧過程中,導致催化劑表面活性位點的增加,能吸附更多的臭氧,從而在催化臭氧過程中產生更多的·OH。綜合表明,鐵鈰復合氧化物催化臭氧氧化效果與鐵鈰摩爾比有關,鐵鈰摩爾比為10∶1時的去除效果最佳。選用此比例復合氧化物作為催化劑進行后續試驗。
2.4 水中臭氧濃度對4-NP去除效果的影響
在表1中③的試驗條件下,選用Fe2O3/CeO2(10∶1)作為催化劑,改變通入水中的臭氧投加量,測得水中臭氧濃度分別為4.1、5.4、7.0 mg/L,分析比較水中臭氧濃度對4-NP去除效果的影響。

圖4 水中臭氧濃度對4-NP去除效果的影響(a)及一級動力學反應速率常數(b)Fig.4 Effects of Ozone Concentration on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
2.5 水中初始pH對4-NP去除效果的影響
在表1中④的試驗條件下,選用Fe2O3/CeO2(10∶1)作為催化劑,調節水中初始pH值為5.0、7.0、9.0,分析比較水中初始pH對4-NP去除效果的影響。
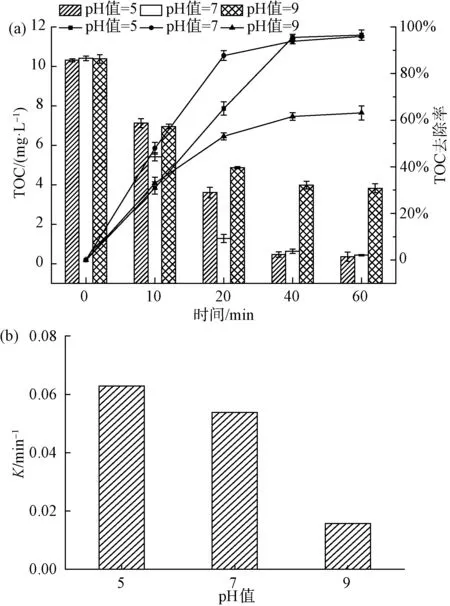
圖5 水中初始pH對4-NP去除效果的影響(a)及一級動力學反應速率常數(b)Fig.5 Effects of Initial pH Value on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
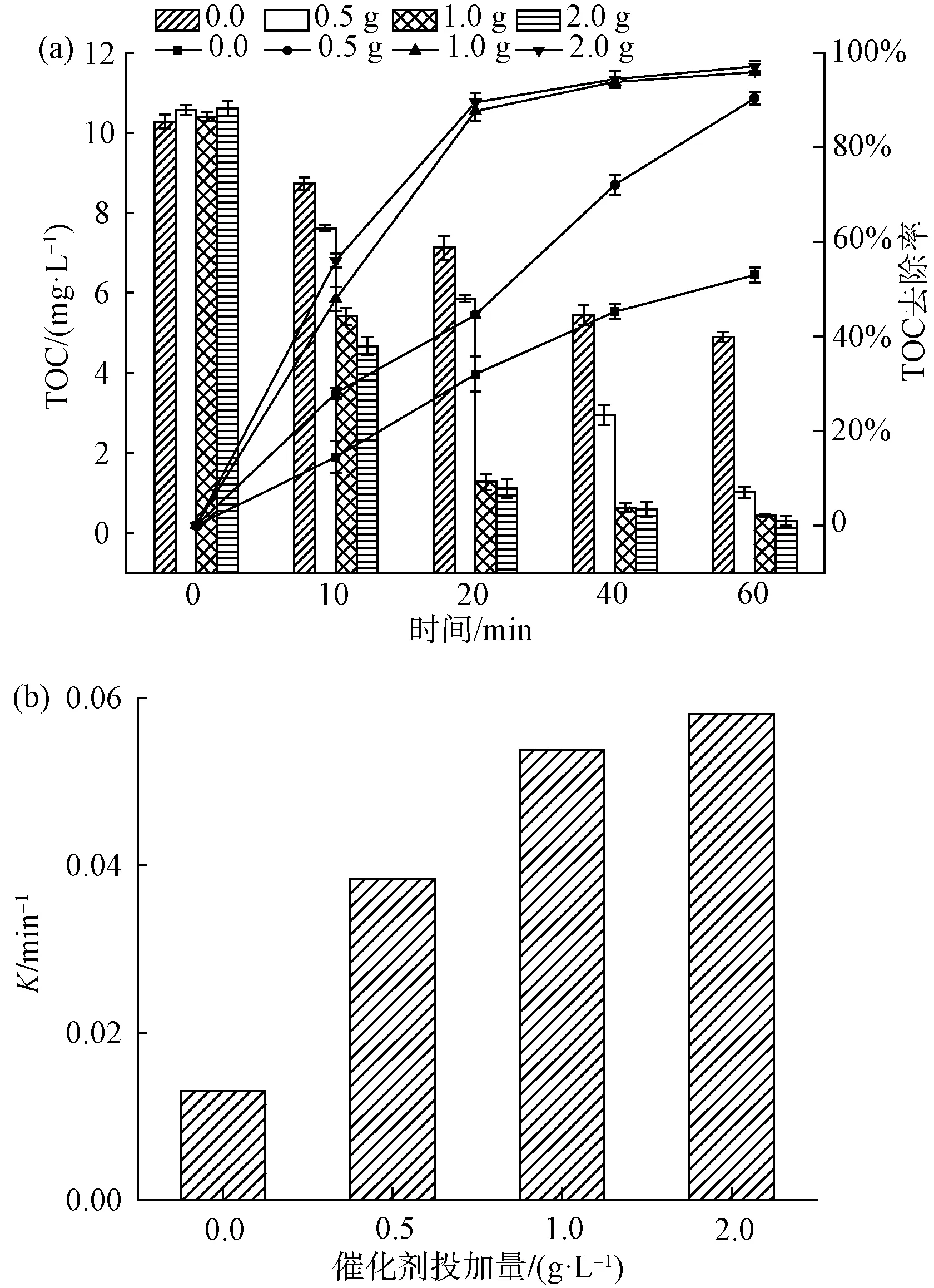
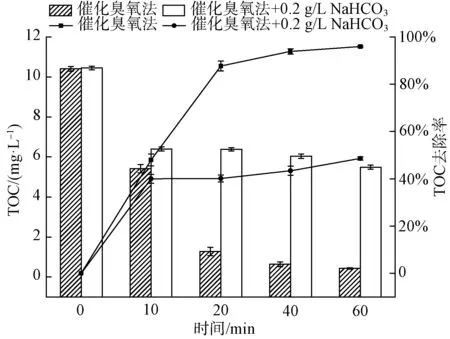
如圖5(a)所示,當水中初始pH值為9.0時,TOC的去除率為63.1%;當水中初始pH值為5.0時,TOC的去除率提高到96.6%,與水中初始pH值為7.0時TOC的去除率(95.9%)相差甚小。如圖5(b)所示,當pH值為5、7、9時,降解曲線的反應速率常數分別為0.063、0.054、0.016 min-1。研究表明[18],催化臭氧氧化體系受到催化劑表面的等電點以及臭氧氧化體系中發生的反應的影響。試驗采用質量滴定法測得的催化劑等電點pHpzc=6.9[19],在pH接近pHpzc時,催化劑表現出最好的效果。在堿性條件下,當催化劑投加量不變時,Lewis酸性位點上的表面羥基基團數量不變。反應溶液pH升高,則OH-增加,競爭吸附于活性位點上,導致表面羥基基團減少,溶液中產生的·OH數量減少,最終使催化降解4-NP的效率降低,這與前面研究的pHpzc機理一致[20]。酸性條件下降解效果顯著,原因可能是pH 在表1中⑤的試驗條件下,選用Fe2O3/CeO2(10∶1)作為催化劑,改變催化劑的投加劑量,分析比較催化劑投加量對4-NP去除效果的影響。 如圖6(a)所示,不投加催化劑,在催化臭氧氧化體系下反應60 min,TOC的去除率為53.0%;當催化劑的投加量為0.5 g/L時,TOC的去除率為90.4%;當催化劑的投加量分別為1.0 g/L和2.0 g/L時,對應的TOC的去除率為95.9%、97.2%,2種催化劑投加量下,去除率幾乎無差異,4-NP基本降解完全。Yu等[21]的研究表明,采用MIL-88 A(Fe)催化臭氧化,對TOC去除率為38.7%,而本試驗對TOC的去除率達到近97.2%,表明鐵鈰復合金屬氧化物催化劑對4-NP的去除有較強的效果。由圖6(b)可知,催化劑投加量為0.0、0.5、1.0、2.0 g/L所對應的降解曲線反應速率常數分別為0.013、0.038、0.054、0.058 1 min-1。陳煒彧等[22]的研究表明,催化劑的催化效果隨著催化劑的增加而增加,其主要原因是在催化臭氧氧化過程中,隨著Fe2O3/CeO2(10∶1)催化劑投加量的增加,催化劑濃度增加,催化劑表面為臭氧分子提供了更多的活性位點,產生的·OH也隨之增加,從而提高了4-NP的去除效果。當催化劑投加量提高至2.0 g/L時,TOC去除率的增加趨于平緩,與投加1.0 g/L催化劑相比,反應速率常數僅提高了0.004 3 min-1。一方面可能是由于過量的催化劑導致自身發生復合作用,臭氧分子與催化劑表面的活性位點接觸減少;另一方面,催化臭氧體系產生過量的·OH,導致其自身發生反應,從而降低體系中·OH的濃度。因此,出于TOC去除率以及經濟成本的考慮,后續試驗催化劑的最佳投加量為1.0 g/L。 圖6 催化劑投加量對4-NP去除效果的影響(a)及一級動力學反應速率常數(b)Fig.6 Effects of Catalyst Dosage on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b) Bai等[23]的研究表明,NaHCO3是一種強堿弱酸鹽,作為·OH抑制劑,可以有效消耗催化臭氧氧化過程中產生的自由基,且NaHCO3不與臭氧發生反應。因此,在催化臭氧體系中添加NaHCO3,利用其與有機物的競爭反應,來驗證催化臭氧過程中·OH 的作用。 圖7 NaHCO3對4-NP去除效果的影響Fig.7 Effect of NaHCO3 on 4-NP Removal ·OH的濃度對去除污染物具有決定性的意義。因此,加入DMSO自由基捕集劑和2,4-二硝基苯肼制得DNPH-HCHO,通過HPLC間接測量·OH的濃度[24]。在實驗室條件下,DMSO濃度為250 mmol/L、催化劑投加量為1.0 g/L、臭氧濃度為7.0 mg/L、初始pH值為7.0時,單獨臭氧與催化劑催化臭氧,·OH生成量如圖8所示。 圖8 ·OH的累積量Fig.8 Accumulative Amount of Hydroxyl Radical 在單獨臭氧體系中反應60 min,·OH的累計生成量為13.34 μmol,這是由于臭氧在水中分解產生少量的·OH。催化劑催化臭氧體系中反應60 min,·OH的累計生成量為22.8 μmol。TOC降解曲線也相對應地出現了明顯的差異,間接證實了催化臭氧產生的·OH進一步礦化有機物,導致TOC降解效率的提高。 本文采用水熱法制備的新型鐵鈰復合氧化物作為催化劑,對催化臭氧氧化去除4-NP進行了試驗研究,得出以下主要結論。 (1)在探究不同反應體系對4-NP去除效果的過程中,發現催化臭氧體系去除4-NP效率顯著高于吸附和單獨臭氧氧化法,且鐵鈰復合氧化物催化效率遠高于單獨的氧化鐵。 (2)在本文研究的條件范圍內,隨著鐵鈰摩爾比的增加,復合氧化物催化臭氧氧化法對4-NP的去除率逐漸增大。 (3)以Fe2O3/CeO2(10∶1)為催化劑的催化臭氧氧化體系對4-NP有很好的去除率。4-NP的去除率受到鐵鈰摩爾比、臭氧濃度、催化劑投加量和體系初始pH的影響。試驗表明,在一定范圍內,4-NP去除率隨著鐵鈰摩爾比、臭氧濃度和催化劑投加量的增加而提高。 (4)最佳組合工藝條件:鐵鈰摩爾比為10∶1,臭氧濃度為7.0 mg/L,催化劑投加量為1 g/L,初始pH值為7.0。催化劑在重復使用5次后,去除率仍維持在92.1%,所制備的催化劑未出現鈍化現象,具有較好的穩定性。 (5)鐵鈰復合氧化物催化臭氧體系中加入自由基抑制劑NaHCO3后,4-NP去除率顯著降低,說明·OH在催化臭氧氧化4-NP過程中起主導作用。另外,間接檢測了催化臭氧過程中·OH濃度的變化,使得試驗結果更具說服力。2.6 催化劑投加量對4-NP去除效果的影響
2.7 添加抑制劑對4-NP去除效果的影響

2.8 催化臭氧過程中·OH濃度變化

3 結論

