溫陽利水方對陽離子化牛血清白蛋白致膜性腎病大鼠足細胞的保護作用
魯歡, 張禮財, 宋超, 肖珊珊, 湯水福, 陳剛毅, 吳興波, 羅月中
(廣州中醫藥大學第一附屬醫院,廣東廣州 510405)
膜性腎病(membranous nephropathy,MN)是一類自身免疫性疾病[1],其中,原發性膜性腎病(primary membranous nephropathy,pMN)是成人腎病綜合征最常見的病理類型[2]。近10余年來,pMN的發病機制研究獲得重大突破,M 型磷脂酶A2 受體(M-type phospholipase A2 receptor,PLA2R)和Ⅰ型血小板反應蛋白相關域7A作為pMN的主要靶抗原,廣泛應用于臨床,對應的抗體檢測不僅有助于與繼發性MN相鑒別,還能預測疾病的發展趨勢和治療轉歸。然而,由于靶抗原的致病機制仍未完全闡明,治療方案較前并無明顯變化。近年來自全國范圍的MN 流行病學研究發現,我國MN 患病率呈明顯上升趨勢,且在我國北方和東北,MN的患病率在2014 年以后已經超過了IgA 腎病,位居原發性腎小球病的首位[3-4]。因此,探索預防和治療MN的有效手段具有重要意義。本課題組前期研究結果提示MN與脾腎陽虛相關,臨床上使用溫陽利水方療效確切,離體實驗證實溫陽利水方水提物可改善脾腎陽虛特發性膜性腎病(IMN)患者血清致小鼠足細胞骨架蛋白F-actin 重排,調節p53和Bcl-2的表達,緩解足細胞損傷[5-7]。
本研究擬構建陽離子化牛血清白蛋白(cationic bovine serum albumin,C-BSA)MN大鼠模型,用溫陽利水方灌胃干預,進一步驗證和探索溫陽利水方的在體療效和機制,現將研究結果報道如下。
1 材料
1. 1實驗動物雄性SD 大鼠(180 ± 20)g,購自廣州中醫藥大學實驗動物中心[合格證號:SCXK(粵)2013-0034]。7 d 檢疫期后,轉入飼養間,開始實驗。動物實驗方案已通過廣州中醫藥大學第一附屬醫院倫理委員會審核(ZYYECK 【2018】047),并遵循《赫爾辛基宣言》。
1. 2實驗細胞MPC5 小鼠足細胞系,由美國Baylor醫學院Danesh教授惠贈,廣東省人民醫院史偉教授轉贈。
1.3藥物溫陽利水方組成:制附子15 g,黃芪30 g,白術45 g,白芍30 g,茯苓30 g,生姜15 g。貝那普利(諾華集團,批號:X2606)。以上藥物均購自廣州中醫藥大學第一附屬醫院。
1.4試劑與儀器RPMI-1640 培養基、Ⅰ型鼠尾膠原(美國Corning 公司);澳洲胎牛血清、0.5 g/L胰蛋白酶(美國Gibco 公司);重組小鼠干擾素γ(IFN-γ)(以色列ProSpec 公司);磷酸鹽緩沖液(PBS)、青-鏈霉素溶液(美國Hyclone 公司); 細胞計數試劑盒8(CCK-8)(日本Dojindo 公司);腎足蛋白(nephrin)檢測試劑盒(酶聯免疫吸附法)(武漢優爾生商貿有限公司,貨號:SEA937Ra);PCR Forward Prime、PCR Reverse Prime(美國Invitrogen公司);RNA Extraction Kit、Prime ScriptTMRT Master Mix、SYBR?Premix Ex TaqTMⅡ(日本TaKaRa 公司)。CO2培養箱(美國Shellab 公司);高速冷凍離心機(美國Sigma公司);多功能酶標儀、微量檢測板(美國Thermo Scientific 公司);電子細胞計數儀、計數板、T-100 regular PCR儀、實時熒光定量PCR 儀(美國Bio-Rad 公司);自動生化分析儀(瑞典Roche 公司);光學顯微鏡(日本Olympus 公司);倒置熒光顯微鏡(德國Leica 公司);JEM-1400 PLUS 電子透射電子顯微鏡(日本電子株式會社)。
2 方法
2.1細胞培養MPC5 小鼠足細胞復蘇后,在體積分數5%CO2、33 ℃培養箱中誘導增殖4~5 d。待細胞生長融合至80%~85%,使用0.5 g/L胰蛋白酶消化后,傳代至包被Ⅰ型鼠尾膠原的培養皿中,再轉入體積分數5%CO2、37 ℃培養箱,誘導分化8~14 d,分化成熟后可進行后續實驗。具體步驟參見文獻[8]。
2.2溫陽利水方水提物的制備加6 倍量超純水分別浸泡制附子及其余藥物30 min,制附子先煎1 h,再加入其余藥物及浸泡液共煎,收集濾液。加4倍量超純水再次煎煮,收集濾液。合并2次濾液,反復過濾除渣,以8 000 r/min 離心5 min,過濾,以80 ℃減壓,濾液濃縮至浸膏,超純水定容至165 mL。過針頭濾器, 除顆粒雜質、滅菌。于-20 ℃保存備用。具體步驟參見文獻[6]。
2. 3溫陽利水方含藥血清的制備將SD 大鼠48 只隨機分為4 組,即對照組和溫陽利水方低、中、高濃度組。其中,每組大鼠再隨機分為3 組,分別命名為3 d、5 d和7 d組。根據“人和動物體表面積折算的等效劑量比率表”,以臨床劑量換算大鼠用藥劑量,折算系數為6.3,溫陽利水方低、中、高濃度組分別按劑量8.25、16.50、33.00 g·kg-1·d-1灌胃。對照組則給予等體積蒸餾水灌胃。各組將每日劑量等分,于9∶00和16∶00分別灌胃1次,按照時間組別依次連續灌胃3 d、5 d 和7 d。灌胃結束后,以100 g/L 水合氯醛麻醉大鼠,腹主動脈采血,以3 000 r/min,4 ℃離心15 min 分離血清,混合同組血清。以0.22 μm微孔濾膜過濾除菌,56 ℃恒溫水浴滅活30 min,于-80 ℃冰箱存儲備用。
2. 4 CCK-8篩選溫陽利水方水提物灌胃濃度和時間取分化成熟的P22 足細胞,同步化24 h 后,以0.5 g/L胰蛋白酶消化成單細胞懸液,以8 000個細胞/孔的密度接種于96孔板,加含體積分數10%胎牛血清的RPMI-1640培養基至100 μL。培養24 h后,換液。分別設對照組,溫陽利水方低、中、高濃度組,每組內再設3 d、5 d 和7 d 組。按照分組,每孔加入提前配制的含體積分數10%對照組大鼠血清或溫陽利水方含藥血清的培養基100 μL,每組設5 個復孔。培養20 h 后,每孔加CCK-8 10 μL,共孵育4 h,使用酶標儀測定450 nm 處吸光度(OD)。將不含細胞的完全培養基空白孔調零。
2.5 MN大鼠模型構建、分組和干預經過檢疫期后,將大鼠置于代謝籠內,留取尿液測定24 h尿蛋白定量(UTP),符合標準者,進入正式實驗。實驗分為4組,分別為對照組、模型組、溫陽利水方組、貝那普利組,每組6只大鼠。模型組、溫陽利水方組、貝那普利組大鼠采用C-BSA 尾靜脈注射4 周構建MN 模型[9],同期,對照組大鼠給予等量生理鹽水尾靜脈注射。造模成功后,對照組和模型組:給予雙蒸水灌胃,2.5 mL/次,每日2次,連續4周;溫陽利水方組:根據CCK-8篩選結果,按照16.50 g·kg-1·d-1劑量灌胃,雙蒸水稀釋,2.5 mL/次,每日2 次,連續4 周;貝那普利組:按照10.00 mg·kg-1·d-1劑量灌胃,雙蒸水稀釋,2.5 mL/次,每日2次,連續4周。
2.6指標檢測
2.6.1 一般情況觀察 在開始灌胃后,觀察大鼠進食量、對灌胃的接納情況、毛發光澤度、小便量、大便質地。
2.6.2 血生化指標檢測 干預結束后,代謝籠收取24 h 尿液后,以100 g/L 水合氯醛麻醉大鼠,腹主動脈采血,分離血清。應用Cobas6000自動生化分析儀檢測尿素氮(BUN)、血肌酐(SCr)、總膽固醇(CHOL)、甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C),采用溴甲酚綠法檢測血清白蛋白(ALB),采用計算法測定血清球蛋白(GLO)。
2.6.3 UTP 檢測 在造模結束、灌胃第2 周和灌胃第4周,均使用代謝籠收取大鼠24 h尿液,采用化學比濁法檢測UTP水平。
2.6.4 腎臟病理檢測 干預結束后,以100 g/L水合氯醛麻醉大鼠,剖腹取右側腎臟,剝離腎包膜和非腎組織,生理鹽水沖洗,切塊,分別保存于光鏡固定液、電鏡固定液。光鏡標本:梯度脫水、浸蠟包埋,常規切片,分別行蘇木素-伊紅(HE)、馬松(Masson)、過碘酸六胺銀(PASM)染色后,在光鏡下觀察。電鏡標本:清洗、1%鋨酸固定、清洗、梯度脫水、樹脂滲透包埋、固化、切片、鈾鉛雙染色,電鏡下觀察。
2.6.5 實時定量聚合酶鏈反應(qRT-PCR)法檢測腎皮質nephrin mRNA表達 干預結束后,以100 g/L水合氯醛麻醉大鼠,剖腹取右側腎臟,剝離腎包膜和非腎組織,生理鹽水沖洗,切塊,分離腎皮質,保存于液氮罐中。按照試劑盒操作說明提取腎皮質總RNA,測定其在230、260、280、320 nm處的OD 值,并計算濃度。取適量總RNA 行變性瓊脂糖凝膠電泳,檢測總RNA 的完整性。取符合條件的總RNA 溶液,按照操作說明,配制20 μL體系行逆轉錄,配制25 μL 體系行擴增。反應條件:95 ℃預變性30 min、95 ℃變性5 s、60 ℃退火30 min,共進行40個循環。內參基因GAPDH上游引物序列為5’-CTCTACCCACGCCAAGTTCAA-3’,下游引物序列為5’-GGATGACCTTGCCCACAGC-3’;nephrin 上游引物序列為5’-CTGACTGGGCTG AAGCCTTCT-3’,下游引物序列為5’-AAGAGCA CAGGCAGCAGGGG-3’[10]。實驗重復3 次,每個樣本、每個基因均采用3個復孔,采用雙△Ct的方法計算目的基因表達量,結果以2-△△Ct表示。
2. 6. 6 酶聯免疫吸附法檢測尿液nephrin 蛋白含量 干預結束后,代謝籠收取大鼠24 h 尿液。以2 000×g離心15 min后收集上清液,置于-20 ℃冰箱中保存備用。使用nephrin檢測試劑盒(酶聯免疫吸附法)檢測大鼠尿液nephrin蛋白含量。按照試劑盒說明書,逐步操作。
2.7統計方法采用SPSS 17.0統計軟件進行數據分析。計量資料以均數±標準差(±s)或中位數表示,計數資料以相對數表示。2組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析。以P<0.05為差異有統計學意義。
3 結果
3.1 CCK-8法篩選溫陽利水方水提物灌胃濃度和時間的結果對照組與溫陽利水方低、中、高濃度組對應時間組比較,3 d 組差異均有統計學意義(P < 0.05),且對照組OD 值均較含藥血清組高,提示3 d含藥血清可能抑制足細胞增殖;5 d組中,中濃度組OD 值較對照組高,差異有統計學意義(P<0.05),其余2 組與對照組比較,差異無統計學意義(P>0.05),提示5 d中濃度組含藥血清可能促進足細胞增殖;7 d 組中,對照組OD 值均較含藥血清組高,且低、高濃度組與對照組比較,差異均有統計學意義(P < 0.05),提示7 d 含藥血清可能抑制足細胞增殖。故選取中濃度作為灌胃濃度,5 d 作為灌胃時間,用于后續實驗。具體結果見表1。
表1 不同濃度溫陽利水方含藥血清處理不同時間對足細胞增殖的影響(CCK-8法)Table 1 Effects of different contents of serumcontaining YDR treatment for different times on proliferation of podocytes(by CCK-8) (±s)
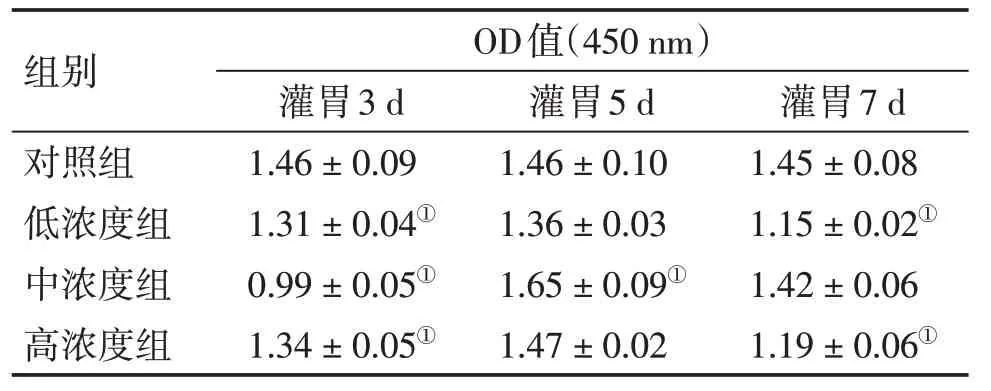
表1 不同濃度溫陽利水方含藥血清處理不同時間對足細胞增殖的影響(CCK-8法)Table 1 Effects of different contents of serumcontaining YDR treatment for different times on proliferation of podocytes(by CCK-8) (±s)
①P<0.05,與對照組比較
?
3.2 MN大鼠與對照組大鼠血生化指標比較造模結束后,MN 大鼠血清SCr、GLO、CHOL、TG、LDL-C 水平均明顯升高,除TG 外,與對照組比較,差異均有統計學意義(P<0.05);血清ALB 明顯下降,與對照組比較,差異有統計學意義(P <0.05)。具體結果見表2。
表2 造模后膜性腎病(MN)模型組與對照組大鼠血生化指標比較Table 2 Comparison of the biochemical indexes between MN model group and control group after modeling (±s)
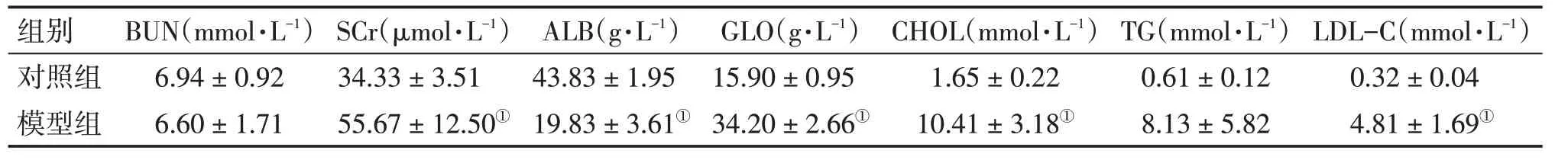
表2 造模后膜性腎病(MN)模型組與對照組大鼠血生化指標比較Table 2 Comparison of the biochemical indexes between MN model group and control group after modeling (±s)
①P<0.05,與對照組比較
?
3.3溫陽利水方對MN大鼠一般情況的影響與模型組比較,在4周的灌胃過程中,溫陽利水方組大鼠食欲增加、不抗拒灌胃、毛發有光澤且脫毛減少、小便量多、大便成形、水腫減輕。
3.4溫陽利水方對MN大鼠UTP的影響在造模結束后、灌胃2周和灌胃4周,分別檢測各組大鼠UTP水平。結果顯示:灌胃2周,溫陽利水方組和貝那普利組大鼠UTP 均明顯下降,但組間比較,差異無統計學意義(P>0.05);灌胃4 周,溫陽利水方組和貝那普利組大鼠UTP 繼續下降,組間比較,差異無統計學意義(P>0.05)。見圖1。
3.5溫陽利水方對MN大鼠腎組織病理的影響灌胃4周后,與模型組比較,溫陽利水方組和貝那普利組大鼠腎小球基底膜增厚減輕,嗜復紅蛋白沉積減少,足突變形和融合緩解,腎小管上皮細胞水腫改善,蛋白管型減少,腎間質炎癥細胞浸潤減輕。見圖2和圖3。
3.6溫陽利水方對MN大鼠腎皮質nephrin mRNA表達和尿液nephrin蛋白含量的影響灌胃4 周后,模型組大鼠腎皮質nephrin mRNA 相對表達量較對照組增加,差異有統計學意義(P<0.05);溫陽利水方組大鼠nephrin mRNA 相對表達量較模型組減少,差異無統計學意義(P>0.05);貝那普利組大鼠nephrin mRNA 相對表達量較模型組減少,差異有統計學意義(P < 0.05)。模型組大鼠尿液nephrin 蛋白含量較對照組增加,差異有統計學意義(P<0.05);溫陽利水方組和貝那普利組大鼠尿液nephrin 蛋白含量均較模型組減少,差異均有統計學意義(P<0.05),且2 個治療組比較,差異亦有統計學意義(P<0.05)。具體結果見表3。
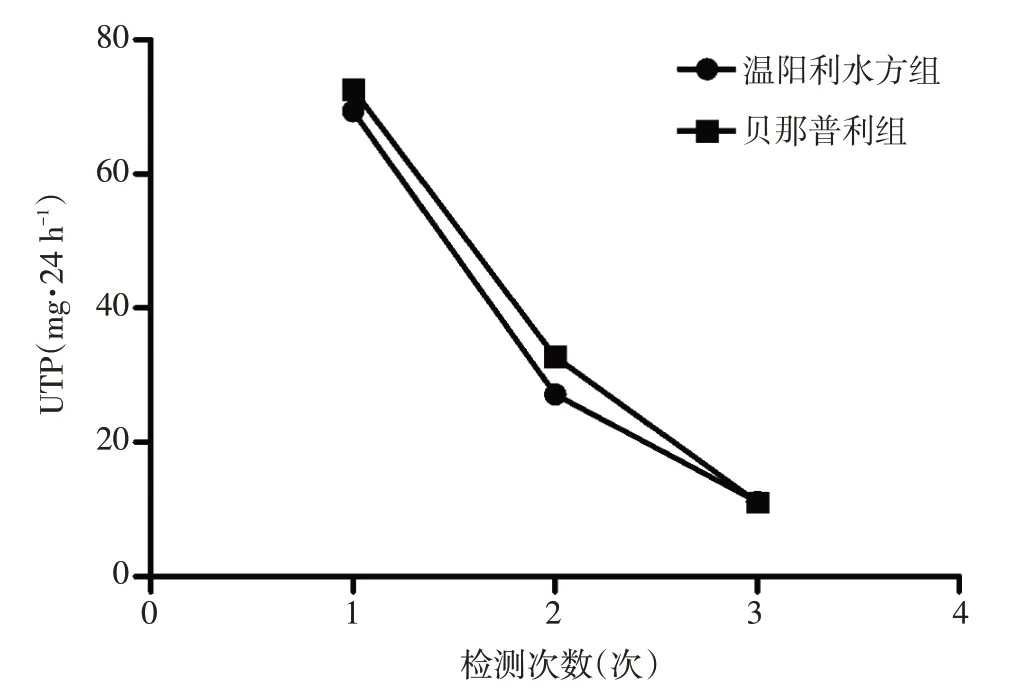
圖1 溫陽利水方組和貝那普利組大鼠UTP變化折線圖Figure 1 The line chart for UTP in YDR group and benazepril group
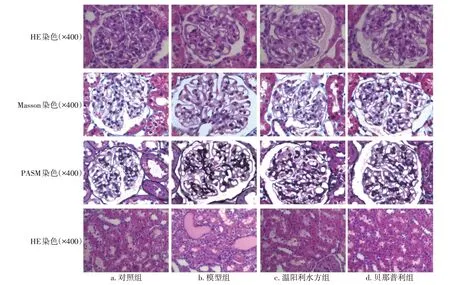
圖2 灌胃4周后各組大鼠腎組織病理光鏡圖Figure 2 Comparison of the renal histopathological features under light microscope in various groups after 4 weeks of intragastric administration
表3 灌胃4周后各組大鼠腎皮質nephrin mRNA和尿液nephrin蛋白檢測結果Table 3 Comparison of the expression levels of nephrin mRNA in renal cortex and nephrin protein in urine from rats in various groups after 4 weeks of intragastric administration (±s)
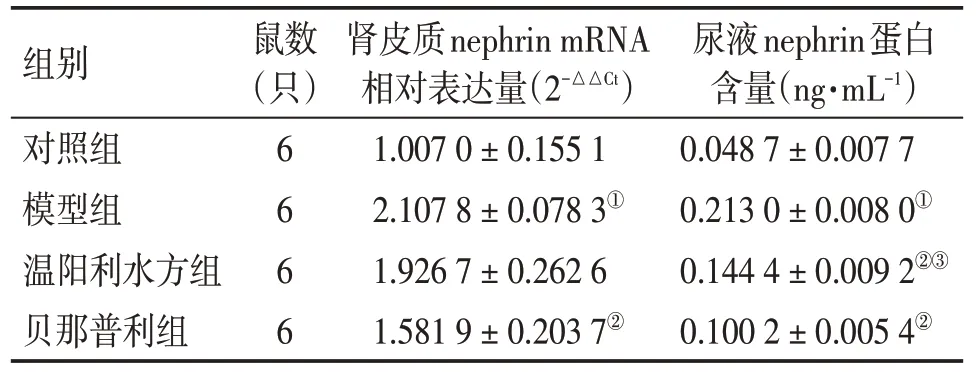
表3 灌胃4周后各組大鼠腎皮質nephrin mRNA和尿液nephrin蛋白檢測結果Table 3 Comparison of the expression levels of nephrin mRNA in renal cortex and nephrin protein in urine from rats in various groups after 4 weeks of intragastric administration (±s)
①P < 0.05,與對照組比較;②P < 0.05,與模型組比較;③P<0.05,與貝那普利組比較
?
4 討論
膜性腎病(MN),常見的主要臨床表現是大量蛋白尿、全身重度水腫。部分患者在起病初期或疾病復發時伴有急性腎損傷,少尿,可加重全身水腫,尤其是胃腸道水腫,可導致患者納差、嘔吐,影響藥物吸收,推遲免疫抑制劑起效時間;藥物無法緩解的重度水腫,隨著患者SCr 逐步上升,或者出現心力衰竭的并發癥,需要行血液透析治療;MN患者的高凝狀態,使得臨時血液透析通路的建立,進一步增加了深靜脈血栓的患病率,加重了治療難度和患者的經濟負擔。因此,對于MN 初期或復發期,在現有治療手段的基礎上,探索更有效的干預措施,減少并發癥的發生,仍然具有重大的臨床意義。本課題組的羅月中教授在30 余年的臨床實踐中發現IMN 初期或復發期中醫辨證以脾腎陽虛證為主[7],與多數研究[11-13]結論一致,配合使用溫陽利水方,不僅可以改善患者納差易吐的癥狀、增加尿量,還能減少患者上呼吸道感染的機率,促進患者平穩進入緩解期。在前期體外研究[6]基礎上,繼續探索溫陽利水方體內療效和機制,具有一定的臨床意義。
本研究采用C-BSA尾靜脈注射法構建MN大鼠模型,結果顯示,造模結束后,MN 大鼠的SCr、GLO、CHOL、TG、LDL-C、UTP 水平均明顯升高,ALB 水平明顯下降,與對照組比較,差異有統計學意義(TG 除外),又見電鏡下基底膜增厚、足突融合[5],提示造模成功。既往對IMN患者的臨床觀察研究發現,脾腎陽虛組患者血清GLO 和抗PLA2R 水平均較高,且二者呈正相關,提示脾腎陽虛組患者免疫活動和炎癥狀態明顯[14-16]。本研究結果顯示:造模后MN大鼠GLO較對照組亦顯著升高。使用溫陽利水方干預后,與模型組比較,溫陽利水方組大鼠食欲增加、不抗拒灌胃、脫毛減少、小便量多、大便成形、完全存活,灌胃2周末和4 周末UTP 均呈下降趨勢(且與貝那普利組比較,差異無統計學意義),腎組織病理學結果可見腎間質炎癥細胞浸潤亦明顯減輕,提示溫陽利水方可調節MN的免疫活動和炎癥狀態。
足細胞損傷、腎小球濾過屏障受損,出現蛋白尿,是MN典型的病理改變。溫陽利水方是否可調節足細胞相關基因和蛋白的表達?Park等[17]對小鼠腎臟細胞分類后,行單細胞測序分析,證實與人類蛋白尿單基因遺傳病相關的基因,尤其是nephrin 和podocin,僅在足細胞表達。nephrin 是足細胞裂孔隔膜(SD)蛋白復合物的主要分子,通過CD2 相關蛋白(CD2AP)、podocin 與細胞骨架蛋白actin 連接。因此,檢測nephrin 可較直觀地反映藥物對足細胞的影響。本研究中,模型組大鼠腎組織nephrin mRNA 表達水平增加,腎組織病理損傷明顯,使用溫陽利水方和貝那普利干預后,腎組織nephrin mRNA 表達水平均下降,腎組織病理損傷減輕、尿蛋白減少。結合前期體外研究[6],溫陽利水方水提物可改善脾腎陽虛IMN 患者血清致小鼠足細胞骨架蛋白F-actin 重排,提示增多的nephrin 可能擾亂了actin 正常結構,導致足突功能失常,出現蛋白尿等病理改變。既往已有研究[18-20]發現,損傷因素作用下,nephrin 在足細胞分布改變,但增加的nephrin 并不能發揮保護足細胞的作用。
綜上所述,溫陽利水方可改善MN模型大鼠水腫,減少尿蛋白,抑制腎小球免疫復合物的沉積和基底膜的增厚,減輕腎間質炎癥細胞浸潤。溫陽利水方可能是通過降低nephrin mRNA 的異常表達從而維持足突生理功能、減少尿nephrin 的排泄發揮足細胞保護作用,從而有效治療MN。
(致謝:感謝中山大學附屬第一醫院病理科董愉教授!感謝廣東省人民醫院史偉教授、章斌教授和張麗主治醫師!)

