五氧化二磷催化乙醇脫水反應制乙烯實驗的改進
程素芳 王慧
摘要: 分析現行高中化學教材中已有的乙烯制備實驗,從試劑選擇、反應條件確定、裝置選用三個層面對實驗進行優化改進。改進后的實驗減小了反應物用量,加快了化學反應速率,提高了乙烯產率,簡化了實驗操作過程。實驗改進通過學生實驗予以實施,學生的參與度高,有利于培養學生的綜合素質。
關鍵詞: 五氧化二磷; 乙醇; 乙烯; 實驗改進
文章編號: 1005-6629(2021)10-0068-03
中圖分類號: G633.8
文獻標識碼: B
1? 問題的提出
“乙烯的制備及其相應性質實驗的現象”是高中化學必修課程核心內容之一,是高中學生學習的重點知識,而這離不開乙烯的實驗室制備。
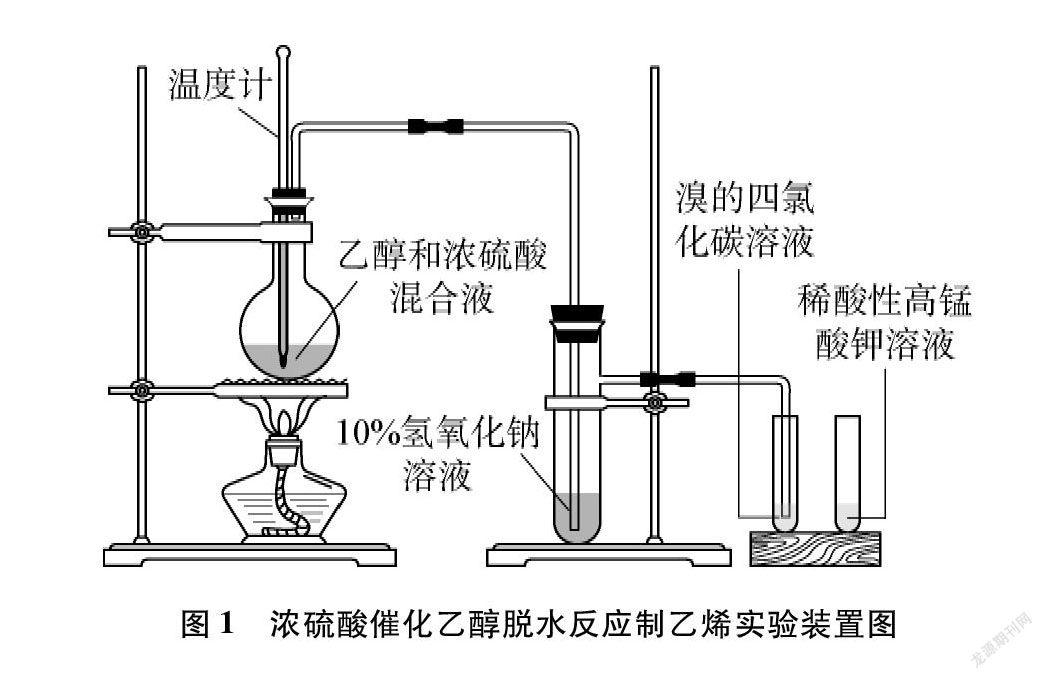
高中化學教材《有機化學基礎(選擇性必修3)》人教版、魯科版均為: 在圓底燒瓶中加入乙醇和濃硫酸(體積比約為1∶3)混合液20mL,溫度維持在170℃左右制備乙烯并進行相應的性質實驗,實驗裝置如圖1所示[1]。該方案用濃硫酸作催化劑,用酒精燈直接加熱,溫度達到140℃時會伴有副反應發生;溫度高于180℃時乙醇碳化現象嚴重,會有SO2、 CO2等雜質氣體生成,需用10%氫氧化鈉溶液處理生成的氣體。因此加熱過程溫度難以控制,實驗完成耗時較長,試劑用量較大。
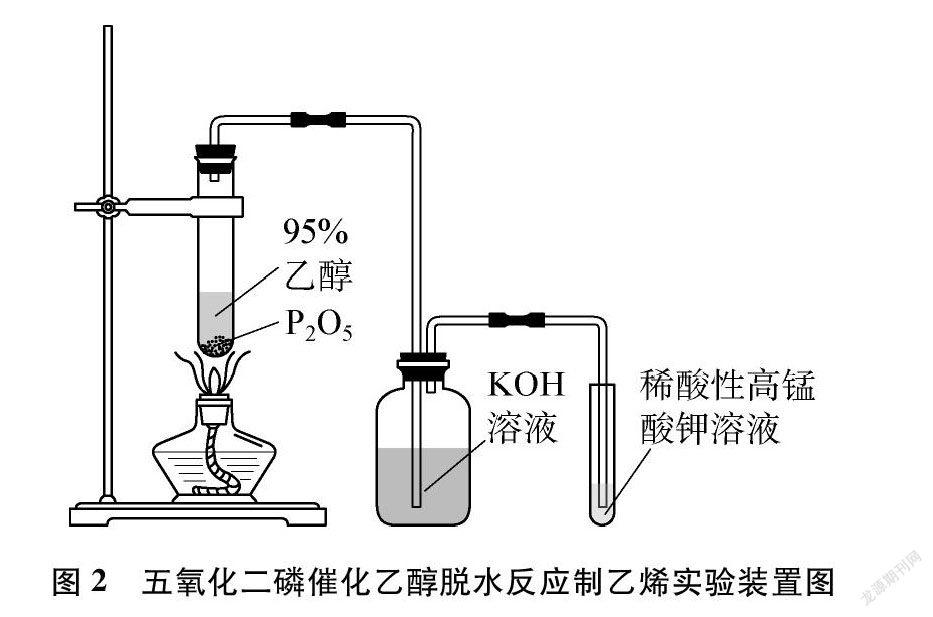
《有機化學基礎(選修5)》蘇教版則為: 在試管中加入2g P2O5并注入4mL 95%的乙醇,用酒精燈直接加熱制備乙烯,實驗裝置如圖2所示[2]。該方案用P2O5作催化劑,在裝有P2O5的試管中加入95%的乙醇。實驗過程會有“吱吱”的響聲,大量白霧產生,伴有放熱現象,測得溶液溫度可達94℃。不足之處是: 乙醇脫水反應速率太快,通常很難將生成的乙烯捕捉,產生的乙烯氣體在橡膠塞塞上之前已經逸出,導致乙烯性質實驗難以進行。用酒精燈直接加熱,氣泡快速生成并劇烈沸騰,還存在一定的安全隱患。
查閱相關文獻,邵國強等[3]指出,用現制焦磷酸12mL和無水乙醇10mL在185~260℃溫度范圍內持續加熱可以制得乙烯氣體;劉波等[4]指出,采用P2O5作催化劑制乙烯實驗的方案,無碳化現象,反應時間短,所需溫度不是很高,高錳酸鉀褪色情況良好;李先拴[5]指出,P2O5先與水形成磷酸,磷酸與乙醇在P2O5脫水作用下形成磷酸氫乙酯等副產物,由于磷酸氫乙酯比硫酸氫乙酯穩定,故90℃附近很難生成乙烯氣體,產生的氣體主要為乙醇蒸氣。
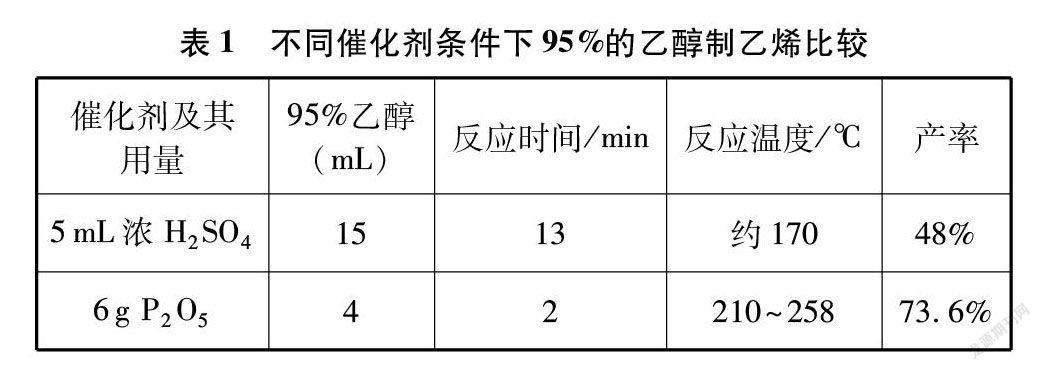
為此,本研究對P2O5催化乙醇脫水制乙烯實驗展開探索,以期找到實驗室制備乙烯的最佳條件。表1從反應物用量、反應時間、反應溫度以及乙烯產率等多角度比較選用濃硫酸和P2O5兩種不同催化劑制乙烯的差別。對比相關數據可以得出: 選用P2O5催化乙醇脫水反應制備乙烯有明顯的優勢,但按圖2所提供的實驗方法,在實際操作中仍存在一些問題,值得我們進一步探索改進。
2? P2O5催化乙醇脫水反應實驗探究
2.1? 試劑選擇
2.1.1? P2O5與乙醇用量
P2O5具有很強的吸水性和脫水性,這一性質與濃硫酸類似。乙醇制乙烯選用P2O5作催化劑,符合高中學生已有認知,學生容易理解。根據
C2H5OHP2O5CH2CH2
不難得出,C2H5OH與P2O5的計量數之比為3∶1。實際反應時體系中的水和生成的水都會消耗部分P2O5,為提高乙烯產率,理論上P2O5的用量略過量一些比較好。呂亞娟等[6]指出,C2H5OH與P2O5物質的量之比約在1.5∶1時,乙烯產率最高,為73.6%。此時P2O5用量約為理論用量的2倍。4mL 95%的乙醇,根據其密度及摩爾質量,可計算出乙醇的物質的量約為0.065mol。假設乙醇完全脫水,產生的水的物質的量應當為0.065mol,產生的水將消耗掉0.022mol P2O5。由P2O5的摩爾質量計算需要P2O5的質量約為3g。考慮到溶液中的水及P2O5在該反應中的催化作用,需要多余的P2O5去促使乙醇脫水生成乙烯,所以4mL 95%的乙醇需要P2O5的質量為6g左右比較合適。
經多次實驗結果證明: 用體積為2mL 95%的乙醇與3g P2O5反應,足以完成教材上乙烯的相關性質實驗。因此從簡約性、安全性考慮,實際操作時可以減少教材中規定的乙醇體積,適當增加P2O5用量。
2.1.2? 乙醇濃度和溴的四氯化碳溶液的選擇
多次實驗結果表明,將3g P2O5分別與2mL 95%的乙醇或等體積無水乙醇反應比較,酸性高錳酸鉀溶液褪色速度無明顯差異。實際教學中,由于我們僅僅需要制得少量的乙烯用于使4mL 0.01mol/L酸性高錳酸鉀溶液、溴的四氯化碳溶液褪色以及乙烯的燃燒實驗,對乙烯生成量的多少要求較低,因此,無論是選用95%的乙醇還是無水乙醇,都可滿足演示實驗的需求。實驗時只要注意控制好乙醇濃度在95%附近一般都能獲得較好的效果。關于烯烴中碳碳雙鍵的檢驗,人教版《有機化學基礎》(選擇性必修3)第97頁指出也可以用溴水[7],實驗多次證實該實驗溴水褪色現象明顯,效果更好,故本實驗用溴水代替溴的四氯化碳溶液。因為四氯化碳本身有一定毒性,使用溴水更符合環保要求。
2.2? 反應條件確定
該實驗如果用酒精燈直接加熱,溫度較難控制,若升溫速度過快極易引起反應混合液暴沸,導致乙醇大量氣化造成原料浪費,熱的乙醇蒸氣還會使酸性高錳酸鉀溶液褪色而干擾乙烯檢驗。且直接加熱還會導致試管中反應物受熱不均勻,氣流不穩定,倒吸現象發生幾率高,實驗安全性差。但若選擇水浴加熱,由于水浴溫度過低達不到乙醇脫水生成乙烯的目的。筆者嘗試用不同種類油浴加熱的方法。一般油浴在密封狀況下加熱溫度可達到200℃,但開放狀態下比較困難,且黏稠度大,不方便操作。而硅油因其黏稠度小、燃點高,是該實驗的理想選擇。經試驗后確定采用硅油浴加熱,溫度約為200℃。
2.3? 裝置選用
2.3.1? 發生裝置
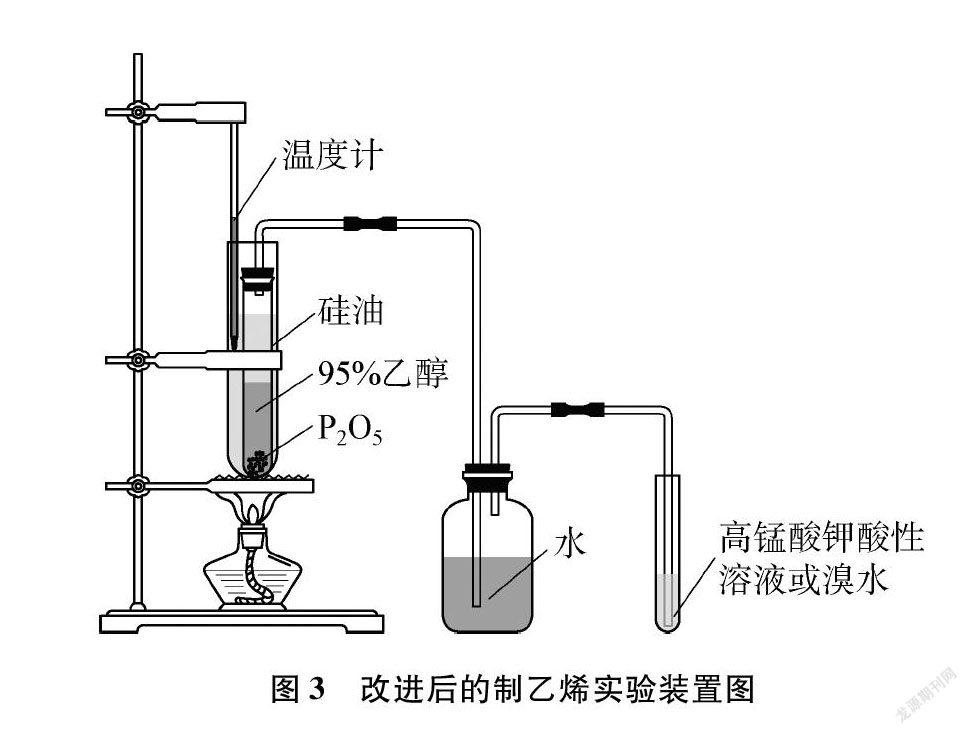
本實驗采用大試管(內置硅油)套小試管(內置反應物)油浴加熱的方式,裝置如圖3所示。該裝置減少了硅油使用量和熱量損失,同時油浴溫度測量也較方便。當硅油加熱到200℃以上時,試管中的乙烯氣體能連續平穩地產生,并使溴水和酸性高錳酸鉀溶液較快褪色。實驗時間約3min,且重復性好。
2.3.2? 除雜裝置
P2O5催化乙醇脫水制得的乙烯氣體中究竟混有哪些雜質?雜質是否如圖2所示,必須要用KOH溶液吸收,有沒有其他更好的選擇?
馬春生等[8]指出,氣體樣品GC圖譜檢測顯示: 在250℃的實驗溫度下,反應生成的氣體幾乎不含酸性氣體,乙烯氣體中的雜質主要為空氣、乙醇蒸氣和水蒸氣。筆者用pH試紙檢測95%乙醇加入P2O5中產生的白霧,pH試紙不變色,說明產生的白霧不是酸霧,而是氣化的乙醇。在用酸性高錳酸鉀檢驗乙烯前需要除去實驗過程中揮發出來的乙醇蒸氣。由于乙醇與水互溶,故反應產生的乙烯氣體用水洗效果很好,所以除雜試劑不必使用KOH溶液。
3? 實驗儀器和試劑
儀器: 大試管、小試管、酒精燈、量筒、洗瓶、鐵架臺、試管夾、導管、溫度計、火柴
試劑: 乙醇(95%)、P2O5、溴水、酸性高錳酸鉀溶液、硅油
4? 實驗步驟
(1) 按圖3所示搭建好實驗裝置,并檢驗裝置的氣密性。
(2) 乙烯制備: 在大試管中加入一定量硅油,加熱。用紙槽取約3g P2O5于小試管中,當硅油溫度接近200℃時,將2mL 95%的乙醇緩慢倒入小試管中混合,振蕩,待反應稍平緩,用帶有玻璃導管的橡膠塞塞上,放進大試管的硅油浴中加熱。
(3) 乙烯性質實驗: 當油浴溫度達到200℃時,觀察洗瓶中的氣泡,待乙烯氣流速度穩定(約1min后),先將導氣管通入盛有1~2mL淡黃色溴水的小試管中,觀察到溶液顏色褪成無色(約50s);再將導氣管通入盛有1~2mL紫色酸性高錳酸鉀溶液的小試管中,觀察到溶液顏色褪成無色(約30s);最后點燃導氣管口的氣體,觀察到火焰明亮并伴有黑煙。上述實驗現象均證明產生的氣體為乙烯。
5? 對實驗改進的評價
(1) 改進實驗中所使用的催化劑。乙醇消去反應制乙烯通常是用濃硫酸作催化劑,本實驗改用P2O5作催化劑符合高中學生已有的認知基礎。通過同一個化學反應選擇不同種催化劑,學生能體驗到合適催化劑的選取對乙烯的實際生產具有重要意義。由此,還可引導學生進一步分析能否使用FeCl3、 Al2O3等作本實驗的催化劑。
(2) 尋找最佳反應實驗條件。從理論計算、論證推理和實驗對照等多重角度,分析探索實驗室制備乙烯的最佳反應物用量、反應物濃度、除雜試劑、加熱介質、反應裝置等。通過改進教學實驗,培養學生敢于質疑、不唯書本、嚴謹求實的科學態度。
(3) 改進后的實驗有以下優點: 乙烯氣體產生快,完成實驗用時短,制得的乙烯氣體所含雜質少且易除去,整套實驗裝置簡潔,反應物用量少,操作簡便,現象明顯,污染小。
(4) 本實驗的改進過程基于學生認知水平,且通過學生實驗予以實施,學生的參與度高。關注實驗方法的多樣性、實驗活動的可行性、實驗過程的安全性和實驗試劑的簡約性,有利于培養學生的綜合素質。
參考文獻:
[1][7]王晶, 鄭長龍主編. 普通高中教科書·有機化學基礎(選擇性必修3)[M]. 北京: 人民教育出版社, 2020: 57~59.
[2]王祖浩主編. 普通高中課程標準實驗教科書·有機化學基礎(選修5)[M]. 南京: 江蘇教育出版社, 2009: 69.
[3]邵國強, 丁紅萍. 實驗室制備乙烯新方法[J]. 化學教學, 2002, (1): 34~35.
[4]劉波, 王程杰. 對乙醇脫水制乙烯實驗的新研究[J]. 化學教學, 2007, (5): 45~47.
[5]李先栓. “五氧化二磷使乙醇脫水”實驗方案的調研報告[J]. 廣州化工, 2011, 39(16): 190~191.
[6]呂亞娟,趙國虎,白林等. 對五氧化二磷催化乙醇制取乙烯的再研究[J]. 化學工業. 科技創新導報, 2011, (1): 112.
[8]馬春生,朱瑩敏. 對五氧化二磷催化乙醇脫水反應的研究[J]. 化學教育, 2011, (6): 70.

