微管相關蛋白4對肺腺癌 A549細胞遷移、侵襲、增殖和凋亡的影響
高標,馬凡尼,李相磊
1開封市中心醫院醫學檢驗科,河南 開封 475000
2河南大學淮河醫院檢驗科,河南 開封 475007
微管相關蛋白4(microtubule-associated protein 4,MAP4)可表達于除神經外的全身組織,其主要作用是調節細胞周期和穩定微管[1]。研究表明,MAP4可影響食管鱗狀細胞癌細胞的侵襲能力,進而影響患者預后[2]。另有研究表明,MAP4與膀胱癌細胞的遷移和侵襲有關[3]。肺腺癌是一種非小細胞肺癌,常發生于女性及不抽煙者中[4]。大部分肺腺癌起源于支氣管黏膜上皮,少數起源于大支氣管黏液腺[5]。在所有類型的肺癌中,肺腺癌的發病率較低,發病年齡相對較小,早期肺腺癌無明顯的臨床癥狀,腫瘤生長較為緩慢[6]。肺腺癌的侵襲和遷移是一個涉及多個基因的復雜過程,目前肺腺癌發生發展的分子機制尚未完全研究清楚。本研究探討了MAP4對肺腺癌細胞遷移、侵襲、增殖、凋亡的影響,旨在為研究肺腺癌發生發展的分子機制提供依據,現報道如下。
1 資料與方法
1.1 一般資料
選擇2014年8月至2020年8月開封市中心醫院收治的肺腺癌患者。納入標準:①經病理檢查確診為肺腺癌;②初診患者;③術前未接受放化療。排除標準:病歷資料不完整。依據納入和排除標準,本研究納入66例患者。其中,男51例,女15例;年齡24~80歲;有吸煙史48例;中高分化45例,低分化21例;有淋巴結轉移39例。收集肺腺癌患者的肺腺癌組織標本66例和癌旁組織標本57例。
1.2 細胞、試劑與儀器
人肺腺癌細胞株A549購自美國模式菌種收集中心(American Type Culture Collection,ATCC)。DMEM、胎牛血清培養基均購自美國Hyclone公司,青霉素、鏈霉素、胰蛋白酶細胞消化液均購自美國Gibco公司,細胞凍存液、脂質體3000試劑盒均購自美國Invitrogen公司,BCA蛋白定量試劑盒、電化學發光(electrochemiluminescence,ECL)試劑盒、二氨基聯苯胺(diaminobenzidine,DAB)、辣根過氧化物酶(horseradish peroxidase,HRP)標記的羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)、HRP標記的羊抗兔IgG、β-肌動蛋白(β-actin)抗體、蛋白提取試劑盒、CCK-8細胞增殖檢測試劑盒均購自上海睿安生物科技有限公司,MAP4抗體購自英國Abcam公司,細胞凋亡檢測試劑盒購自美國BD公司。CO2培養箱、臺式低溫高速離心機、酶標儀均購自美國Thermo Fisher Scientific公司,倒置顯微鏡購自德國Leica公司,顯微成像系統購自日本Nikon公司,UV2000分光光度計購自美國UNICO公司,凝膠成像系統購自美國Bio-Rad公司。
1.3 免疫組織化學染色法檢測MAP 4蛋白的表達情況及結果判定
將固定好的組織標本脫蠟至水,于抗原修復液中浸泡10 min煮沸,自然冷卻后采用磷酸鹽緩沖液(phosphate buffered saline,PBS)沖洗,滴加3%過氧化氫溶液孵育10 min,PBS沖洗3次,血清封閉10 min,棄血清,一抗4℃孵育過夜,PBS沖洗3次,二抗室溫孵育30 min,PBS沖洗3次,DAB顯色,蘇木素復染,鏡下觀察。細胞質被染為棕黃色或棕褐色視為陽性。采用半定量法進行評分,陽性細胞百分比評分:陽性細胞百分比<25%為0分,25%~50%為1分,51%~75%為2分,>75%為3分;染色強度評分:無色為0分,淺黃色為1分,棕黃色為2分,棕褐色為3分。兩項評分相加,0~3分為陰性,其余為陽性。
1.4 細胞培養及轉染
采用含10%胎牛血清及1%雙抗的DMEM培養基培養A549細胞,于37℃、5% CO2培養箱中培養,每2~3天傳代1次,待細胞生長密度超過80%時,采用胰蛋白酶消化,離心棄上清,采用細胞凍存液重懸,轉至無菌管中,保存于-80℃。向細胞中分別轉染siRNA-NC質粒和siRNA-MAP4質粒作為siNC組和siMAP4組,操作步驟依據脂質體3000試劑盒說明書進行。
1.5 蛋白質印跡法(Westernblot)檢測MAP 4蛋白表達
依據蛋白提取試劑盒說明書提取細胞中的蛋白質,采用BCA法測定蛋白濃度,進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE),然后轉膜,于室溫下采用含5%脫脂奶粉的TBST緩沖液封閉2 h,采用MAP4一抗4℃孵育過夜,TBST緩沖液洗滌3次,每次5 min,采用HRP標記的二抗于室溫下孵育1 h,TBST緩沖液洗滌3次,每次5 min,采用ECL試劑盒進行化學發光顯影,按照說明書進行操作,采用凝膠成像系統采集圖像,采用BandScan 4.0軟件分析條帶灰度。
1.6 細胞劃痕實驗檢測細胞的遷移能力
將細胞接種于6孔板,培養24 h形成單層細胞,采用無菌槍頭進行均勻的“一”字劃痕,洗去漂浮細胞,更換培養基,繼續培養細胞,于顯微鏡下觀察24 h和48 h的細胞遷移情況。
1.7 Transwell實驗檢測細胞的侵襲能力
采用無血清培養基將細胞饑餓培養6 h,將Matrigel膠按1∶4的比例稀釋,在Transwell上室中加入40 μl,均勻覆蓋,孵育2 h,消化后離心收集細胞,調整細胞密度至 5×105/ml,將 200 μl細胞懸液加入Transwell小室的上室,下室中加入500 μl培養基,培養24~48 h,采用棉簽擦去小室上層的基質膠及內層細胞,將小室取出后,倒置風干,采用95%乙醇固定5 min,向24孔板中加入500 μl的1%結晶紫溶液,置入小室,浸膜于其中,室溫放置5 min后取出,PBS清洗后置于載玻片上,封片,顯微鏡下計數。
1.8 CCK- 8法檢測細胞的增殖能力
將轉染后的A549細胞培養至對數生長期,收集細胞并計數,調節細胞密度至2×104/ml,吸取100 μl細胞懸液至96孔板中,于37℃、5% CO2培養箱中培養,每孔加入10 μl CCK-8溶液,混合均勻后,37℃孵育2 h,采用酶標儀測定450 nm處的光密度(optical density,OD)值。
1.9 流式細胞儀檢測細胞凋亡
采用膜聯蛋白V(Annexin V)-異硫氰酸熒光素(fluorescein isothiocyanate,FITC)/碘 化丙啶(propidium iodide,PI)雙染色法檢測細胞凋亡情況,收集轉染后的A549細胞進行重懸,將細胞密度調整至 1×106/ml,將100 μl細胞懸液轉至 5 ml流式管中,加入Annexin V-FITC及PI各5 μl,混勻后室溫避光孵育15 min,加入400 μl緩沖液,采用流式細胞儀進行檢測。
1.10 統計學分析
采用SPSS 20.0軟件對數據進行統計分析。符合正態分布的計量資料以均數±標準差(±s)表示,組間比較采用獨立樣本t檢驗;計數資料以例數和率(%)表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 肺腺癌組織和癌旁組織中MAP 4表達情況的比較
肺腺癌組織中MAP4的陽性表達率為56.06%(37/66),明顯高于癌旁組織的19.30%(11/57),差異有統計學意義(χ2=17.371,P<0.01)。(圖1)
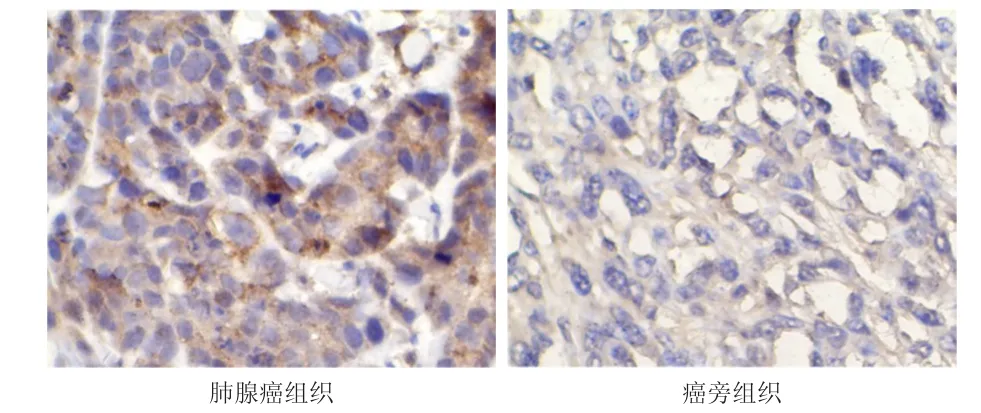
圖1 肺腺癌組織和癌旁組織中MAP 4的表達情況(免疫組織化學染色,×400)
2.2 兩組肺腺癌細胞中MAP 4相對表達量的比較
siMAP4組肺腺癌細胞中MAP4的相對表達量為(0.29±0.08),低于siNC組肺腺癌細胞的(0.60±0.12),差異有統計學意義(t=3.723,P<0.05)。(圖 2)
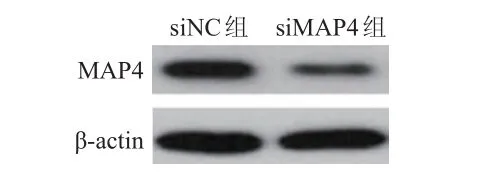
圖2 Western blot檢測兩組肺腺癌細胞中MAP 4的表達情況
2.3 兩組肺腺癌細胞遷移和侵襲能力的比較
siMAP4組肺腺癌細胞的24 h和48 h未遷移區域分別為(78.25±10.02)%和(62.47±7.26)%,分別明顯高于siNC組肺腺癌細胞的(43.56±8.31)%和(31.32±4.54)%,差異均有統計學意義(t=4.616、4.889,P<0.01)。siMAP4組肺腺癌細胞的侵襲細胞數目為(102±5)個,明顯少于siNC組肺腺癌細胞的(210±11)個,差異有統計學意義(t=15.481,P<0.01)。(圖3、圖4)
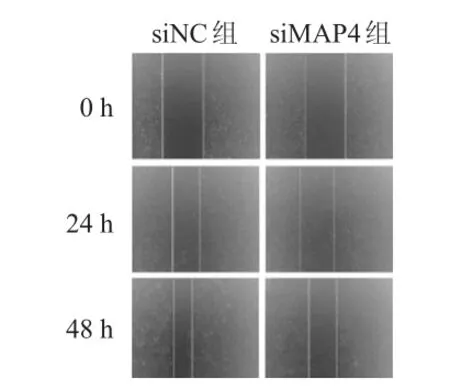
圖3 細胞劃痕實驗檢測兩組肺腺癌細胞的遷移能力
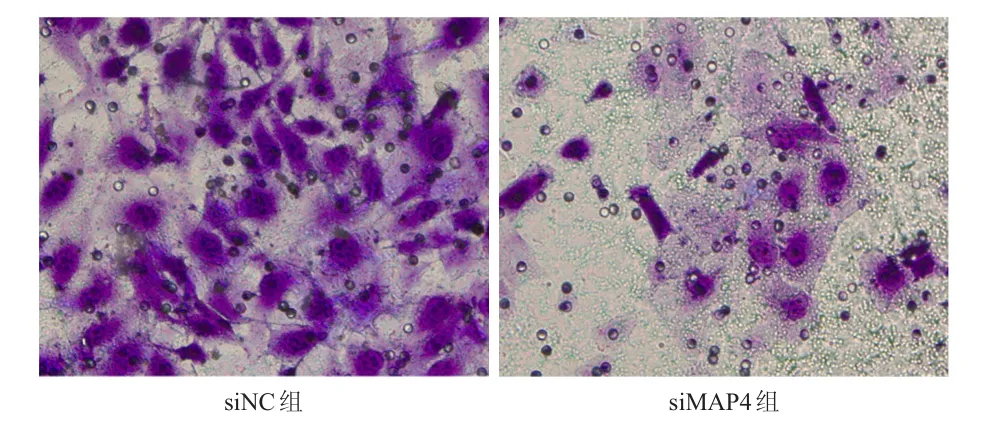
圖4 Transwell實驗檢測兩組肺腺癌細胞的侵襲能力(結晶紫染色,×400)
2.4 兩組肺腺癌細胞增殖能力的比較
轉染后1~5天,siMAP4組肺腺癌細胞的OD450值與同時間點siNC組比較,差異均無統計學意義(P>0.05)。(表1)
表1 轉染后 1~ 5天兩組肺腺癌細胞的OD450值(±s)
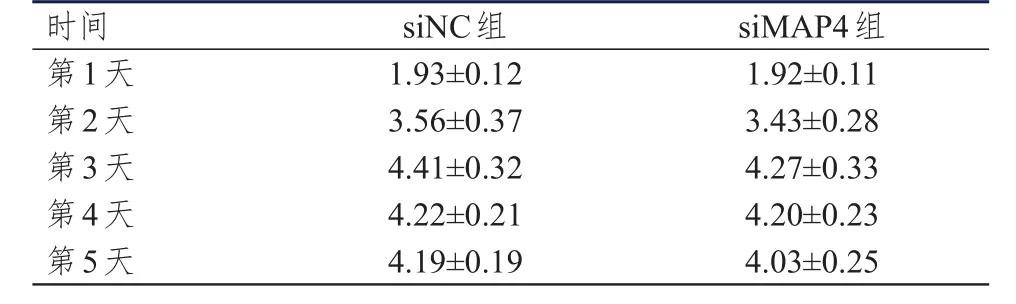
表1 轉染后 1~ 5天兩組肺腺癌細胞的OD450值(±s)
時間第1天第2天第3天第4天第5天1.93±0.12 3.56±0.37 4.41±0.32 4.22±0.21 4.19±0.19 1.92±0.11 3.43±0.28 4.27±0.33 4.20±0.23 4.03±0.25 siNC組siMAP4組
2.5 兩組肺腺癌細胞凋亡情況的比較
siMAP4組肺腺癌細胞的凋亡率為(34.82±7.65)%,與siNC組肺腺癌細胞的(39.27±8.34)%比較,差異無統計學意義(P>0.05)。(圖5)
3 討論

圖5 Annexin V-FITC/PI 雙染色法檢測兩組肺腺癌細胞的凋亡情況
肺癌是全球發病率和病死率最高的惡性腫瘤,嚴重威脅人類健康[7]。非小細胞肺癌占全部肺癌的80%,其中最常見的是肺腺癌[8]。肺腺癌生長較慢,但具有較高的浸潤性和破壞性,并且極易出現血行轉移和淋巴結轉移[9]。遠處轉移和局部復發是肺腺癌患者最主要的死亡原因[10]。近年來隨著醫療技術和理念的進步,腫瘤的分子靶向治療得到越來越廣泛的應用[11]。MAP4屬于微管相關蛋白(microtubule-associated protein,MAP)家族成員,首先發現于小鼠神經母細胞瘤細胞,對裝配、穩定微管具有重要作用[12]。研究表明,下調MAP4的表達可增加腫瘤細胞對化療藥物的敏感性,提高化療效果[13]。另有研究發現,肺癌組織中MAP4mRNA與stathminmRNA的比值高于正常肺組織,說明MAP4對診斷肺癌具有指示作用[14]。
微管由微管蛋白及微管相關蛋白組成,是構成細胞骨架的重要成分之一[15]。微管的功能主要受MAP的調節,在細胞收縮、運動及物質運輸中具有重要作用[16]。由于MAP4可提高微管強度、聚集微管,而微管在細胞分裂和細胞運動過程中又具有至關重要的作用,因此MAP4可能與腫瘤細胞的遷移和侵襲具有一定關聯[17]。研究報道,MAP4水平是檢查前列腺癌及判斷前列腺惡性腫瘤侵襲性的潛在指標[18]。還有研究證實,MAP4與口腔鱗狀細胞癌的惡性生物學行為相關[19]。本研究檢測了肺腺癌組織和癌旁組織中MAP4的表達情況,結果發現,肺腺癌組織中MAP4的陽性表達率明顯高于癌旁組織,提示MAP4高表達可能與肺腺癌的發生發展有關。
肺腺癌的遷移和侵襲是一個較為復雜的過程,與多種原癌基因及抑癌基因相關[20]。本研究通過RNA干擾技術調節肺腺癌細胞A549中MAP4的表達水平,結果顯示,下調MAP4的表達可抑制肺腺癌細胞的遷移和侵襲。這可能是由于MAP4具有調節微管的作用,MAP4水平降低導致微管強度減弱,進而引起腫瘤細胞的分裂和運動能力降低,遷移和侵襲能力受到抑制。CCK-8和流式細胞儀檢測結果顯示,MAP4表達水平對肺腺癌細胞的增殖和凋亡無顯著影響,這可能是因為MAP4不參與A549細胞增殖和凋亡相關信號通路的激活。
綜上所述,MAP4在肺腺癌組織中高表達,MAP4高表達可提高肺腺癌細胞的遷移和侵襲能力,在肺腺癌的發生發展中具有重要作用,本研究暫未發現MAP4對肺腺癌細胞增殖和凋亡的影響,但具體機制還有待更深入的研究。

