三角梅cDOPA 5GT基因的克隆和光照對其表達的影響
劉姍, 孫蓉, 高靜雷
三角梅基因的克隆和光照對其表達的影響
劉姍, 孫蓉, 高靜雷
(攀枝花學院生物與化學工程學院,干熱河谷特色生物資源開發四川省高校重點實驗室,四川 攀枝花 617000)
為了解光照對三角梅()葡糖基轉移酶基因表達的影響,從其苞片中克隆了環多巴5-糖基轉移酶基因()。結果表明,三角梅基因的cDNA全長為1 446 bp,編碼482個氨基酸,生物信息學分析表明cDOPA 5GT蛋白的等電點(PI)為5.77,具有糖基轉移酶的特征基序,為酸性親水跨膜蛋白,不含信號肽,二級結構以-螺旋和無規則卷曲為主,氨基酸序列保守性較差。qRT-PCR分析表明,遮光處理基因表達量和植株的甜菜紅素含量均顯著下降。這表明三角梅的色素合成受糖基轉移酶基因調控,并與光照呈正相關關系。
三角梅;葡糖基轉移酶;基因表達;光照
三角梅()是紫茉莉科(Nyctaginaceae)三角梅屬植物, 為常綠攀援狀灌木,原產于南美洲的巴西、秘魯等國,因其發現者法國探險家、植物學家Louis-antoine de Bougainville而得名,意思為“寶巾”[1]。三角梅屬中只有葉子花()、三角梅和秘魯三角梅()具有觀賞價值[2–3]。三角梅喜光不耐寒,主要觀賞部位是苞片,色素通過甜菜色素途徑合成, 主要為甜菜紅素和甜菜黃素,并通過兩種色素間相對含量的轉化實現對花色的調節,使苞片呈現不同顏色[4–5]。
甜菜色素途徑的起始物是酪氨酸,中間產物多巴在不同酶的催化下分別合成環狀多巴和甜菜醛氨酸,兩者再自發形成甜菜紅素,與甜菜黃素的積累不在同一個分支。葡糖基轉移酶(glycosyltransferases, GTs)是甜菜色素代謝過程中重要的關鍵酶,該途徑涉及的糖基轉移酶分為2類:5-、6-糖基轉移酶和環多巴5-糖基轉移酶(cyclo-DOPA-5-glucosyltrans- ferase, cDOPA 5GT),其中環多巴糖苷在合成末端把糖基轉移至甜菜苷配基上[6–7],產物在甜菜紅素的總含量中占比較大,該過程可以是環狀多巴先被cDOPA 5GT催化形成環多巴葡萄糖,再與甜菜醛氨酸結合,也可以是環狀多巴先結合甜菜醛氨酸,再催化連接糖基形成甜菜苷。三角梅的優勢色素是甜菜紅素,在苞片表皮和對紫外線較為敏感的組織中積累[8–9],其積累量與葡糖基轉移酶表達量相關。葡糖基轉移酶目前已在植物類黃酮生物合成中被大量鑒別,但在甜菜色素代謝途徑的生物合成中還較少報道,本研究對三角梅的基因進行了同源克隆,并對cDOPA 5GT蛋白進行了生物信息學分析,同時對三角梅基因的表達和甜菜紅素的積累進行了分析,初步探討了甜菜紅素的積累與光照的相關性,為研究三角梅甜菜紅素的生物合成提供試驗基礎。
1 材料和方法
1.1 材料
試驗用三角梅()購買后于實驗室中培育,由同一母本扦插批量培養。挑選花期花蕾數量較多且生長一致的三角梅植株,在花芽發育初期,將植株分成二組,一組正常日照(對照),另一組用黑色塑料膜包裹進行遮光處理(試驗組)。2周后,選取大小和形態一致的苞片作為試驗材料。
1.2 cDOPA 5GT基因的克隆
按照柱式植物RNAout 2.0試劑盒說明書提取三角梅花期苞片總RNA[10]。按照Thermo公司反轉錄試劑盒說明書合成cDNA,以cDNA為模板,進行PCR擴增。根據NCBI中植物基因同源比對結果,設計1對特異引物GUTBDS (5?-CGGGGT- ACCATGGAGTATAACTCAGAAACAGAGCACA-3?,引入I酶切位點)和UGTBDX (5?-CCGCTCGA- GTCATTTATCCTTACTCGTTTTAGCTGAG-3?,引入I酶切位點),以反轉錄產物為模板擴增三角梅苞片基因,反應體系總體積為30L,包含Max DNA Polymerase 15L、cDNA 1L、UDPBDS和UDPBDX引物各0.5L和ddH2O 13L,PCR產物經1.5%瓊脂糖凝膠電泳后,回收目的片段在末端添加多聚A尾,連接pMD19-T載體并轉入大腸桿菌DH5感受態中,篩選陽性轉化子送上海英濰捷基貿易有限公司進行測序,將序列命名為。
1.3 生物信息學分析
采用BLAST P軟件(https://blast.ncbi.nlm.nih. gov/Blast.cgi)進行氨基酸同源序列比對分析;采用ProtParam軟件(http://expasy.org/tools/protparam/html)進行蛋白質理化性質分析;采用PSIPRED軟件 (http://bioinf.cs.ucl.ac.uk/psipred)進行蛋白二級結構預測;采用SWISS MODEL軟件(https://swissmodel. expasy.org/interactive)進行蛋白三級結構預測; 采用Signal P 4.1軟件(http://www.cbs.dtu.dk/services/ SignalP/)進行信號肽預測;采用TMHMM軟件(http:// www.cbs.dtu.dk/services/TMHMM)進行蛋白跨膜結構預測。采用MEGA 6.0軟件構建系統進化樹,進行系統進化分析。
1.4 實時熒光定量PCR分析
根據全長序列設計1對熒光定量引物cDOPA 5GTqS和cDOPA 5GTqX,以18S rRNA基因作為內參[11],采用實時熒光定量PCR技術分析遮光處理對基因表達量的影響。PCR反應體系總體積為15L,包含SYBR Premix ExII 7.5L、cDNA 1.0L、引物各0.5L和ddH2O 5.5L,反應程序為:95℃ 3 min,95℃ 10 s, 64.5℃(cDOPA 5GT)/55.7℃(18s rRNA) 30 s, 72℃ 40 s, 72℃ 10 min, 共39次循環。
1.5 甜菜紅素含量的測定
甜菜紅素含量的測定采用改進的Stintzing等[12]方法,稱取0.15 g三角梅苞片干粉于預冷的研缽中,加入預冷的甲醇2 mL研磨,全部轉入10 mL離心管中;置于4℃冰箱中30 min;然后在16 099.2×下離心10 min并收集沉淀,加入4 mL ddH2O重懸沉淀,置于4℃冰箱中30 min;在16 099.2×下離心10 min后收集上清液;重復操作1次,合并上清液用ddH2O定容至10 mL,在波長536 nm處測定吸光值,甜菜紅素含量(, mg/g)=(×M××1000)/ (×)[6,13],式中,為536 nm下的吸光度, M為甜菜紅素的相對摩爾質量(550.47 g/mol),為溶液的總體積(L),為甜菜紅素的摩爾消光系數[5.66× 104L/(mol·cm)],為樣品質量(g)。
2 結果和分析
2.1 cDOPA 5GT基因的克隆
以三角梅苞片cDNA為模板進行PCR擴增, 獲得了一條長為1 446 bp的片段(圖1),測序結果與預期吻合。經Blast P序列比對分析表明該片段序列與葉子花葡糖基轉移酶基因的相似度高達99%,命名為,GeneBank登錄號為MT239387。

圖1 cDOPA 5GT基因的PCR擴增。M: DNA Marker; U: cDOPA 5GT。
2.2 cDOPA 5GT的生物信息學分析
理化性質和結構預測基因編碼482個氨基酸,BLAST分析表明cDOPA 5GT氨基酸序列的保守性相對較差,與同科植物紫茉莉(,登錄號BAD91803.1)的葡糖基轉移酶的氨基酸序列相似度為65%,而與奎奴亞藜(,登錄號XP021748306.1)和馬齒莧(,登錄號XP021847933.1)的相似度為63%和62%。cDOPA 5GT的相對分子質量為54.66 kD,蛋白等電點(PI)為5.77,為酸性穩定親水性蛋白,推測的分子式為C2463H3779N655O712S22;同時,該蛋白中含有22種氨基酸,其中47個帶正電荷,61個帶負電荷,含量較多的為亮氨酸(Leu,10%), 而酪氨酸(Tyr)和半胱氨酸(Cys)較少,僅為1.7%和1%。利用PSIPRED預測cDOPA 5GT蛋白二級結構主要由-螺旋和無規則卷曲構成,還有一定量的折疊結構。應用SWISS MODEL預測蛋白三級結構如圖2。采用在線工具Signal P4.1分析結果表明,cDOPA 5GT蛋白不具有信號肽結構; TMHMM預測cDOPA 5GT蛋白可能為跨膜蛋白。
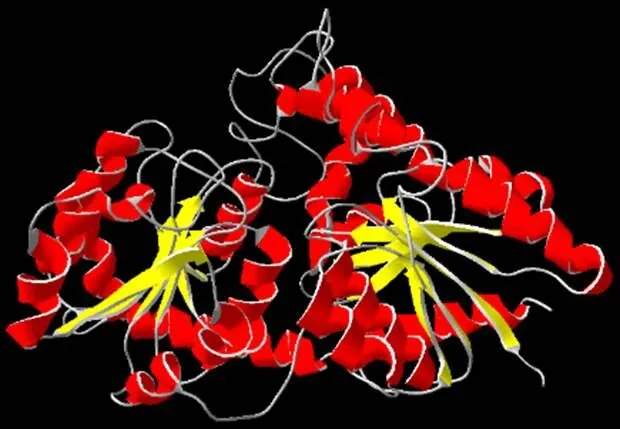
圖2 三級結構預測
序列分析 通過BLAST P比對,cDOPA 5GT蛋白存在1個Glycosyltransferase-GTB-type超家族成員PLN02863結構區域(圖3)。不同植物基因編碼的氨基酸序列差異很大,保守性較差。三角梅cDOPA 5GT的C-端具有UGTs家族的44個氨基酸高度保守序列PSPG (圖4),說明三角梅基因編碼的蛋白是可溶性的酶,葡糖基結合位點可能是WGPQLEILNHESTGGFLSHCGWNSVLE SLREGVPILGWPLAAEQ。
將cDOPA5GT蛋白的氨基酸序列與NCBI上已知的其他植物UTGs蛋白的氨基酸序列進行比對,結果表明,三角梅cDOPA 5GT蛋白與紫茉莉(, 登錄號AB182643.1)、甜菜(subsp., 登錄號XP010681653.1)的親緣關系較近,而與擬南芥(, 登錄號AF196777.1)、菊花(, 登錄號MN364678.1)的親緣關系較遠(圖5)。

圖3 BLAST P序列比對結果
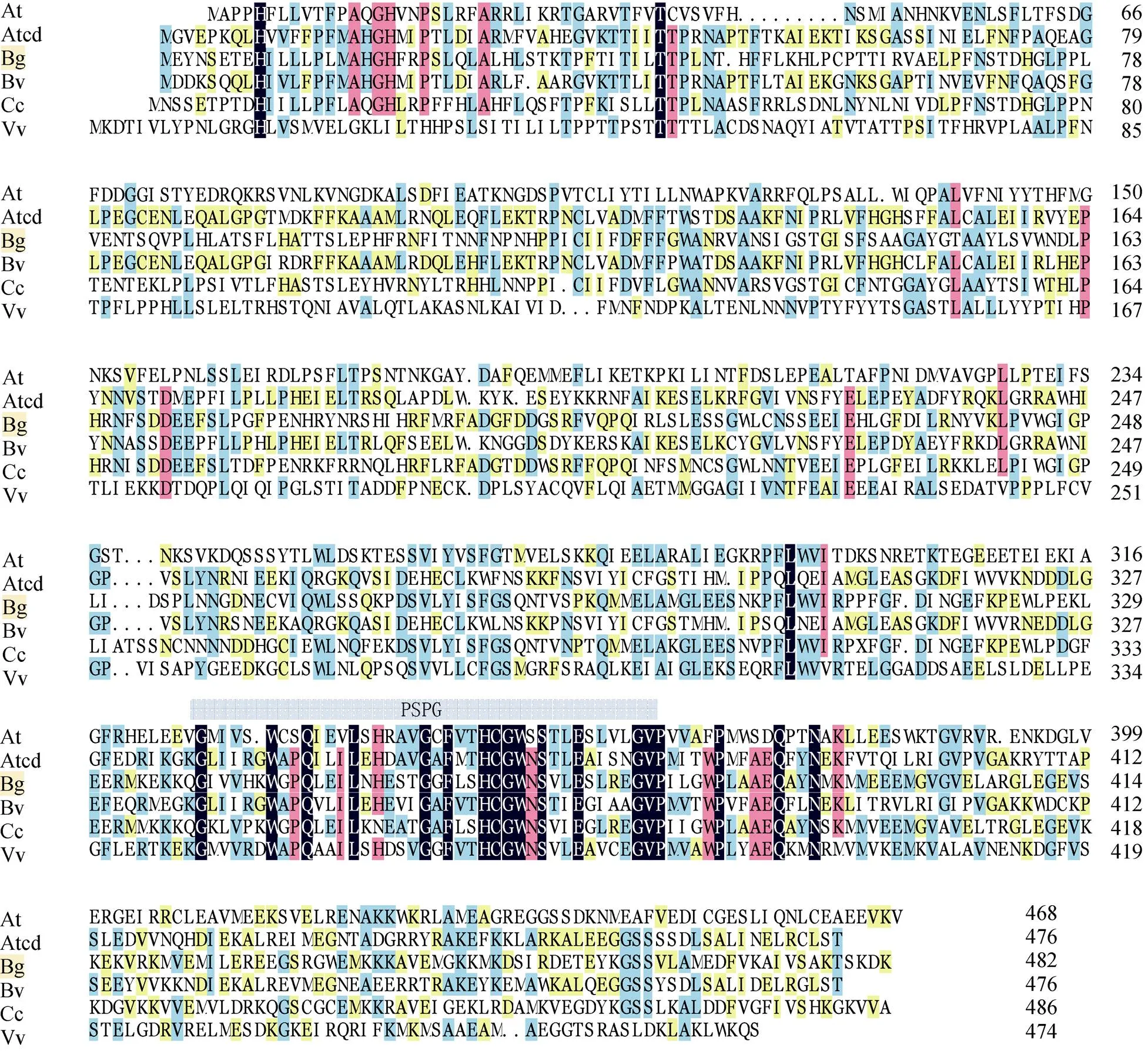
圖4 cDOPA 5GT氨基酸序列的保守結構域預測。At: 擬南芥; Atcd: 莧菜; Bg: 三角梅; Bv: 甜菜; Cc: 雞冠花; Vv: 葡萄。
2.3 cDOPA 5GT的表達和甜菜紅素積累量的相關性
熒光定量分析結果表明(圖6),遮光處理后,基因表達量明顯下降(<0.01),而且遮光處理的三角梅甜菜紅素含量也下降(<0.01)。這表明三角梅苞片中的基因表達受光照的調節,其表達量和甜菜紅素含量的Pearson相關系數為0.9998,呈極顯著正相關,表明基因在其甜菜紅素合成通路中作用重要。
3 結論和討論
糖基化反應是植物體內重要的次生代謝反應,糖基轉移酶(GTase)催化特定位點的糖基化反應合成糖苷。GTs被分為99個家族[14],其中以尿嘧啶核糖基轉移酶苷二磷酸-葡萄糖(UDP-sugar)為供體的UGTs屬于家族1,是植物主要的糖基轉移酶。本研究獲得的糖基轉移酶在C-末端含有該家族特有的植物次生產物糖基轉移酶(PSPG)基序,因此推測cDOPA 5GT蛋白屬于UGT-1家族。UGT表達量的提高能夠促進重要次生代謝產物的合成,在大腸桿菌BL21中表達紅景天()的基因,獲得了8種酚苷類天然產物[15]; 擬南芥() UGT的異位表達提高了花青素和原花青素的含量,并賦予擬南芥較高的耐光性[16]。糖基轉移酶是分歧較多的多源基因家族,目前的研究表明UGTs與糖基受體結合的結構域沒有顯著保守性,尚未有某個特定的氨基酸可以決定UGTs的酶學特征,盡管已有研究表明甜菜色素積累與糖基轉移酶轉錄量正相關[17–19],但三角梅植物的基因組序列尚未公布,其還有待深入研究。

圖5 基于UTGs氨基酸序列的系統進化分析
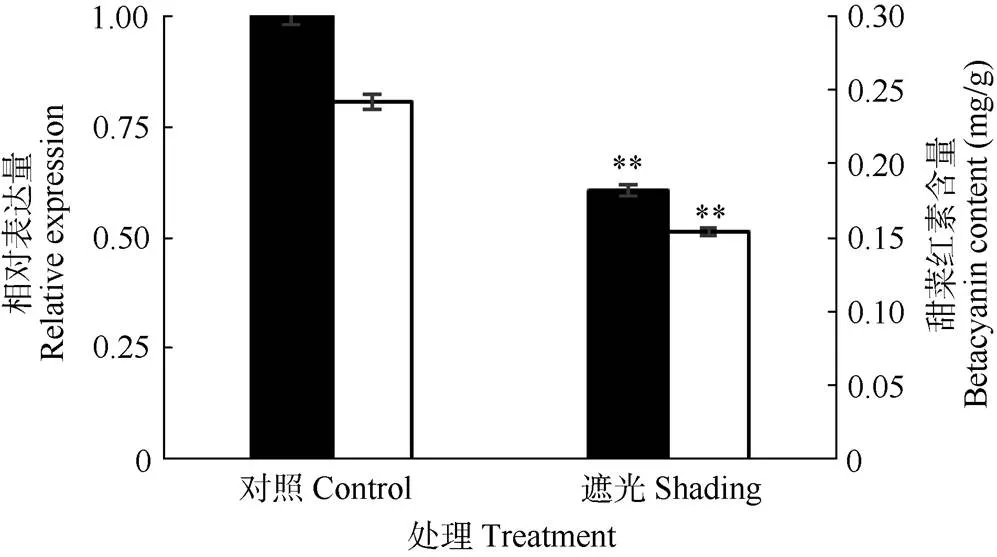
圖6 cDOPA 5GT的相對表達量(■)和甜菜紅素含量(□)。**: P<0.01。
甜菜紅素在多數石竹目植物中替代花青素使植物產生艷麗的顏色,目前尚未發現同一種植物同時存在這兩種色素,但有報道表明參與兩種色素途徑的酶和轉錄因子可以在不含此色素的植物中相互表達[20–22],可能是甜菜紅素和花青素具有相同的進化起源,合成途徑相類似[7,23]。甜菜紅素合成受多種因素的影響,其中光對色素的累積影響較大[24], 而藍光比紅光更有利于甜菜紅色素的積累[25]。本研究結果表明,遮光會影響糖基轉移酶基因的表達,相對表達量降低了38.3%,同時甜菜紅素的合成也降低36.3%,這表明光照與三角梅色素合成呈極顯著相關。本試驗是自然光照培養植物,雖然有報道探討了光質、光強對甜菜紅素合成的影響,但光改變后上游代謝物的流向未見報道研究,同時遮光并非必然降低基因表達量,在適當的遮光率下,關鍵酶基因的表達量可能還比全光照高,如30%的遮陰處理,珠子參(var.)皂苷合成關鍵酶的表達量和皂苷的積累都得到提升[26],可能光照率對不同關鍵酶的活性影響不一樣,造成目標代謝物合成受多因素影響,因此在三角梅甜菜色素合成的光照條件上還需要進一步摸索。對于三角梅而言,艷麗的色彩中缺少了藍色系,而藍色是甜菜紅色素途徑不產生的下游產物,顯示藍色的是黃酮類化合物,為花青素代謝途徑,而有研究表明花青素代謝途徑和甜菜色素代謝途徑有相同的起源,結合本研究結果,甜菜紅色素代謝重要關鍵酶之一的糖基轉移酶基因表達和甜菜紅素含量成正相關關系,那么今后是否可以利用基因工程手段將編碼類黃酮-3?5?-羥化酶(F3?,5?H)的基因引入下調某些甜菜色素途徑關鍵酶基因,從而達到內源表達花青素代謝途徑的下游產物,促使花色素苷的合成轉向翠雀素糖苷的合成方向[27],使三角梅苞片顏色更豐富,是未來值得深入探討的課題。
[1] XU S X, WANG L S, SHU Q Y, et al. Progress of study of the biology of the resource plant bougainvillea [J]. Chin Bull Bot, 2008, 25(4): 483–490. doi: 10.3969/j.issn.1674-3466.2008.04.015.徐夙俠, 王亮生, 舒慶艷, 等. 三角梅屬植物的生物學研究進展 [J].植物學通報, 2008, 25(4): 483–490. doi: 10.3969/j.issn.1674-3466. 2008.04.015.
[2] Huang Y J. ISSR analysis of germplasm resources ofRaeusch [D]. Fuzhou: Fujian Agriculture and Forestry University, 2010: 1–2. 黃彥晶. 三角梅(Raeusch.)種質資源的ISSR分析 [D]. 福州: 福建農林大學, 2010: 1–2.
[3] TANG Y J, WU X Y, CAO W J. Genetic diversity and relationship ofgermplasm resources based on SRAP markers [J]. J Trop Subtrop Bot, 2014, 22(2): 147–154. doi: 10.3969/j.issn.1005-3395. 2014.02.007.唐源江, 武曉燕, 曹雯靜. 基于SRAP的葉子花種質資源遺傳多樣性及遺傳關系分析 [J]. 熱帶亞熱帶植物學報, 2014, 22(2): 147–154. doi: 10.3969/j.issn.1005-3395.2014.02.007.
[4] Lee D W, Collins T M. Phylogenetic and ontogenetic influences on the distribution of anthocyanins and betacyanins in leaves of tropical plants [J]. Int J Plant Sci, 2001, 162(5): 1141–1153. doi: 10.1086/32 1926.
[5] KUGLER F, Stintzing F C, Carle R. Characterisation of betalain patterns of differently coloured inflorescences fromL. andsp. by HPLC-DAD-ESI-MS[J]. Anal Bioanal Chem, 2007, 387(2): 637–648. doi: 10.1007/s00216-006-0897-0.
[6] Zheng X L. Studies on physiology, biochemistry and molecular biology on betalain synthesis in[D]. Fuzhou: Fujian Agriculture and Forestry University, 2016: 15–22. 鄭學立. 莧菜甜菜紅素合成的生理生化與分子生物學研究[D]. 福州: 福建農林大學, 2016: 15–22.
[7] Sakuta M. Diversity in plant red pigments: Anthocyanins and beta- cyanins [J]. Plant Biotechnol Rep, 2014, 8(1): 37–48. doi: 10.1007/ s11816-013-0294-z.
[8] Wang C Q, Liu T, Wang B S. Advances in betalain research in higher plants [J]. Chin Bull Bot, 2006, 23(3): 302–311. doi: 10.3969/j. issn.1674-3466.2006.03.011. 王長泉, 劉濤, 王寶山. 植物甜菜素研究進展 [J]. 植物學通報, 2006, 23(3): 302–311. doi: 10.3969/j.issn.1674-3466.2006.03.011.
[9] Bock K W. The UDP-glycosyltransferase (UGT) superfamily expressedin humans, insects and plants: Animal-plant arms-race and co-evolution [J]. Biochem Pharmacol, 2016, 99: 11–17. doi: 10.1016/j.bcp.2015.10.001.
[10] Sun R, Liu S, Tang Z Z, et al.-Amyrin synthase fromexpressed in[J]. FEBS Open Biol, 2017, 7(10): 1575–1585. doi: 10.1002/2211-5463.12299.
[11] ZHOU X F, WANG J, SHI H W, et al. The exploration of 18S rRNA for quantitative RT-PCR as reference gene in plant [J]. J Jilin Norm Univ (Nat Sci), 2016, 37(2): 115–119. doi: 10.16862/j.cnki.issn1674- 3873.2016.02.025. 周曉馥, 王晶, 史宏偉, 等. 18S rRNA作為植物實時熒光定量PCR內參基因的探究 [J]. 吉林師范大學學報(自然科學版), 2016, 37(2): 115–119. doi: 10.16862/j.cnki.issn1674-3873.2016.02.025.
[12] Stintzing F C, Schieber A, Carle R. Betacyanins in fruits from red-purple pitaya,(Weber) Britton & Rose [J]. Food Chem, 2002, 77(1): 101–106. doi: 10.1016/s0308-8146(01) 00374-0.
[13] Zhao S Z, Sun H Z, Chen M, et al. Light-regulated betacyanin accumulation in euhalophytecalli [J]. Plant Cell Tiss Org Cult, 2010, 102(1): 99–107. doi: 10.1007/s11240-010- 9710-z.
[14] Qin J J, Sun C Y, Zhang M P, et al. Classification, function and evolution of plant UDP-glycosyltransferase [J]. Genom Appl Biol, 2018, 37(1): 440–450. doi: 10.13417/j.gab.037.000440. 秦晶晶, 孫春玉, 張美萍, 等. 植物UDP-糖基轉移酶分類、功能以及進化 [J]. 基因組學與應用生物學, 2018, 37(1): 440–450. doi: 10. 13417/j.gab.037.000440.
[15] HE Q L, BAI Y F, ZHOU W, et al. Biocatalysis of phenolic glycosides natural products instrain using UGT73B6 [J]. Bio- technol Bull, 2017, 33(11): 136–142. doi: 10.13560/j.cnki.biotech.bull. 1985.2017-0363. 何慶林, 白艷芬, 周威, 等. 利用糖基轉移酶UGT73B6在大腸桿菌中生物催化酚苷類天然產物 [J]. 生物技術通報, 2017, 33(11): 136– 142. doi: 10.13560/j.cnki.biotech.bull.1985.2017-0363.
[16] RAO M J, Xu Y T, Huang Y, et al. Ectopic expression of citrus UDP-GLUCOSYL TRANSFERASE gene enhances anthocyanin and proanthocyanidins contents and confers high light tolerance in[J]. BMC Plant Biol, 2019, 19(1): 603. doi: 10.1186/s12870- 019-2212-1.
[17] SEPúLVEDA-JIMéNEZ G, Rueda-Benítez P, Porta H, et al. A red beet () UDP-glucosyltransferase gene induced by wounding, bacterial infiltration and oxidative stress [J]. J Exp Bot, 2004, 56(412): 605–611. doi: 10.1093/jxb/eri036.
[18] SASAKI N, WADA K, KODA T, et al. Isolation and characterization of cDNAs encoding an enzyme with glucosyltransferase activity for-DOPA from four o’clocks and feather cockscombs [J]. Plant Cell Physiol, 2005, 46(4): 666–670. doi: 10.1093/pcp/pci064.
[19] Hatlestad G J, Lloyd A. The betalain secondary metabolic network [M]// CHEN C X. Pigments in Fruits and Vegetables. New York: Springer, 2015: 127–140. doi: 10.1007/978-1-4939-2356-4_6.
[20] Cheng M N, Huang Z J, Hua Q Z, et al. The WRKY transcription factor HpWRKY44 regulatesexpression in red pitaya fruit () [J]. Hort Res, 2017, 4: 17039. doi: 10. 1038/hortres.2017.39.
[21] Xu S X, Huang Q Y, Lin C S, et al. Transcriptome comparison reveals candidate genes responsible for the betalain-/anthocyanidin- production in bougainvilleas [J]. Funct Plant Biol, 2016, 43(3): 278– 286. doi: 10.1071/FP15246.
[22]XU S X, HUANG Q Y, LIN C S, et al. Progress of betalains biology [J]. Subtrop Plant Sci, 2019, 48(4): 378–383. doi: 10.3969/j.issn.1009-7791. 2019.04.014. 徐夙俠, 黃青云, 林春松, 等. 甜菜色素的生物學研究進展 [J]. 亞熱帶植物科學, 2019, 48(4): 378–383. doi: 10.3969/j.issn.1009-7791. 2019.04.014.
[23] Hatlestad G J, Akhavan N A, SUNNADENIYA R M, et al. The beet Y locus encodes an anthocyanin MYB-like protein that activates the betalain red pigment pathway [J]. Nat Genet, 2015, 47(1): 92–96. doi: 10.1038/ng.3163.
[24] WONG Y M, SIOW L F. Effects of heat, pH, antioxidant, agitation and light on betacyanin stability using red-fleshed dragon fruit () juice and concentrate as models [J]. J Food Sci Technol, 2015, 52(5): 3086–3092. doi: 10.1007/s13197-014-1362-2.
[25] ZHENG X L, LIU S C, XIE L Y, et al. Promoter-cloning, protein subcellular localization, and expression analysis forgene of[J]. Fujian J Agric Sci, 2015, 30(11): 1064– 1070. doi: 10.3969/j.issn.1008-0384.2015.11.008. 鄭學立, 劉生財, 謝禮洋, 等. 莧菜基因的啟動子克隆、亞細胞定位及表達分析 [J]. 福建農業學報, 2015, 30(11): 1064–1070. doi: 10.3969/j.issn.1008-0384.2015.11.008.
[26] HUANG W J, SUN X C, LI B, et al. Effects of shading on key enzyme genesexpression and accumulation of saponins invar.[J]. China J Chin Mat Med, 2018, 43(19): 3855–3861. doi: 10. 19540/j.cnki.cjcmm.20180528.007.黃文靜, 孫曉春, 李鉑, 等. 遮陰對珠子參皂苷合成關鍵酶基因表達和皂苷積累的影響 [J]. 中國中藥雜志, 2018, 43(19): 3855–3861. doi: 10.19540/j.cnki.cjcmm.20180528.007.
[27] LI M R, CHEN J T, SUN Z J, et al. Advances in molecular breeding of ornamental plants [J]. J Trop Subtrop Bot, 2003, 11(1): 87–92. doi: 10. 3969/j.issn.1005-3395.2003.01.017.李美茹, 陳金婷, 孫梓健, 等. 花卉分子育種的研究進展 [J]. 熱帶亞熱帶植物學報, 2003, 11(1): 87–92. doi: 10.3969/j.issn.1005-3395. 2003.01.017.
Cloning of Cyclo-DOPA-5-glucosyltransferase Gene fromand Effect of Illumination on Its Expression
LIU Shan, SUN Rong, GAO Jing-lei
(Key Laboratory of Dry-hot Valley Characteristic Bio-Resources Development at University of Sichuan Province, Department of Biological and Chemical Engineering, Panzhihua University,Panzhihua 617000, Sichuan, China)
In order to understand the effect of illumination on the expression of glucosyltransferase gene in, the cyclo-DOPA-5-glucosyltransferase gene () was cloned from bracts. The results showed that the full length cDNA ofwas 1 446 bp, encoding 482 amino acids. The bioin- formatics analysis showed that isoelectric point of cDOPA 5GT was 5.77, showing an acidic and hydrophilic transmembrane protein without signal peptide. The cDOPA 5GT protein had characteristic motifs of glucosyl- transferase, and the secondary structure was dominant of α-helices and random coils, and the amino acid sequence was less conserved. The results of qRT-PCR and spectrophotometry showed that the expression ofgene and betacyanin accumulation in plants decreased significantly under shading by qRT-PCR and spectro- photometry. Therefore, it was suggested that the synthesis of betacyanin was regulated by glucosyltransferase gene, and positively correlated with light time.
; Cyclo-DOPA-5-glucosyltransferase; Gene expression; Illumination
10.11926/jtsb.4233
2020–04–10
2020–06–10
四川省國際科技合作項目(2019YFH0136)資助
This work was supported by the Cooperation Project of International Science and Technology in Sichuan (Grant No. 2019YFH0136).
劉姍(1980~ ),女,博士,副教授,從事植物生物技術研究。E-mail: liushan@pzhu.edu.cn

