肥大細胞在脂肪組織中的生理與病理作用*
齊睿娟, 高 源, 齊 云
(中國醫學科學院&北京協和醫學院藥用植物研究所,北京100193)
脂肪組織可分為白色脂肪組織(white adipose tissue,WAT)與棕色脂肪組織(brown adipose tissue,BAT)。WAT 行使能量儲存功能,將人體多余的能量以化學能形式儲存,而BAT則具有產熱功能,在寒冷等刺激下將化學能轉化為熱能,以維持體溫。脂肪組織同時還具有內分泌功能,可分泌多種激素、細胞因子和代謝產物(統稱為脂肪因子),通過調節來自中樞神經系統的進食信號以及周圍組織的代謝活性來控制機體的能量平衡。脂肪組織的生成、發展及生物學功能的實現,除了與脂肪細胞有關外,還有賴于構成其內部高度異質性的其他類型細胞,如前脂肪細胞、脂肪細胞祖細胞、血管內皮細胞、成纖維細胞、巨噬細胞、T 細胞、肥大細胞(mast cells,MCs)等[1]。其中,MCs 在脂肪組織中的生理病理作用近年來逐漸為學界所重視。
MCs 是一種重要的免疫細胞,來源于多能造血祖細胞,經血液循環遷移至外周組織中,并在不同組織中分化、成熟與定居。傳統認為,MCs僅與微生物感染和過敏反應關系密切,但事實上,MCs的功能不止于此。由于其分布廣泛,MCs 還能參與到與周圍組織相關的多項生理病理過程中,如血管生成和組織重塑等[2]。近年來,脂肪組織中MCs 的生理與病理作用引起了學界的廣泛關注。Gurung 等[3]研究顯示,在代謝綜合征患者皮下脂肪組織中,單位面積內的MCs 數目是正常人群的4.5 倍,并且伴隨著MCs數目的增加,MCs 活化程度也顯著升高[3]。這一差異提示MCs 可能在脂肪組織中發揮關鍵生物學效應,并且與肥胖等代謝性疾病的發生有關。
基于上述差異,研究人員還觀察到機體不同部位的脂肪組織中MCs 數目也有所不同[4]。雖然在肥胖人群與正常人群的皮下和內臟脂肪組織中均能觀察到MCs 數目的顯著差異,但肥胖小鼠與正常小鼠的MCs 數目差異卻只集中在內臟脂肪組織中,其皮下脂肪組織中MCs 數目差異并不顯著[4]。這些研究證據均提示脂肪組織MCs應當對脂肪組織內部功能有不可忽視的影響。因此,探究脂肪組織中MCs 的生理與病理作用,對深入理解脂肪組織功能至關重要,并且為后續開發針對肥胖等代謝性疾病的臨床干預手段提供了參考資料。
1 脂肪組織中的MCs的生理作用
1.1 促進脂肪細胞的增殖分化 脂肪細胞增殖分化是指前脂肪細胞進入細胞周期分化為成熟脂肪細胞的過程,其目的是通過增加功能正常的脂肪細胞數量來容納脂質,在滿足能量存儲需要的同時避免單個脂肪細胞壞死。
敲除MCs可抑制脂肪增殖分化。Ishijima 等[5]檢測到MCs敲除會引起脂肪組織中Ap2,Pparg,Acsl1與Adipsin等成熟脂肪細胞特異性基因的表達下降,而與此同時Pref1,Aebp1與Gata2等前脂肪細胞特異性基因表達水平顯著增加,說明抑制MCs 可引起脂肪組織中前脂肪細胞的累積。值得注意的是Pref1,Aebp1與Gata2所表達出的蛋白質產物又可抑制前脂肪細胞向脂肪細胞的分化,抑制脂肪細胞的增殖[6-8],提示MCs在脂肪增殖分化這一過程中具有正向調控作用。
Tanaka 等[9]則闡明了 MCs 是通過分泌前列腺素D2(prostaglandin D2,PGD2)來促進脂肪的分化,其機制在于PGD2的代謝產物deoxy-delta-12,14-PGJ2是過氧化物酶增殖體激活受體γ(peroxisome proliferator-activated receptor γ,PPARγ)的天然配體,可直接激活PPARγ,啟動下游成脂基因的表達,并增加細胞對外周游離脂肪酸的攝取,促進脂質生成。此項研究觀察到含有deoxy-delta-12,14-PGJ2的MCs培養上清可誘導3T3-L1 前脂肪細胞的分化,且此效應可被特異性的PPARγ 拮抗劑GW9662 所阻斷[9]。該研究的體內結果也顯示KitW/Wv小鼠體重在移入野生型小鼠的骨髓源MCs(bone marrow MCs,BMMCs)后可出現顯著增加,而在移入敲除造血PGD 合酶(hematopoietic PGD synthase,H-PGDS)小鼠的BMMCs 后則無顯著變化,H-PGDS缺失小鼠BMMCs 的培養上清也無法誘導3T3-L1 前脂肪細胞的分化[9],進一步證實 MCs 主要通過PGD2促進脂肪細胞分化成熟。
1.2 促進血管生成 伴隨著脂肪細胞的分化,脂肪組織快速擴張,其內部對氧氣的強烈需求會觸發血管新生,即在原有毛細血管基礎上通過血管內皮細胞的增殖和遷移,形成新的分支,再延展形成新的脈管網絡。新建的脈管網絡能通過維持充足的血流為脂肪組織擴張提供氧氣、營養物質等必要的物質條件[10]。
血管新生起始于脂肪組織內細胞外基質(extracellular matrix,ECM)的降解和促血管生成因子的釋放[11]。研究顯示,MCs 能通過分泌蛋白酶類物質水解ECM 的組分(如IV 型和V 型膠原,纖維連接蛋白及蛋白聚糖等)來促進血管新生,如分泌的類胰蛋白酶與類糜蛋白酶能分別降解VI型和V型膠原并激活膠原酶,組織蛋白酶G 能水解纖連蛋白,基質金屬蛋白酶3(matrix metalloproteinase-3,MMP-3)和MMP-9能降解組織蛋白聚糖等[12]。Liu 等[13]也觀察到 MCs還能分泌白細胞介素6(interleukin-6,IL-6)和干擾素γ(interferon-γ,IFN-γ)來誘導血管內皮細胞與血管平滑肌細胞表達多種高活性的組織蛋白酶(如組織蛋白酶B、S 與L 等),間接促進ECM 水解,且其中的組織蛋白酶S 還能分泌相應的促血管生成因子,協同促進血管新生[14]。
1.3 調控脂肪組織褐變 BAT 可將化學能轉化為熱能,其特點在于細胞內含有大量的線粒體,且線粒體內膜可特異性表達解偶聯蛋白1(uncoupling protein 1,UCP1),介導氧化磷酸化解偶聯,使物質氧化產生的化學能以熱能形式散失[15]。同時BAT可將游離脂肪酸及葡萄糖作為產熱耗能的底物,促進脂肪分解,在維持能量代謝平衡方面也有一定作用。而WAT 在某些因素刺激下,如低溫、運動、輔助T 細胞2(T helper cell 2,Th2)型細胞因子等,其線粒體內膜上也會大量表達UCP1,從而分化出一種類似于棕色脂肪細胞的米色脂肪細胞,這一生理過程叫做“WAT 的褐變”[16]。同棕色脂肪細胞相似,米色脂肪細胞主要通過UCP1 將游離脂肪酸與葡萄糖轉化為熱能[17],多項研究也已證實其能參與維持能量穩態及脂肪代謝[18-20]。可以說棕色脂肪細胞與米色脂肪細胞共同參與調節機體脂解產熱與能量穩態的維持。
1.3.1 低溫刺激下促進脂肪組織褐變 生理條件下,低溫刺激能增加人皮下脂肪細胞中UCP1 的表達,促進脂肪褐變,增加產熱。此現象具有季節性,冬季更易發生。人脂肪組織內MCs 也能感受寒冷信號,在冬季活性更高,可釋放組胺和IL-4 等直接促進脂肪褐變[21]。研究顯示,正常人冰敷一側大腿連續10 d 后,該側皮下WAT 內的MCs 數目與活化程度較對照側均顯著增加,且脂肪細胞上組胺受體數量也顯著增加[22]。MCs 釋放的組胺可激活脂肪細胞的組胺受體,升高胞內環磷酸腺苷(cyclic ade-nosine monophosphate,cAMP),激活cAMP 依賴的蛋白激酶A(cAMP-dependent protein kinase A,PKA),活化的PKA 進一步磷酸化下游靶蛋白,引起胞內甘油三酯分解并促進UCP1 的表達,直接誘導米色脂肪的生成。此外,對照側皮下WAT 中的MCs 活化水平也較實驗初始水平顯著升高,其原因或與交感神經的激活有關。經典生理學理論認為BAT 或米色脂肪產熱主要由神經系統支配,通過交感神經分泌的去甲腎上腺素(norepinephrine,NE),作用于棕色或米色脂肪細胞的β-腎上腺素能受體誘導脂解產熱。而MCs 本身也可表達β-腎上腺素能受體,經NE 刺激后即可脫顆粒,分泌組胺[23]。反過來,組胺又進一步通過組胺受體激活脂肪組織中的交感神經,提高其對低溫的敏感性[24]。組胺還可以通過擴張BAT 中的血管以增加其血流量來間接刺激產熱[25]。
除組胺外,以IL-4 為代表的Th2 型細胞因子也是一種重要的促脂肪褐變生物介質。IL-4 一方面可通過作用于血小板源性生長因子受體α(platelet-derived growth factor receptor α,PDGFRα)陽性脂肪前體細胞膜上的IL-4受體α,引發胞內信號轉導及轉錄激活蛋白6(signal transducer and activator of transcription 6,STAT6)的氧化磷酸化,進而促使PDGFRα 陽性脂肪前體細胞增殖并向米色前體脂肪細胞分化,刺激米色脂肪的生成[26];另一方面,IL-4可通過刺激巨噬細胞等其他類型的免疫細胞來間接影響產熱[24]。有研究還指出IL-4或能通過PKA 通路與組胺協同促進脂解[25]。在人皮下脂肪組織中,UCP1 的表達水平與IL-4 及MCs 標志物羧肽酶A3(carboxypeptidase A3,CPA3)的表達水平高度相關,提示寒冷刺激下人皮下脂肪組織中的MCs可能才是IL-4的主要來源[21]。
1.3.2 室溫或熱中性條件下抑制脂肪組織褐變非低溫刺激條件下,MCs 活化反而抑制小鼠脂肪褐變。Liu 等[13]最初檢測到高脂飲食的KitW-sh/W-sh小鼠或經色苷酸鈉干預的野生型小鼠在室溫(18~22℃)條件下的基礎代謝率顯著高于對照組小鼠,其耗氧量與CO2釋放量及其皮下脂肪組織中的UCP1 表達也顯著高于對照組,提示抑制MCs 功能可促進脂肪褐變并改善機體能量代謝。Zhang 等[27]繼而觀察到即使在非高脂的普通喂養條件下,抑制MCs 功能就可增加小鼠皮下脂肪細胞中Ucp1、Cidea、Elovl3等產熱基因的表達,且能促進PDGFRα 陽性雙潛能脂肪前體細胞的增殖及其向米色前體脂肪細胞方向的分化。
MCs 來源的 5-羥色胺(5-hydroxytryptamine,5-HT)是調控小鼠皮下脂肪褐變與能量代謝的關鍵介質。5-HT 是一種重要的能量調節物質,可由中樞或外周的多種細胞分泌。外周的5-HT 由色氨酸羥化酶1(tryptophan hydroxylase 1,Tph1)合成,而Crane等[28]利用Tph1-/-小鼠觀察到外周5-HT的缺失能直接促進棕色與米色脂肪細胞中UCP1 的表達,提示Tph1可影響UCP1的表達。
Zhang 等[27]則進一步指出只有 MCs 中的 Tph1 才是調控脂肪組織內UCP1表達的關鍵,該研究比較了KitW-sh/W-sh小鼠在植入正常或Tph1-/-BMMCs后,皮下組織中UCP1 的表達情況。結果顯示,植入正常BMMCs 后,KitW-sh/W-sh小鼠組織中的UCP1 顯著下降,而植入Tph1-/-BMMCs 后,KitW-sh/W-sh小鼠組織中的UCP1 表達則顯著升高,提示MCs 內的Tph1 對脂肪褐變與熱生成有抑制作用。Yabut 等[29]在熱中性(29~30℃)條件下也觀察到了這一點,并在此基礎上,進一步設計雜交獲得了MCs 選擇性Tph1缺失的KitTph1-/-小鼠模型,檢測到KitTph1-/-小鼠的UCP-1 表達較對照組高,補充證實了是MCs 內的Tph1 對脂肪褐變與熱生成有直接抑制作用[30],確定了MCs 內的Tph1是調控脂肪褐變的關鍵靶點。
上述兩方面的研究結果表明,MCs 受溫度影響可呈現出對脂肪組織褐變截然相反的作用,通過分泌功能不同的生物介質達到相反的效果。MCs 對低溫敏感,在寒冷刺激下,MCs 可通過NE 分泌組胺及IL-4 等促脂肪褐變介質,協助機體產熱,維持體溫;而在非低溫環境下,機體無產熱需要,MCs則通過內部的Tph1-5-HT 軸分泌5-HT 抑制脂肪褐變,防止能量以熱的形式過度耗散,推測其背后的進化機制在于機體減少不必要的能量消耗,節省細胞內底物,以便為MCs發揮其他免疫學功能(如抵御微生物)留備充足的物質條件。當然,這其中仍有許多問題尚未有定論,如MCs 分泌5-HT 影響UCP1 的具體分子機制,5-HT 是否還對其他非UCP1 介導的產熱機制存在影響以及此現象是否能在人體中重現等,亟待后續研究闡明。
2 脂肪組織中的MCs的病理作用
2.1 影響脂肪組織內分泌模式 脂肪組織也是一個內分泌器官,可合成并分泌多種脂肪因子[31]。這些脂肪因子可以在脂肪組織局部起作用,也可以釋放到體循環對遠處的器官或組織產生作用。而脂肪過度堆積會破壞脂肪組織正常的內分泌模式,導致脂肪因子分泌失衡,促炎細胞因子分泌增多。
2.1.1 抑制脂聯素(adiponectin)分泌 脂聯素主要由脂肪細胞分泌,是PPARγ 重要的激動因子,目前被認為是已知脂肪因子中最強的胰島素增敏劑[32]。有研究指出MCs的類糜蛋白酶能通過抑制脂聯素的表達而對葡萄糖代謝產生負面影響[33]。在肥胖患者的血漿中脂聯素的濃度往往偏低,但研究人員并未在抑制MCs功能后檢測到肥胖患者或小鼠血漿中脂聯素水平的升高,只有在喂養高脂飼料的KitW/Wv小鼠脂肪組織中觀察到了脂聯素mRNA 表達升高的情況[10,34-35]。
2.1.2 影響瘦素(leptin)的生成與分泌 瘦素主要由脂肪細胞分泌,可發揮抑制食欲及刺激能量消耗的作用,被認為是機體調控體重的主要活性因子之一[36]。然而,肥胖患者體內瘦素水平遠高于常人,卻不能發揮抑制食欲或降低體重的作用[37],這種現象稱之為“瘦素抵抗”,其發生原因可能與瘦素受體有關的細胞信號轉導缺陷等有關,但其具體分子機制尚不完全清楚[37]。有臨床研究在代謝綜合征患者皮下脂肪組織中觀察到,組織中MCs 的數量與血液中瘦素的含量呈正相關[3]。而動物實驗結果也顯示,抑制MCs 功能可降低肥胖小鼠血液中的瘦素水平[38]。關于MCs 功能與瘦素抵抗發生、發展背后的具體機制開展的研究則相對較少,亟待進一步闡明。
2.1.3 促進其他炎癥因子的生成與釋放 多項臨床研究顯示,病理性肥胖患者的脂肪組織中MCs 的數量及活化水平與脂肪組織炎癥有關。脂肪組織中的MCs 可釋放大量促炎細胞因子,如IL-1β、IL-6、單核細胞趨化蛋白1(monocyte chemotactic protein 1,MCP-1)等[30,39]。而在喂養高脂飲食的KitW-sh/W-sh小鼠血液與脂肪組織中,IL-6、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、IFN-γ 和 MCP-1 都顯著降低,其中IL-6和IFN-γ可能是MCs調節機體脂質代謝的關鍵介質[13]。另有研究顯示,肥胖小鼠附睪脂肪組織中有大量MCs 可合成并釋放TNF-α,且不同部位脂肪組織的MCs 對TNF-α 的敏感性不同,內臟脂肪細胞的敏感性要高于皮下脂肪組織[40]。此研究結果可部分解釋“皮下脂肪組織不易出現脂肪組織炎癥”這一現象。
2.2 增加炎癥細胞的浸潤 正常脂肪組織中本身含有部分駐地巨噬細胞,約占脂肪組織所有細胞的10%~15%[41],其中大部分巨噬細胞表現為抗炎型(M2 型),僅一小部分為促炎型(M1 型)。而在病理狀態下,脂肪過度累積導致脂肪細胞壞死,炎癥因子如IL-6 和MCP-1 等釋放增加,更多的單核細胞被招募進入脂肪組織,并向M1 型巨噬細胞分化,使巨噬細胞數量急劇增加,可達脂肪組織細胞總數量的45%~60%[42],且組織內駐地巨噬細胞的主要表型也由抗炎的M2 型轉換為促炎的M1 型。大幅增加的M1 型巨噬細胞會圍繞在壞死的脂肪細胞周圍,吞噬脂滴,形成“冠狀樣結構(crown-like structures)”,這是脂肪組織炎癥的典型病理標志。
MCs 可影響單核細胞浸潤。有研究觀察到,肥胖小鼠WAT 中的巨噬細胞數量在MCs 膜穩定劑色苷酸鈉干預后可顯著減少,而MCs 數量則無顯著變化,提示WAT 中MCs 可驅動單核細胞的浸潤,其分泌的MCP-1 則可能是調節單核細胞浸潤的關鍵趨化因子之一[13,41]。2019 年一項臨床研究也顯示,在代謝綜合征早期(未發展至2 型糖尿病或動脈粥樣硬化)患者的皮下脂肪組織中已經出現大量MCs,其數量與血液單核細胞的活化水平高度相關[4]。而同年一項對小鼠附睪WAT 內免疫細胞變化的動態分析進一步支持了這一觀點,在高脂飼料連續喂養20 周的觀察周期內,Fc?RIa+MCs 自始至終是脂肪組織內的主要免疫細胞之一,其數量在4 周時達到總免疫細胞的(39.5±2.8)%,而M1 型巨噬細胞同期卻僅占約1.4%。直至肥胖發展中后期(12 周后),M1 型巨噬細胞才逐漸與MCs 共同成為脂肪組織中的主要免疫細胞[38]。另外,MCs 除自身分泌MCP-1 外,還可以促進脂肪組織中血管內皮細胞分泌MCP-1。研究者將正常人WAT 中的血管內皮細胞與MCs 分別培養,后將血管內皮細胞的培養上清液置換為MCs 的上清液,結果顯示相比于未更換為MCs 上清的對照組血管內皮細胞而言,經MCs 上清培養后的血管內皮細胞分泌的MCP-1 增加了5倍[30]。這些結果提示 MCs 可能是驅動 M1 型巨噬細胞浸潤的關鍵因素之一。
2.3 加劇脂肪組織的纖維化 脂肪組織纖維化是指脂肪組織中細胞外基質成分過分聚集這一病理現象,脂肪過度堆積所引發的脂肪組織慢性低度炎癥以及缺氧微環境是導致脂肪纖維化形成的主要原因[37]。脂肪組織纖維化會降低脂肪組織彈性,限制脂肪組織體積,是脂肪組織代謝功能紊亂的標志。
研究顯示,脂肪組織內膠原蛋白的累積與脂肪組織內 MCs 數量高度相關[4],提示 MCs 或可促進脂肪纖維化。滲入脂肪組織的未成熟MCs可隨組織擴張而逐漸成熟,不斷分泌轉化生長因子β(transforming growth factor-β,TGF-β)、血管內皮生長因子(vascular endothelial growth factor,VEGF)、腎素、TNF-α、類胰蛋白酶與類糜蛋白酶等生物介質,共同促進成纖維細胞生長和基質膠原合成,促進纖維化發生[43]。如MCs 分泌的肥大細胞蛋白酶6(mast cell protease 6,MCP-6)可誘導脂肪組織中成纖維細胞V型膠原的表達[44];分泌的類胰蛋白酶可通過環氧合酶2 來激活蛋白酶活化受體2(protease-activated receptor 2,PAR2),調節絲裂素活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路,引起纖維化[45];其分泌的類糜蛋白酶和組織蛋白酶G 既可以將血管緊張素I轉換為血管緊張素Ⅱ,又可以刺激MMP-9 并激活TGF-β 誘導下游通路來增強纖維化[46-47]。另一方面,纖維化微環境本身又會改變浸潤其中的MCs的分泌模式,使其轉變為促炎表型,分泌出更多的IL-6、IL-1β、MCP-1 等炎癥因子,加劇組織內部炎癥的同時,反過來又強化了脂肪組織的纖維化程度[30]。
2.4 參與胰島素抵抗 在代謝綜合征輕早期患者的皮下脂肪組織中,Altintas 等[4]發現MCs 數量與脂肪組織胰島素抵抗指數和穩定模型評估胰島素抵抗指數呈正相關,認為MCs 可以通過長期釋放IL-6和IL-1β 等關鍵介質引發胰島素抵抗。另有臨床研究指出,胰島素增敏劑吡格列酮可減少胰島素抵抗患者脂肪細胞中 MCs 的數量[48]。而 Einwallner 等[39]在重度肥胖癥患者(體重指數>40 kg/m2)的脂肪組織中卻并未觀察到MCs 數量與機體胰島素敏感性之間存在明顯關系。上述觀察結果的不同可能與其選擇的研究對象肥胖程度有關。脂肪組織中的MCs 與機體胰島素的敏感性之間的具體關系需要深入研究。
2.4.1 MCs穩定劑在2型糖尿病及其并發癥中的作用 肥胖引起的胰島素抵抗也是2 型糖尿病發生發展的重要環節。Liu 等[13]首先報道了 MCs 直接參與小鼠2 型糖尿病的發生發展,指出酮替芬或色苷酸鈉干預可有效改善肥胖的2 型糖尿病模型小鼠的葡萄糖耐量與胰島素敏感性;而臨床研究也曾觀察到色苷酸鈉鼻噴霧吸入治療可以顯著降低哮喘患者的體重[49]。Shi等[50]繼而在2型糖尿病患者的身上色苷酸鈉治療可在6 個月內將患者血糖和糖化血紅蛋白水平降低至正常范圍內。2015 年,另一項以肥胖的2型糖尿病患者為樣本的臨床研究表明,降血糖藥聯合使用酮替芬每日兩次可顯著降低患者的空腹血糖、血液總膽固醇、低密度脂蛋白和甘油三酯的水平,并同時觀察到血液中MCP-1、IL-6、白三烯B4(leukotriene B4,LTB4)等炎癥因子的水平也顯著降低[35]。
也有研究觀察了MCs 穩定劑在與糖尿病并發癥中的作用。糖尿病腎病是以腎小球基底膜增厚、血管擴張為特征的多期臨床綜合征,是一種常見的糖尿病并發癥,其患者的腎間質中含有大量MCs。體內實驗顯示,使用MCs 穩定劑曲尼斯特可顯著減少糖尿病腎病大鼠腎小管間質的纖維化,改善腎小管萎縮和蛋白尿的情況[51],延緩腎病的進一步惡化。而在鏈脲佐菌素(streptozocin,STZ)致糖尿病大鼠模型中則顯示,曲尼斯特可減輕其腸系膜重量,降低血管壁基質中TGF-β 的含量與膠原蛋白的堆積,從而改善血管壁過厚的情況[52]。值得注意的是,曲尼斯特也具有穩定MCs 膜以外的其他作用,故其主要作用機制還需更多基礎與臨床研究予以闡明。
2.4.2 不同基因缺陷動物模型中MCs 與胰島素抵抗的關系 學界也有研究團隊基于不同遺傳背景的動物模型對脂肪組織中的MCs與機體胰島素抵抗的關系提出了相反的觀點。不同于常見的KitW/Wv或KitW-sh/W-sh(c-Kit)缺陷小鼠模型,Gutierrez 等[53]發現Cpa3Cre/+(c-Kit非依賴性)MCs 缺失小鼠及其對照組Cpa3+/+小鼠共同喂養高脂飼料后,兩者在體重、全身脂肪含量及葡萄糖耐量方面均沒有顯著差別,也沒有觀察到色甘酸鈉對小鼠體重、葡萄糖耐量和胰島素敏感性的改善作用。無獨有偶,Chmelar等[54]在另一c-Kit非依賴性的Mcpt5-Cre R-DTA+MCs 缺失小鼠模型上也得到了與Gutierrez 等[54]同樣的結論,即相比于MCs 缺失,c-Kit缺失所引起的造血系統缺陷及其導致的機體其他免疫細胞相對水平的變化更可能是改善高脂飲食引起的胰島素抵抗的原因。上述2個團隊各自雖基于不同遺傳背景的動物模型反駁了Liu等[13]基于c-Kit缺陷的動物模型所提出的觀點,但無法從根本上解釋喂養高脂飼料KitW-sh/W-sh小鼠在植入野生型小鼠BMMCs 后,體重增加、胰島素敏感性減弱、代謝表型趨于肥胖野生型小鼠這些現象的原因。另外需要指出的是,Gutierrez 等[53]與 Chmelar等[54]建立DIO 模型所采用的飼料成分在膽固醇含量方面與前期研究的存在顯著差別,他們使用的高脂飼料并不含膽固醇,而Liu等[13]所使用的飼料則是高膽固醇含量。而研究顯示,與食用高膽固醇高脂飼料的小鼠相比,食用不含膽固醇高脂飼料的小鼠局部(脂肪組織內)和全身的MCs 活化水平顯著更低,提示飲食中的膽固醇或可干擾MCs 的活化水平,其含量的差異有可能造成了不同研究中動物代謝表型的差異,從而影響了最終結論的準確得出[55]。故仍需在嚴格一致的實驗條件下開展更多的基礎研究以闡明脂肪組織MCs在機體胰島素抵抗中的作用。
3 展望
MCs 通過分泌功能不同的生物介質,在生理與病理2 個方面參與調節脂肪組織功能(圖1)。脂肪組織MCs的生理意義主要體現在其能促進脂肪細胞分化、組織血管生成以及調控脂肪組織褐變。而脂肪組織MCs 的病理意義,則是反映在其能影響脂肪組織內分泌模式、驅動炎癥細胞的浸潤、加劇脂肪組織纖維化,以及影響機體胰島素敏感性等方面,能參與肥胖和代謝綜合征的發生發展。
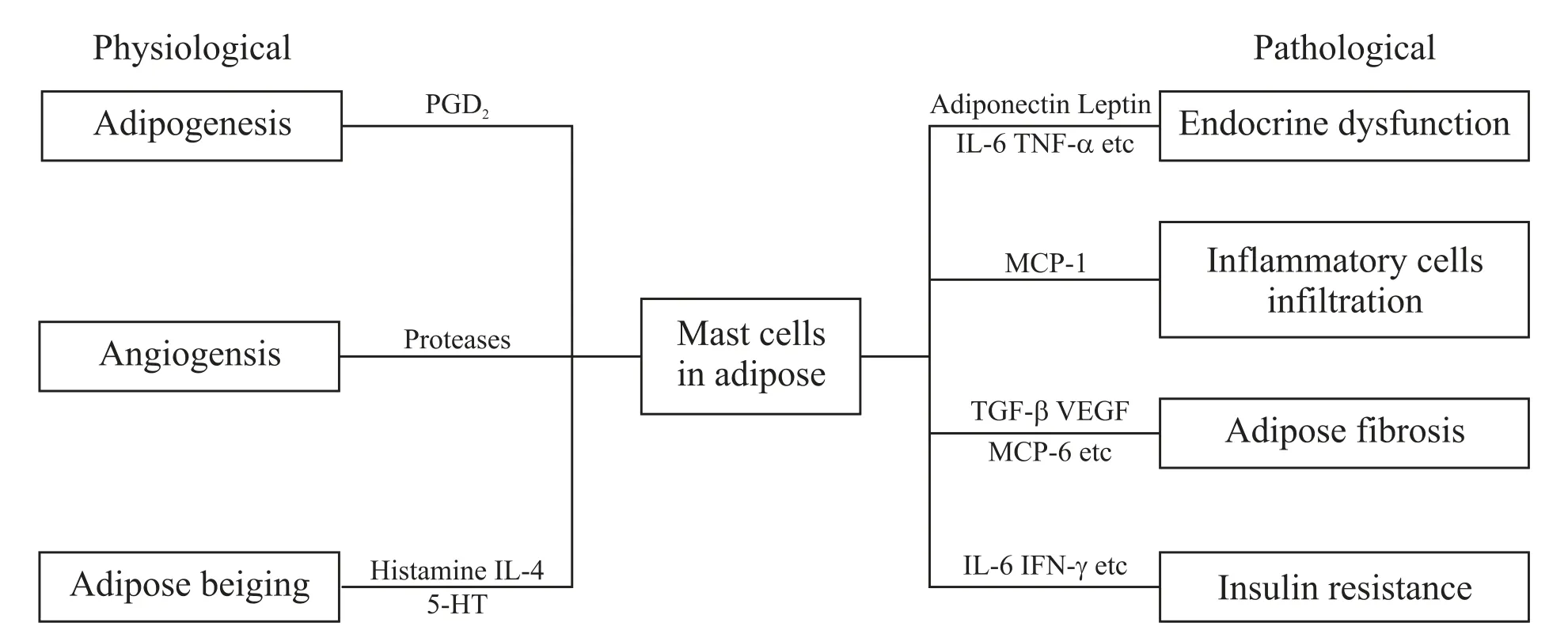
Figure1.The physiological and pathological role of MCs in adipose tissue.圖1 MCs在脂肪組織中的生理與病理作用
盡管目前有多項證據表明在嚙齒類動物肥胖模型中,穩定MCs 對控制肥胖以及2 型糖尿病,改善糖脂代謝有顯著效果,但其使用的MCs 缺失模型都是基于c-Kit突變的基因小鼠模型,而當不同的研究者采用不影響c-Kit的其他MCs 缺失模型時(Cpa3Cre/+或Mcpt5-Cre R-DTA+),卻無法重現MCs 對體重與糖脂代謝的作用[53-54]。這種結果差異有可能與模型試驗條件的不同有關,也可能與MCs 本身的功能多樣性有關,其可能通過分泌功能不同的特定生物活性物質參與機體糖脂代謝,而僅單純抑制MCs 整體功能的思路其實無法反映這當中某種關鍵介質的病理作用。
未來需要更多的基礎與臨床研究以闡明MCs 與脂肪組織中其他細胞之間的相互作用,脂肪組織MCs 在脂肪組織慢性炎癥、胰島素抵抗與能量代謝轉化中發揮主要作用的關鍵介質及其具體分子機制等問題。只有深入研究才有可能發現潛在的生理病理作用機制,從而為臨床防治開拓新的思路。

