惡性胸膜間皮瘤合并肺結核/結核性胸腔積液的臨床特征分析
陽苑 胡明明 魯葆華 張同梅 聶文娟 李寶蘭
首都醫科大學附屬北京胸科醫院綜合科101149
惡性胸膜間皮瘤(malignant pleural mesothelioma,MPM)為臨床罕見的惡性腫瘤,MPM合并胸腔積液占60%~90%[1]。因其起病隱匿,臨床特征及影像表現缺乏特異性,常誤診為結核性胸腔積液(tuberculous pleural effusion,TPE)、肺惡性腫瘤胸膜轉移、非特異性胸腔積液等。MPM合并惡性胸腔積液與肺結核/TPE尤其難于鑒別,總體誤診率高達48.6%[2]。
既往肺結核/TPE基礎上發生MPM的臨床表現復雜,容易誤診為肺結核/TPE復發。但目前尚無報道MPM合并肺結核/TPE的臨床特點,故本研究回顧性分析MPM合并肺結核/TPE 14例,期望加強對該類疾病的認識。
1 對象與方法
1.1 研究對象 收集首都醫科大學附屬北京胸科醫院2012年2月至2020年2月經組織病理學確診的MPM患者85例。篩查后本研究共納入MPM合并肺結核/TPE患者14例。其中合并活動性TPE 4例,經胸腔積液結核分枝桿菌(mycobacterium tuberculosis,MTB)Xpert/RIF陽性確診;合并活動性肺結核1例,經痰MTB培養陽性確診;合并既往結核病史9例,均符合以下標準:(1)既往確診肺結核/TPE;(2)曾規律抗結核治療6個月以上,復查病灶吸收好轉。本研究通過首都醫科大學附屬北京胸科醫院倫理委員會審批[(2020)年-科研-臨審第(23)號]。
1.2 研究方法 收集14例患者信息,包括血清/胸腔積液γ干擾素釋放實驗;血清/胸腔積液結核菌抗體;痰/胸腔積液/支氣管鏡灌洗液/胸膜活檢X-pert;痰/血清/胸水MTB核酸擴增;痰/胸腔積液/支氣管鏡灌洗液涂片抗酸桿菌鏡檢、痰/血清/胸腔積液結核菌培養;胸腔積液常規、生化;血清/胸腔積液中腫瘤標志物癌胚抗原(carcinoembryonic antigen,CEA)、神經元特異性烯醇化酶(neuron specific enolas,NSE)、胃泌素釋放肽前體(pro-gastrin releasing peptide,pro-GRP)、鱗癌抗原(squamous cell carcinoma antigen,SCC)、細胞角蛋白21-1片段(cytokeratin fragment 21-1,CYFRA21-1),胸部CT掃描;胸腔積液沉淀包埋/CT引導下胸膜穿刺/內科胸腔鏡下胸膜活檢組織病理檢查。
1.3 統計學分析 應用SPSS 19.0描述統計,分析各參數百分比及分布特點。
2 結果
2.1 病史及基本信息 14例患者中2例患者有既往石棉接觸史,另有1例既往于當地專科醫院確診矽肺,其余11例患者均無石棉等特殊接觸史;男女比例均等,各占50%;年齡(59.15±16.82)歲,年齡范圍為21~87歲。見表1。

表1 14例惡性胸膜間皮瘤合并肺結核/TPE患者基本特征及臨床表現
2.2 癥狀及體征 14例患者中12例合并胸腔積液,以不同程度的胸悶、胸痛、咳嗽等為主要癥狀;起病時呈低、中度發熱,合并感染時高熱。體征包括患側呼吸音減低、消失,患側胸廓縮窄等。見圖1、表1。
2.3 實驗室檢查 (1)胸水常規及生化:12例胸腔積液標本淡黃色至深黃色多見(83.3%),血性少見(16.7%)。胸水性質均為滲出液,且呈單核細胞優勢(單核細胞百分比≥75%);僅1例合并感染的患者,多核細胞比例明顯升高。(2)胸水的生物標志物:11例患者送檢了胸腔積液腺苷脫氨酶(adenosine deaminase,ADA),3例MPM合并活動性TPE患者ADA升高,8例肺結核/既往確診TPE的MPM患者ADA正常。從腫瘤標志物分析,11例MPM合并肺結核/TPE患者血液/胸腔積液中CEA均陰性(100%),CYFRA21-1升高8例(72.7%)。見表2。
2.4 影像表現 所有患者胸部增強CT表現見表3。7例既往結核性胸膜炎患者中有6例在同側出現MPM所致的胸腔積液;4例MPM合并活動性TPE患者病灶位于同側。胸部CT表現為胸膜不規則環形增厚,結節、腫塊樣增厚,胸膜不規則強化;胸腔積液以包裹性積液多見。MPM合并既往肺結核患者可見索條、纖維硬結灶,肺實變灶,胸膜鈣化灶。本文1例患者完成了PET/CT檢查,表現為單側胸膜不均勻環形增厚伴代謝異常增高,患側胸腔包裹性積液;PET/CT影像考慮惡性病變,后經穿刺證實為MPM。

表2 14例惡性胸膜間皮瘤合并肺結核/結核性胸腔積液患者實驗室檢查結果
3 討論
結核病是嚴重威脅全人類的公共衛生問題,我國結核發病率居世界第二[3],約30%肺結核患者合并TPE[4-5]。MPM則為罕見的胸部惡性腫瘤,發病率約0.3/10萬至0.5/10萬[6]。

圖1 MPM合并肺結核/結核性胸腔積液患者的影像表現 A:MPM胸膜不規則環形增厚(縱隔窗);B:MPM胸膜結節、腫塊樣增厚,雙肺轉移灶(肺窗);C:MPM肺對側索條、纖維硬結灶及肺實變病灶(肺窗);D:胸腔積液為包裹性積液(縱隔窗);E:患側胸廓縮窄(肺窗)F:MPM并雙側胸膜鈣化(縱隔窗)
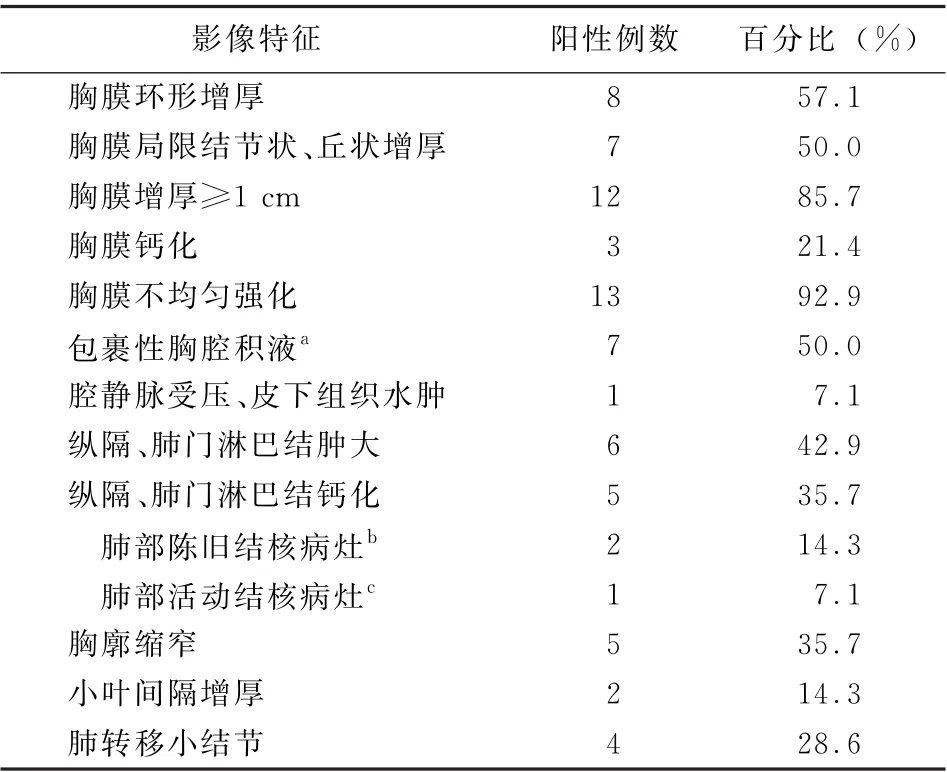
表3 14例惡性胸膜間皮瘤合并肺結核/結核性胸腔積液患者胸部增強CT表現
魏星和楊淑苓[7]報道,22例MPM中3例(13.6%)既往有同側肺結核病史;王志剛和丁紅[2]發現,17例MPM中有2例(11.8%)既往確診并治愈的肺結核患者。本文所篩查的85例MPM中,MPM合并明確結核病史/活動性結核病的患者14例,占16.5%,與既往文獻基本一致。本研究中7例既往TPE患者中,6例MPM發生于結核性胸膜炎同側;4例活動性TPE者伴發MPM也均位于患病同側。既往研究也表明,結核病、化學性肺炎、病毒性感染等慢性病均可并發惡性間皮瘤[8],故結核等慢性炎癥可能是MPM的易患因素。
從臨床癥狀來看,MPM以胸痛、胸悶、咳嗽多見[9];TPE也主要表現為胸腔積液引起的咳嗽、咳痰、胸痛、呼吸困難[10]。MPM患者可因腫瘤消耗出現乏力、食欲不振,因合并感染引起發熱,同結核病的發熱、乏力、盜汗等結核中毒癥狀仍難以鑒別。具有提示意義的臨床表現在于:兩病并存的患者中有7例胸痛呈進行性加重,需嗎啡等藥物解救,胸痛不隨胸腔積液增多而減輕;而單純TPE呈輕中度胸痛,伴隨胸腔積液增多時胸痛減輕[11]。
從12例胸腔積液的外觀分析,淡黃色及深黃色者10例(占83.3%),僅2例為血性積液。王志剛等[2]報道,17例確診的MPM患者早期均未見可提示惡性病變的血性胸腔積液,僅2例在發病2~3個月后才變為血性。MPM的積液表現以非血性、滲出性積液為主、單核細胞占優勢,同TPE難以鑒別。
根據既往文獻報道,胸腔積液中CYFRA21-1升高為支持MPM的預測因子,CEA升高為排除MPM的預測因子;CYFRA21-1/CEA的比值高也支持MPM診斷[12-13]。在本文中TPE并發MPM者仍保持胸腔積液中CEA陰性,CYFRA21-1升高的特性。最新的研究發現,TPE患者胸腔積液中IL-27、IL-22濃度顯著高于惡性胸腔積液[14-15],新的生物標志物可能用于鑒別診斷。
從影像表現來看,MPM表現為不規則的胸膜增厚或結節狀增厚,且厚度大于1 cm,呈不均勻強化。該征象掩蓋了既往結核性胸膜炎所致的相對規則的、輕度增厚的胸膜病變[16-17],肺部可見既往的結核病灶及雙側胸膜鈣化[18]。本文1例患者經PET/CT檢查提示為惡性病變,經胸膜穿刺病理證實為MPM。當最大標準攝取值的cut-off值定為2.2時,PET/CT診斷MPM的敏感度和特異度達94.1%和100.0%,且MPM的最大標準攝取值隨臨床分期進展遞增[19-20]。
從病理分析,MPM胸腔積液中可發現異型細胞,陽性率20%~24%[2]。但MPM的細胞形態具多樣性,與胸膜轉移性腺癌、纖維肉瘤等難以鑒別[21-22]。本文中2例患者胸腔積液細胞學篩查發現異型細胞,其余患者為胸腔積液未見異型/癌瘤細胞,較既往報道陽性率偏低。12例患者經CT引導下胸膜活檢確診MPM,2例患者經胸腔鏡檢查確診MPM。胸腔鏡下視野清晰,在病灶呈局限性、斑點狀分布者更具優勢,確診率高[23];但胸腔鏡為侵入性檢查,胸膜腔內組織粘連也限制其應用。胸腔鏡下結核性胸膜炎可呈充血水腫型、粘連型、包裹型、壞死型;而MPM的瘤體在胸膜上呈單個或多個鵝卵石樣,質地硬且觸之易出血,或呈大片狀胸膜增厚,如牛板筋樣不易鉗取[24]。
本文中14例患者從出現癥狀到確診MPM的時間為2~7個月,平均確診時間為4.58個月,較無結核病史的患者MPM確診時間延長。分析其原因,當結核病患者再次出現胸部癥狀,胸腔積液呈黃色滲出液、γ-干擾素釋放實驗等陽性時,容易定勢思維予抗結核治療,經1~2個月療效不佳再行胸膜穿刺活檢。其次,肺結核/TPE患者對慢性咳嗽、咳痰、胸悶等癥狀耐受也導致就診時間滯后。
在既往或現患結核病的基礎上發生MPM者,由于MPM臨床癥狀以及實驗室檢查缺乏特異性,易誤診為結核復發。當結核病患者出現劇烈持續的胸痛癥狀,需要警惕合并MPM等惡性腫瘤可能。胸腔積液中腺苷脫氫酶和腫瘤標志物的異常對鑒別診斷有重要價值,胸腔積液中如發現異型細胞需要高度警惕惡性病變,CT定位下胸膜穿刺活檢或者胸腔鏡檢查為確診MPM的重要策略。
利益沖突所有作者均聲明不存在利益沖突

