白酒飲用舒適度動物評價模型優化的研究
趙婉妤,胡力文,呂 鑫,許 欣 *,裴曉方,盧中明,杜禮泉,鄭 敏
(1.四川大學 華西公共衛生學院(華西第四醫院),四川 成都 610041;2.四川省綿陽市豐谷酒業有限責任公司,四川 綿陽 621006)
中國酒文化源遠流長,自酒問世以來,始終作為一種情感交流的載體,展現獨特的消費理念和神奇魅力。隨著社會經濟的發展進步,物質文化水平的提高,人們對白酒的消費更加走向理性化,對白酒品質提出了更高的要求,不僅要滿足飲時激活人體精神,而且更加注重飲后的體征感受,具體來說要“飲時爽口,飲后醉的慢,醒得快,酒后不干口、不上頭”[1-2]。對于白酒飲用舒適度的研究主要方式為專家評判,但人工評判主觀性過強,效率較低。張夢妍等[3]已初步建立白酒飲用舒適度評價模型,根據醉酒昏睡期小鼠的醉酒時間、醒酒時間對白酒飲用舒適度進行了評價,并成功應用于多種白酒的測定,但是由于醉酒階段指標測定的影響因素較多,實驗結果的準確度、精密度較差,因此該評價模型的進一步優化問題亟待解決。目前有研究依據乙醇在體內的代謝差異,將急性醉酒分為三個階段:興奮期、共濟失調期及醉酒昏睡期[4-5],提示針對醉酒不同階段進行研究的可能性,有研究者以此為基礎對白酒飲用舒適度評價模型進行了優化[6]。
在急性醉酒的三個階段中,共濟失調期常伴隨明顯的肢體不穩、動作不協調等癥狀[5]。研究表明,急性醉酒共濟失調是由于過量攝入乙醇造成的腦組織氧化損傷[7],但共濟失調發生機制復雜,影響因素較多,且我國復雜的白酒釀造工藝賦予了酒體除乙醇外的眾多有利微量成分[8]。相比于靜態昏睡期,共濟失調階段動態的行為學表現則更能直觀準確地體現實驗動物的生理狀態,展現白酒飲用舒適度,且目前未見不同白酒對共濟失調效應是否會產生不同影響的研究。故本研究以優化的動物行為學實驗為基礎,結合乙醇代謝、急性損傷、氧化損傷等生理生化指標,在共濟失調階段比較分析不同白酒對醉酒小鼠的影響,探究白酒飲用舒適度評價指標靈敏度,彌補研究空白,為進一步優化白酒飲用舒適度動物評價模型提供數據支撐,奠定實驗基礎,同時對不同白酒導致不同共濟失調效應的原因進行初步探索。
1 材料與方法
1.1 材料與試劑
2種白酒(酒精度48%vol)(編號分別為①號、②號):由四川省綿陽市豐谷酒業有限公司提供,主要理化指標分析結果見表1。
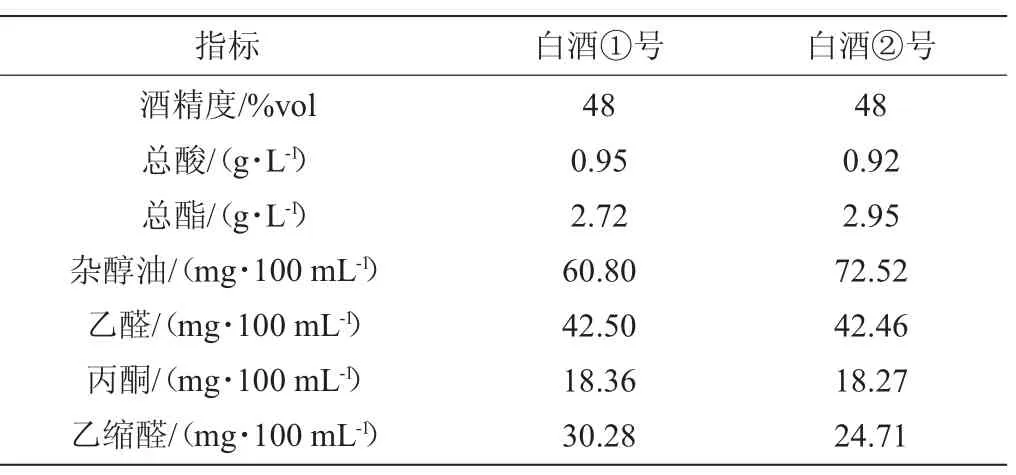
表1 2種白酒主要理化指標分析結果Table 1 Results of main physical and chemical indexes analysis of 2 Baijiu samples
無特定病原體(specific pathogen free,SPF)級Balb/c小鼠(雄性,日齡(42~48 d)):由北京維通利華實驗動物有限技術公司提供(許可證號:SCXK(京)2016-0011)。獨立通風籠具(individually wentilate cagesdul,IVC)飼養,環境溫度20~22℃,相對濕度60%~70%,由四川大學華西公共衛生學院實驗動物中心提供(使用許可證號:SYXK(川)2018-011)。
乙醇(分析純):成都海興化工試劑廠;乙醛測定試劑盒:愛爾蘭Megazyme公司;神經特異性烯醇化酶(neuronspecific enolase,NSE)酶聯免疫檢測試劑盒:上海酶聯科技生物有限公司;肝素試劑、超氧化物歧化酶(superoxide dismutase,SOD)測定試劑盒、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-PX)測定試劑盒、脂質過氧化物(lipid peroxidation,LPO)測定試劑盒、丙二醛(malondialdehyde,MDA)測定試劑盒:南京建成生物工程研究所。
1.2 儀器與設備
平衡木裝置(60 cm×2 cm×2 cm):實驗室自制;7890B氣相色譜儀:美國Agilent公司;7697A頂空進樣器:美國Agilent公司;ECTM-WAX色譜柱(30m×0.53mm×1.2μm):美國Alltech公司;HeraeusTMFrescoTM21微量離心機:美國ThermoScientific公司;Multiskan Go全波長酶標儀:美國Thermo Scientific公司;手持式勻漿器:美國Kimble公司。
1.3 方法
1.3.1 動物分組與處理
120只Balb/c小鼠適應性飼養后,按體質量分層后隨機分組,分為樣①組、樣②組、酒精對照組及空白對照組,分組情況見表2。
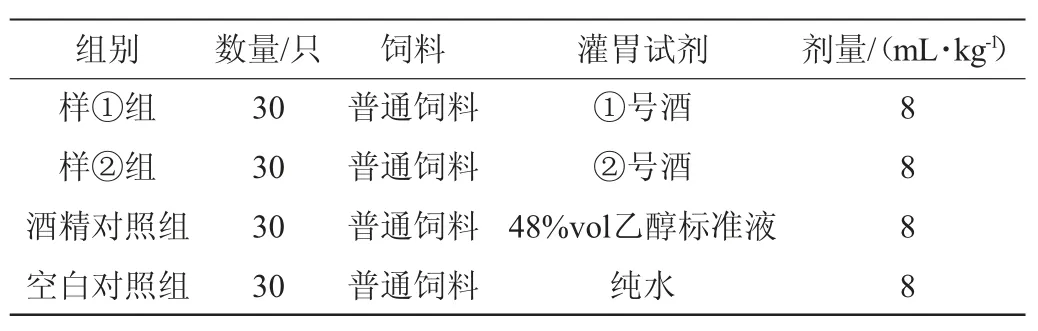
表2 實驗動物分組情況Table 2 Grouping of experimental animals
1.3.2 平衡木實驗
參考CRABBE J C等方法[9],正式實驗前1天需要進行過梁訓練,將小鼠放置于平衡木一端,推動臀部或輕柔搖動尾部使其過梁,每只小鼠訓練兩次。禁食不禁水12 h,不同組別小鼠進行稱質量并計算灌胃量。正式實驗前將小鼠移入測試房間適應2 h,每只小鼠灌胃10 min后置于平衡木一端,觀察小鼠過梁情況,行走評分標準見表3。
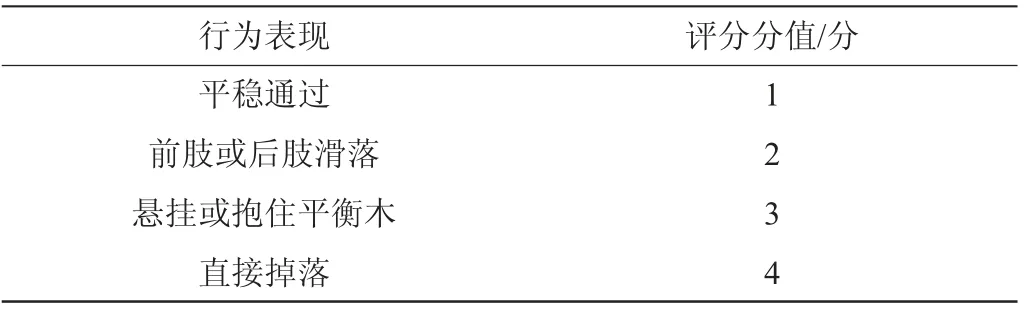
表3 行走試驗評分標準Table 3 Score standards of walking tests
1.3.3 標本采集及檢測
不同組別小鼠過梁結束后,立即抓取固定使其眼球突出充血,用彎頭眼科鑷迅速鉗取眼球,使血液流入抗凝離心管(肝素鈉溶液100 μL)中,顛倒混勻后4 ℃、3 000 r/min離心15 min,取上清,-20 ℃冰箱保存。小鼠摘眼球取血后,頸椎脫臼處死,置于冰盤上,醫用解剖剪剪開頸部皮膚、人字縫,醫用直頭鑷剝開顱骨,輕輕取出腦組織,剔除結締組織和脂肪組織后,用預冷過的生理鹽水漂洗血跡,吸水紙吸干后電子天平稱質量。按體料液比1∶1(g∶mL)加入生理鹽水在冰浴中進行勻漿,4 ℃、10 000 r/min離心30 min,取上清,-20 ℃冰箱保存。頂空氣相色譜法測定小鼠血漿中乙醇含量,酶聯免疫吸附法測定小鼠血漿中NSE含量,化學顯色法測定小鼠腦勻漿中乙醛、LPO、MDA含量、SOD、GSH-PX活力,操作步驟嚴格按照說明書進行。
1.3.4 數據的統計及處理
采用SPSS 21.0軟件進行統計分析和處理,正態分布數據采用均值±標準差(X±S)表示,方差齊時進行單因素方差分析(one-way ANOVA),LSD檢驗進行組間兩兩比較;方差不齊時使用Kruskal-Wallis檢驗。
2 結果與分析
2.1 行為學指標
共濟失調的發生與大腦、小腦及前庭系統等的損害密切相關,主要表現為機體運動的協調不良、平衡障礙等。研究表明,乙醇暴露劑量控制在2.5~3.5 g/kg范圍內能使小鼠產生明顯的共濟失調現象[10-11],故根據前期預實驗,本研究采用8 mL/(kg·體質量)(約3.0 g/kg)的單次灌胃劑量進行有效造模。平衡木實驗是評估小鼠肢體平衡以及肌肉運動協調能力的行為學方法。本研究參考崔海等[12-13]研究方法對平衡木行走評分標準進行了適當調整,即行走評分越高,共濟失調現象越嚴重。不同組別平衡木實驗行為學指標檢測結果見表4。

表4 平衡木實驗行為學指標檢測結果Table 4 Determination results of behavioral indicators by balance beam device tests
由表4可知,樣①組、樣②組、酒精對照組行走評分高于空白對照組,差異極顯著(P<0.01);樣②組行走評分低于酒精對照組,差異極顯著(P<0.01);樣①組行走評分高于樣②組,差異顯著(P<0.05);其余組間差異無統計學意義(P>0.05)。酒精暴露組較空白對照組均出現明顯的共濟失調現象,提示乙醇在致共濟失調中的關鍵作用,但樣①組、樣②組較酒精對照組行走評分偏低,說明酒樣中除乙醇、水外的微量成分可能對小鼠機體具有一定的保護作用。白酒中雜醇、醛類、羧酸、酯類、酸類等微量成分約占1%~2%,其種類與比例的變化都會影響白酒的質量和風味[14],本研究發現樣①組與樣②組誘導產生的共濟失調程度不同,且差異具有統計學意義,提示平衡木實驗行為學指標能有效反映不同白酒引起的共濟失調效應大小。
2.2 乙醇代謝指標
乙醇是親脂性小分子化合物,能迅速通過血腦屏障作用于腦組織。乙醛是乙醇的代謝產物,動物實驗證明攝入酒精的小鼠腦部乙醛含量明顯增加,且小腦含量更高,小腦是平衡中樞,由于乙醛其較強還原性,會致使腦部缺氧,出現站立不穩等現象[15]。不同組別乙醇、乙醛含量檢測結果見表5。
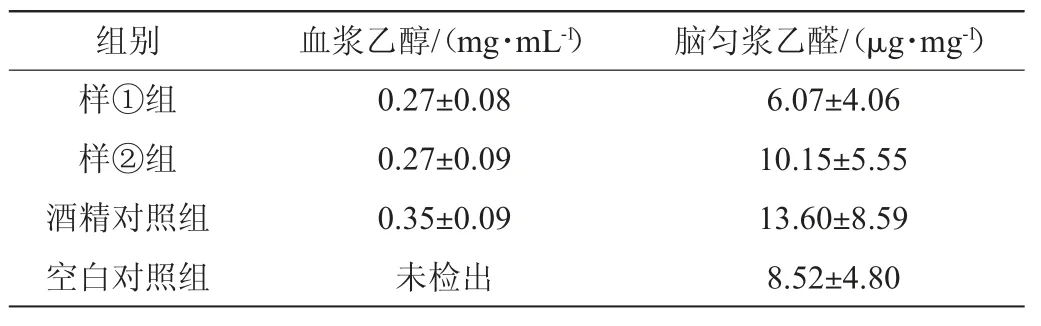
表5 不同濃香型白酒對急性酒精中毒小鼠乙醇代謝的影響Table 5 Effect of different strong-flavor Baijiu on ethanol metabolism in mice with acute alcoholism
由表5可知,各組間血漿乙醇、腦勻漿乙醛含量差異不顯著(P>0.05),與上述行為學結果不一致。由于乙醛的濃度與乙醇攝入量、乙醛加和物的形成、體內代謝酶的活性等密切相關[16],結合酒樣主要理化指標分析結果(即乙醇、乙醛、乙縮醛含量相近),可得出乙醛含量不能有效反映共濟失調的程度。
2.3 急性腦損傷指標
NSE是細胞能量代謝活動的關鍵酶,主要分布于中樞神經系統神經元與神經內分泌細胞中,當神經元損傷或壞死后,NSE通過血腦屏障進入血液中,致使血清(或血漿)NSE水平升高,其含量可靈敏、特異地反映神經元受損的程度[17-18]。不同組別神經特異性烯醇化酶含量檢測結果見表6。

表6 血漿中神經特異性烯醇化酶檢測結果Table 6 Determination results of neuron-specific enolase in plasma
由表6可知,樣①組、樣②組、酒精對照組血漿NSE含量高于空白對照組,差異極顯著(P<0.01);其余組間無統計學差異(P>0.05)。結果顯示,樣②組NSE含量稍低于樣①組、酒精對照組,提示②號酒樣所致的急性腦損傷程度更小,且NSE檢測水平趨勢與行走評分結果保持一致,提示血漿NSE含量可能與共濟失調水平呈正相關趨勢。由于樣①組、樣②組、酒精對照組小鼠酒精攝入量及血漿乙醇含量并無顯著差異,提示酒樣②中的微量成分可能有減輕乙醇對神經元損傷的作用。
2.4 氧化損傷指標
酒精誘導的腦損傷與腦組織發生氧化應激和脂質過氧化等反應有關[19]。MDA和LPO是脂質過氧化的重要產物,常用作反映機體細胞氧化損傷程度的指標,由于SOD和GSH-PX活力高低可間接反映機體清除自由基的能力,故常聯合使用進行氧化損傷評價。不同組別氧化損傷相關指標檢測結果見表7。
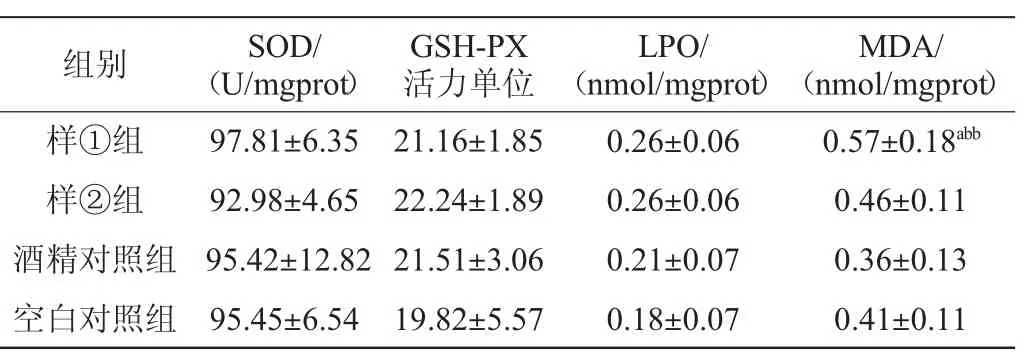
表7 氧化損傷相關指標檢測結果Table 7 Determination results of indicators related to oxidative damage
由表7可知,樣①組腦勻漿MDA含量高于酒精對照組、空白對照組,差異具有統計學意義(P<0.01或0.05);其余組間差異無統計學意義;各組間腦勻漿SOD、GSH-PX活力、LPO含量無統計學差異(P>0.05)。研究發現不同組別間氧化損傷指標無統計學差異(P>0.05),考慮到實驗動物采用的是單次中劑量酒精暴露,且段玉香等[19-20]研究結果顯示,單次大劑量或者長期酒精暴露均可產生明顯的腦部氧化損傷,故提示可能與作用劑量大小或者酒精暴露時間長短有關。且由于白酒中的微量成分組成及比例十分復雜,酒體中的某一種或某一類微量成分會對氧化應激造成不同的影響,具體的影響方式與程度需要進一步的實驗研究。
3 結論
本研究結果顯示,同酒精濃度酒精暴露組(不同白酒以及乙醇溶液)將造成實驗動物不同程度的共濟失調效應,具體可能是通過調控NSE的含量水平來產生影響。即飲用舒適度越高的酒飲后體內生成的NSE含量水平越低,急性腦損傷越輕,產生的共濟失調效應越小。提示可通過優化的平衡木實驗測定動物行為學指標結合急性腦損傷指標來評價白酒的飲用舒適度。
本研究結果提示,同酒精濃度酒精暴露組(不同白酒以及乙醇溶液)引起的共濟失調效應有明顯差異,且不同組間乙醇代謝、氧化應激指標與行為學實驗結果并不完全一致,結合白酒的理化成分檢測結果分析,可能與白酒中微量成分組成和比例不同有關;但具體的原因與機制值得深入探究,后續研究將對該內容繼續開展。

