體素內不相干運動擴散加權成像預測腦膠質瘤IDH1基因突變的價值
馮盼盼 王超超 董海波 李亞迪 王洪財 梁良
腦膠質瘤具有高度的侵襲力及增殖能力,是一種發病率高、復發率高、預后差的中樞神經系統惡性腫瘤,僅依賴常規病理分級不能滿足臨床對腦膠質瘤患者的個性化治療需求[1-2]。研究認為,高級別腦膠質瘤異檸檬酸脫氫酶-1(isocitrate dehydrogenase-1,IDH1)基因為突變型者其預后明顯好于病理分級相同的野生型,甚至也好于低級別野生型,因此,IDH1基因突變可作為腦膠質瘤患者預后相對良好的標志[3-5]。傳統的影像形態學分析預測腦膠質瘤IDH1基因突變的價值不大。多數腫瘤組織成像體素內既有擴散也有灌注成分[6]。體素內不相干運動擴散加權成像(IVIM-DWI)可以定量分離擴散和灌注成分,無創地反映腫瘤內部的擴散和灌注信息[7-8]。目前,國內外關于IVIM-DWI預測腦膠質瘤IDH1基因型的研究較少,本研究回顧性分析IDH1突變型與野生型腦膠質瘤患者IVIM-DWI定量參數的差異,探討其術前預測腦膠質瘤IDH1基因突變的臨床應用價值。
1 對象和方法
1.1 對象 回顧分析寧波市醫療中心李惠利醫院2016年9月至2020年1月經手術病理證實的55例WHOⅡ~Ⅳ級腦膠質瘤,依據免疫組織化學法檢測結果分為IDH1突變組17例和IDH1野生組38例。IDH1突變組男 8例,女 9例,年齡 32~70(48±3)歲。其中星形細胞瘤9例,少突星形細胞瘤3例,少突膠質細胞瘤3例,間變性少突星形細胞瘤1例及間變性星形細胞瘤 1例。IDH1野生組男26例,女12例,年齡25~87(55±2)歲。其中膠質母細胞瘤23例,間變性星形細胞瘤8例,間變性少突星形細胞瘤2例,間變性少突膠質細胞瘤1例及星形細胞瘤4例。納入標準:(1)MR檢查前患者未進行任何治療;(2)MR檢查后2周內手術切除腫瘤,根據WHO 2016分類標準進行病理學診斷;(3)影像資料完整,包括MRI平掃、增強及IVIM-DWI序列。排除標準:(1)術前接受過放療或化療;(2)由于頭部運動偽影而無法獲得MR數據;(3)實體腫瘤成分無法用于分析(<20 mm2)。本研究經本院醫學倫理委員會批準,所有患者均簽署書面知情同意書。
1.2 方法 采用美國GE Discovery MR750 3.0 T MR掃描儀和頭部8通道相控陣線圈(GE Medical Systems)。(1)常規MR平掃:包括橫斷面液體衰減反轉恢復(FLAIR)序列 T1WI,TR 1 850 ms,TE 24 ms,TI 780 ms;基于快速自旋回波(FSE)的刀鋒(PROPELLER)序列T2WI:TR 6 656 ms,TE 105 ms。FOV 240 mm×240 mm,矩陣288×224,層厚4 mm,層間距1 mm,掃描層數24層。(2)常規MR增強掃描:注入對比劑釓噴酸葡胺注射液0.2 ml/kg后橫斷面T1WI序列掃描,參數同平掃序列。(3)IVIM-DWI:采用軸位單次激發自旋平面回波擴散加權成像(SS-EPI-DW),TR 4 500 ms,TE 為最小值,b 值分別設定 0、10、20、30、50、100、150、200、400、800、1 200、2 000、3 000 s/mm2,相應的 NEX 取 2、1、1、1、1、1、1、2、2、3、3、5、6,掃描時間 378 s。FOV240mm×240mm,矩陣 160×160,層厚 4 mm,層間距 1 mm;掃描層數24層。
1.3 圖像分析與后處理 圖像由美國GE ADW 4.5后處理工作站,Functool MADC軟件分析IVIM-DWI,獲得偽彩圖。由2位神經放射學副主任醫師分別沿腫瘤最大實性區域的內邊緣采用不規則模型勾畫感興趣區(ROI),結合常規MR圖像避開囊性、出血或壞死區域,在同層對側白質區手動放置一個ROI(約50 mm2),得到腫瘤及對側白質的表觀擴散系數(ADC),使用雙指數模型獲得真性水分子擴散系數(D)、微循環灌注系數(D*)和灌注分數(f),取平均值。
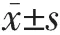
2 結果
2.1 一致性分析 2位醫師測量ADC、D、D*和f值的ICC 分別為 0.935、0.927、0.933和 0.941,一致性良好。2.2IDH1突變組與野生組IVIM-DWI參數比較IDH1突變組ADC、D、f值均高于IDH1野生組(均P<0.05),但D*值在兩組中差異無統計學意義(P=0.058)(表1,典型病例見圖 1、2,插頁)。
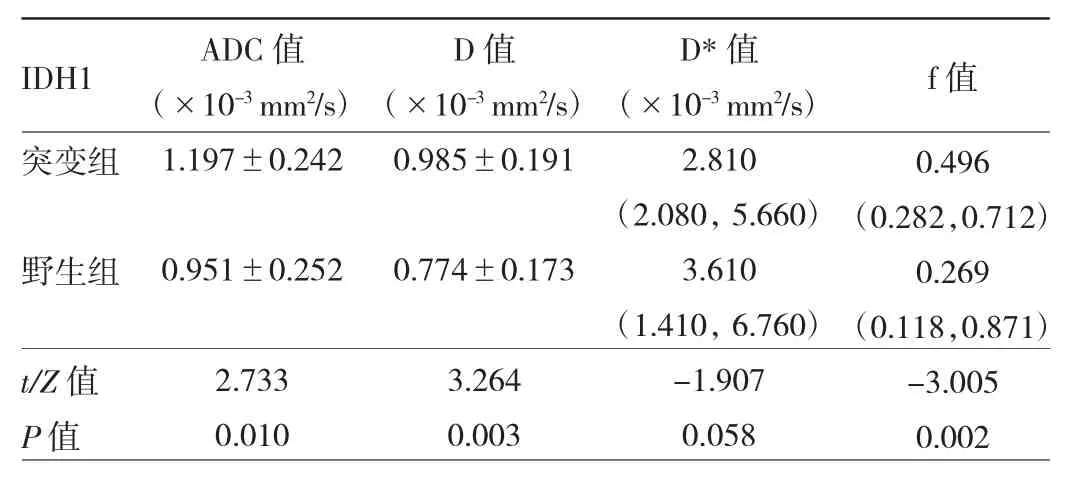
表1 IDH1突變組與野生組IVIM-DWI參數的比較
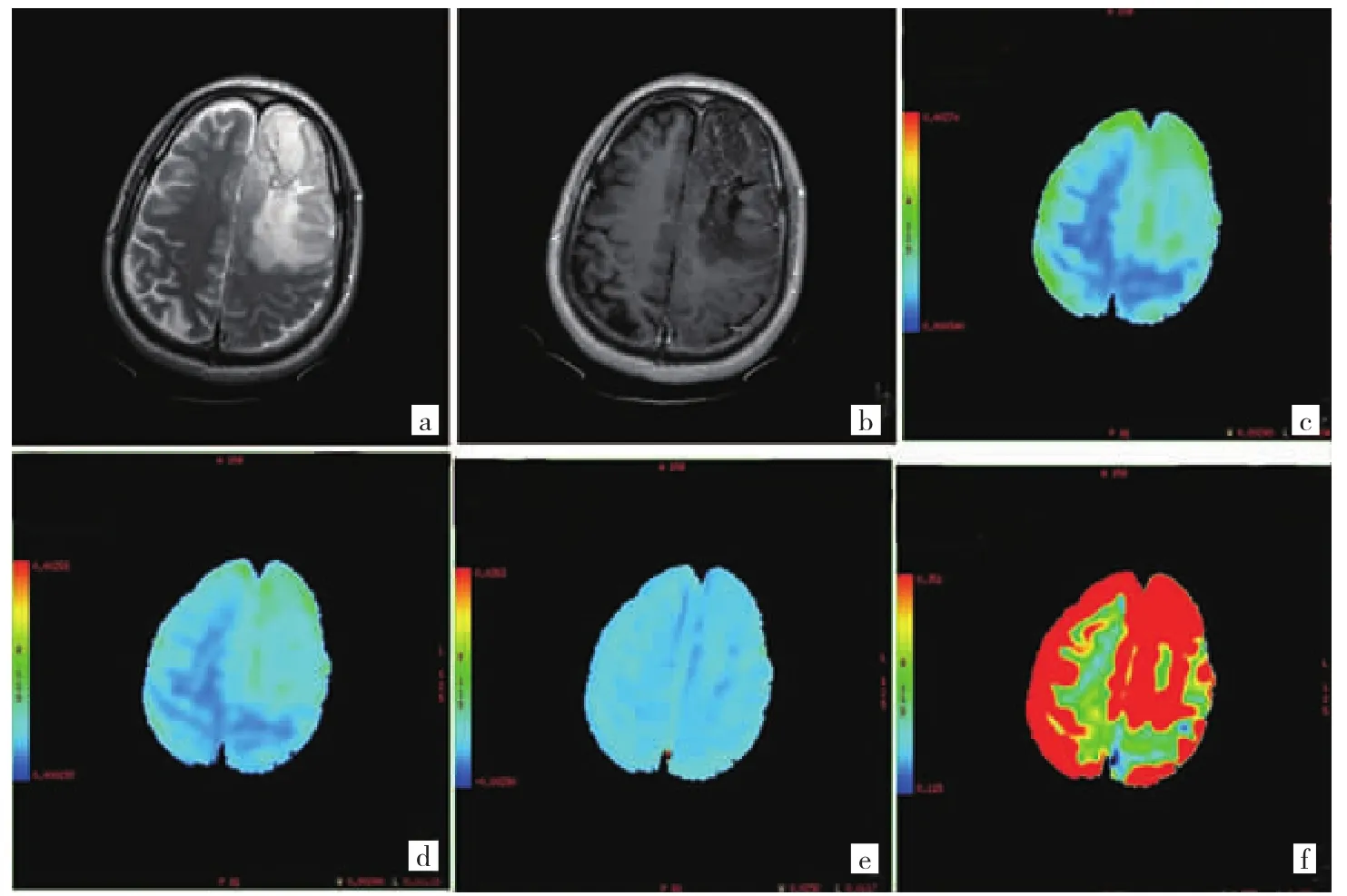
圖1 70歲男性左側額葉間變性少突星形細胞瘤患者,WHOⅢ級,IDH1突變型 [a:T2WI高信號;b:T1WI增強少許不均勻強化;c~f:表觀水分子擴散系數(ADC)、真性水分子擴散系數(D)、微循環灌注系數(D*)和灌注分數(f)]
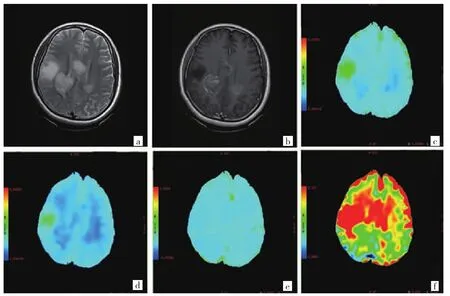
圖2 43 歲女性兩側間變性星形細胞瘤患者,WHOⅢ級,IDH1 野生型[a:T2WI高信號;b:T1WI增強不均勻強化;c~f:ADC、D、D* 和 f]
2.3 ROC曲線預測IDH1突變型腦膠質瘤的效能ADC、D、f值的 AUC 分別為 0.793、0.807、0.818,臨界值分別為 1.060×10-3mm2/s、0.858×10-3mm2/s、0.282,ADC預測的特異度最高,f的靈敏度最高,D*無顯著診斷效能(P=0.057)(表 2,圖 3)。
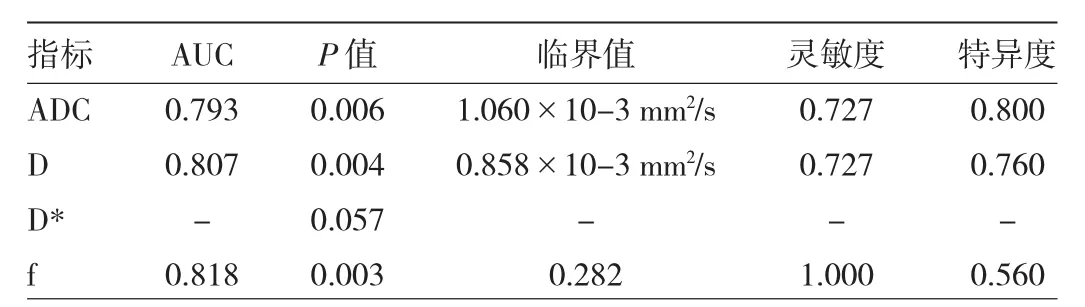
表2 IVIM-DWI定量參數預測腦膠質瘤IDH1基因突變的效能
3 討論
2016年《WHO中樞神經系統腫瘤分類》顛覆性地改變了腦膠質瘤傳統形態學分型方法,第一次以分子分型作為腫瘤分型的核心依據,基因型結合表觀型的新分型方法增加了診斷準確性[9-11]。相較于組織學分類,基因分子生物學標志物對確定腦膠質瘤分子亞型和進行個體化治療及判斷臨床預后具有重要意義。
IVIM采用雙指數模型,從理論上可以將擴散和灌注信息分離,其中,D值和ADC值與水分子擴散相關,f值和D*值與血流灌注相關。眾所周知,D值主要反映細胞密度和水分子運動等真實擴散狀態。Wang等[6]認為IDH1突變型腦膠質瘤的D值高于野生型,但其研究結果并未達到統計學意義,可能與病例數較小有關。本研究中,IDH1突變型的D值明顯高于IDH1野生型,具有統計學意義,鑒別兩者的臨界值為0.858×10-3mm2/s,AUC為0.807。同時,本研究顯示低級別腦膠質瘤的IDH1基因突變率高達78.9%,高級別腦膠質瘤的IDH1基因突變率卻僅為5.6%[9-10],而低級別腦膠質瘤的細胞密度和異常增殖能力相對較低[12]。筆者認為,IDH1基因突變型腦膠質瘤的細胞密度較低、異常增殖能力較低,核質比更低,細胞外間隙更大,水分子擴散受限相對較小,故D值較高[13-14]。因此,D值在預測IDH1突變方面有一定價值。
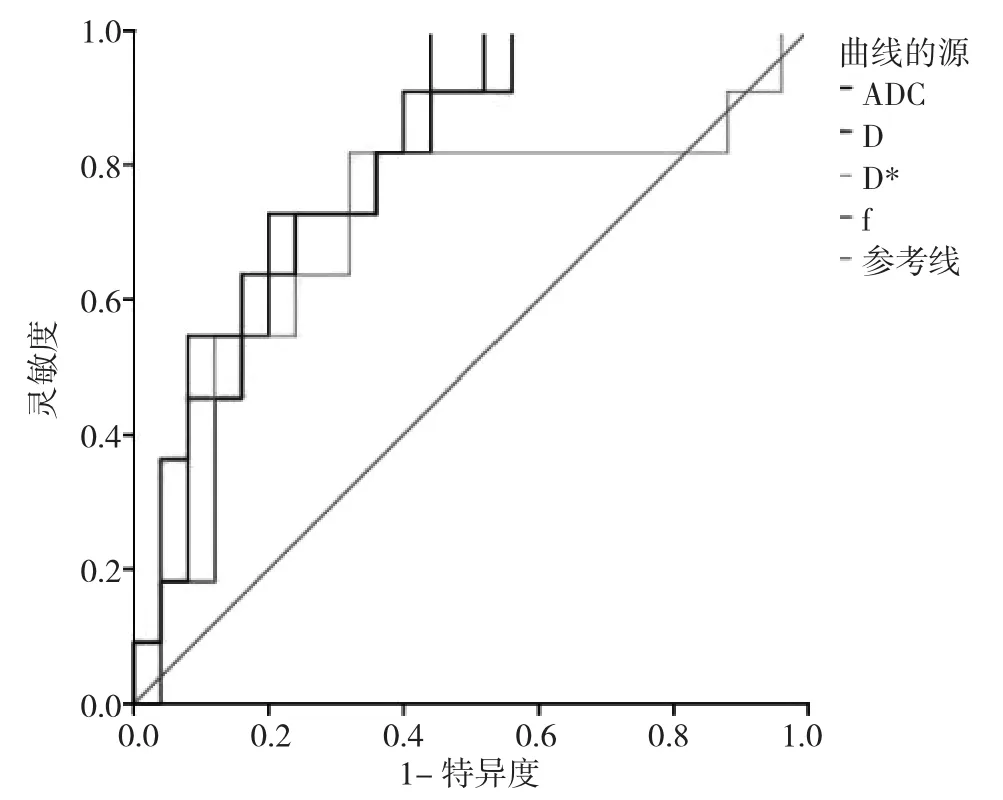
圖3 體素內不相干運動擴散加權成像(IVIM-DWI)定量參數鑒別腦膠質瘤IDH1基因突變的ROC曲線
當b值>200 s/mm2,D值與ADC值呈正相關[15]。小樣本研究已經提示DWI的最小ADC值可以鑒別IDH1的突變狀態[16]。有研究也證實了無論高級別還是低級別腦膠質瘤,IDH1突變型的ADC值均高于IDH1野生型[6]。本研究顯示,IDH1突變型的ADC值明顯高于野生型,鑒別兩者的臨界值為1.060×10-3mm2/s,AUC為0.793,預測的特異度最高(0.800)。這表明雖然ADC值包含了一定的灌注信息,但在預測IDH1突變方面仍有一定價值。
IDH1基因突變的腦膠質瘤通過抑制缺氧誘導因子亞單位(HIF-1)的活性途徑導致血管生成減少[17]。依據IVIM理論,D*值反映灌注情況,其數值與毛細血管的密度相關。Wang等[6]研究顯示僅在高級別腦膠質瘤中,IDH1突變型的D*值較野生型低,而低級別腦膠質瘤中D*值則差異無統計學意義,說明不同級別腦膠質瘤內灌注情況存在差異。本研究中,IDH1突變型腦腦膠質瘤的D*值低于野生型腦膠質瘤,但兩組間無統計學差異,除了可能與樣變量較少、沒有對高低級別腦膠質瘤突變與否的D*值分開研究外,也一定程度提示D*值對預測IDH1基因突變價值不大。Wang等[6]研究表明僅在高級別腦膠質瘤中,IDH1突變型的f值較野生型低,而低級別腦膠質瘤中沒有明顯差別。本研究中,IDH1突變型腦膠質瘤的f值顯著大于IDH1野生型,與Wang等[6]的結論有所差異。筆者認為,與D*值反映毛細血管的密度有所不同,f值是指體素內微循環灌注成分在整個病變組織中的所占比例,由于IDH1突變型腦膠質瘤的細胞增殖程度低、細胞密度相對較小,核質比較低,其擴散成分所占比例相對較低,而微循環灌注成分所占比例相對升高,所以f值升高,而IDH1野生型腦膠質瘤恰好相反[14]。本組中,IDH1突變型腦膠質瘤f值的ROC及靈敏度均最高,表明f值在預測IDH1基因突變方面有重要價值。
IDH1基因突變可改變IDH1與底物親和力以及代謝的方向,使腫瘤代謝和微觀結構發生改變。多項試驗表明,IDH1突變可增加腫瘤細胞的放射敏感性[18-19]和化療敏感性[20-22]。目前的標準治療方式為手術聯合替莫唑胺(TMZ)輔助放化療等綜合治療。Rohle等[23]研究顯示,可穿過血腦屏障的小分子IDH1基因突變特異性抑制劑(AGI-5198)在體內和體外均顯示較好的療效。AGI-5198可反轉因IDH1基因突變導致的細胞分化改變并降低 2-羥基戊二酸(2-bydroxyglutarate,2-HG)含量。由于IDH1基因突變改變腦膠質瘤的甲基化譜,對烷化劑化療藥的療效產生影響[24-25]。因此,IVIM-DWI定量預測腦膠質瘤IDH基因突變不僅可指導臨床判斷預后,而且有助于治療方案的選擇和靶向藥物的研發。本研究也存在一些局限性:首先,病例數較少;其次,研究采用回顧性分析方法,有可能漏掉一些未行IVIMDWI數據采集和分子病理檢測的病例;IVIM-DWI的參數選擇如不同的b值、TE對結果也有影響;再次,勾畫ROI僅為腫瘤增殖活躍區,而未能對腫瘤的異質性進行評價。今后,筆者將采用前瞻性研究方法,納入不同基因型的腦膠質瘤病例,同時采用“最大值法”、“全瘤分析法”及“瘤周分析法”評價IVIM-DWI對鑒別IDH1基因型的價值。
總之,IVIM-DWI的定量參數ADC、D、f值在術前預測腦膠質瘤IDH1基因突變有重要價值,以f值效能最高。

