自噬基因結腸癌預后模型建立及驗證*
王竣立 陶成成 喬玲 游江舟 李昌龍
(四川大學華西基礎醫學與法醫學院生物化學教研室,四川 成都 610041)
根據2018年的全球癌癥統計數據,結腸癌的全球發病率排名第三,死亡率在所有癌癥中排名第二,且發病率和死亡率都有逐年上升的趨勢[1]。臨床上影響結腸癌預后的風險因素變化多樣,包括患者的年齡、生活習慣、腫瘤發生的部位、其生物學特性及腫瘤的分期。近年來我國結腸癌的發病率呈快速增長趨勢,雖然手術、放化療、靶向治療等在一定程度上延長了結腸癌患者的生存時間,但治療后腫瘤局部復發和轉移的發生率仍較高。因此,有效預測復發傾向和預后水平在結腸癌治療中具有重要意義。在腫瘤的發生發展過程中,自噬有著雙向調控的作用,根據細胞基因組成和細胞所處環境的變化,自噬既能抑制腫瘤的發生發展,同樣也參與了腫瘤的進程與耐藥[2-3]。研究通過癌癥基因組圖庫(The Cancer Genome Atlas, TCGA)數據庫中提取轉錄組測序信息,篩選與結直腸癌預后相關的自噬基因,并構建其風險計算模型,以期對臨床結直腸癌的預后分析和前期治療提供靶向治療思路。
1 資料與方法
1.1 結腸癌差異自噬基因篩選與功能分析 使用TCGA數據庫收集結腸癌轉錄組及生存信息,將轉錄組原始基因代碼轉換成基因名稱,整合患者年齡、性別、癌癥分期、轉移狀況和生存狀況等多項數據。使用R語言wilcox檢驗篩選出結直腸癌差異自噬基因,篩選條件為P<0.05。在GO以及KEGG pathway 數據庫中,對差異表達自噬基因進行信號通路以及功能的富集分析,GO富集分析是對差異表達的自噬基因進行GO分類,基于離散分布顯著性、誤判率和富集度的分析,得出與樣本顯著相關的、低誤判率的、靶向性的基因功能分類,初步預測差異基因的功能。KEGG pathway 分析是通過KEGG數據庫以及Biocarta來進行分類,對通路中的基因進行顯著性分析,得到與樣本有顯著關聯的信號通路,預測其功能。
1.2 模型構建 首先對差異表達的自噬基因進行單因素Cox風險回歸分析,初步篩選出對結腸癌預后可能具有影響的自噬基因,篩選條件為P<0.05。然后對單因素Cox風險回歸分析篩選出的差異表達基因進行多因素Cox比例風險回歸分析,依據回歸系數(β)及風險比(hazard ratio,HR)來識別保護(HR<1)和危險(HR>1),同時篩選出了高風險自噬差異基因,以上述基因表達量為自變量,患者生存時間與生存狀態作為因變量,使用COX-PH函數構建自噬基因預后模型。
1.3 模型驗證及臨床相關性分析 以患者風險值與生存狀態繪制生存曲線;將患者風險值由低到高繪制風險曲線;結合患者生存狀態以及參與模型構建的風險自噬基因表達量,綜合驗證所構建預后模型是否能作為結腸癌預后獨立危險因子。將參與模型構建的自噬基因與模型所得危險因子與患者癌癥分期、年齡、性別、是否轉移進行相關性分析。
1.4WIPI2、RAB7A基因的驗證
1.4.1 細胞株和主要試劑 人結腸細胞NCM460與人結腸癌細胞HCT116、RKO(ATCC);胎牛血清(Hyclone,美國);DMEM培養基(Biological Industries,以色列);1%青霉素-鏈霉素(Hyclone,美國);PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)逆轉錄試劑盒(TaKaRa,日本);TB Green PCR Mix(TaKaRa,日本);Trizol(碧云天,中國)。
1.4.2 Real-time PCR檢測正常結腸細胞與結腸癌細胞中WIPI2、RAB7A基因表達水平,分別使用正常結腸細胞(NCM460),兩株結腸癌細胞(HCT116、RKO)。傳代培養至密度80%時,提取正常結腸細胞和結腸癌細胞總RNA,使用PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)逆轉錄試劑盒逆轉錄為cDNA,以此cDNA為模板,GAPDH基因為內參,進行Real-time PCR。Real-time PCR反應體系為:25μL總反應體系中TB Green PCR Mix 12.5μL,上、下游引物分別為1μL,cDNA模板1μL,dd H2O 9.5μL。反應條件:預變性95℃ 30s;變性95℃ 5s,退火延伸60℃ 30s,共35個循環。按2-ΔΔCt法進行相對定量分析。
引物序列如下:RAB7AForward:5′-GTGATGG TGGATGACAGGCTAG-3′,RAB7AReverse:5′-AG TCTGCACCTCTGTAGAAGGC-3′;WIPI2 Forward: 5′-CGACAACTGCTACTTGGCGTAC-3′,WIPI2 Reverse: 5′-AGTGCCGCTAAAGGACTGTCGT-3′;GAPDHForward:GAGTCAACGGATTTGGTCGT,GAPDHReverse:GACAAGCTTCCCGTTCTCAG。設正常結腸細胞的相對表達量為1。
2 結果
2.1 篩選結腸癌差異表達自噬基因 利用TCGA數據庫中收集到的正常樣品42例,腫瘤樣品482例,進行wilcox檢驗,篩選出結腸癌相關差異表達自噬基因共34個,其中上調基因16個,下調基因18個(圖1A)。紅色為高表達基因,綠色為低表達基因;離散程度代表基因差異表達程度。如圖1B,紅色為高表達基因,綠色為低表達基因,亮度越高,表達差異程度越大,具體的的logFC,P value,FDR(見表1)。其中HSPB8,NKX2-3,NRG2,TP53INP2等上調最為顯著,這些上調基因除參與自噬外,與信號傳導,基因的異常表達,藥物抵抗有著密切相關[4-7],相反CDKN2A,ATG9B等顯著下調的基因與腫瘤抑制,細胞周期調節等也有一定相關性[8-9]。
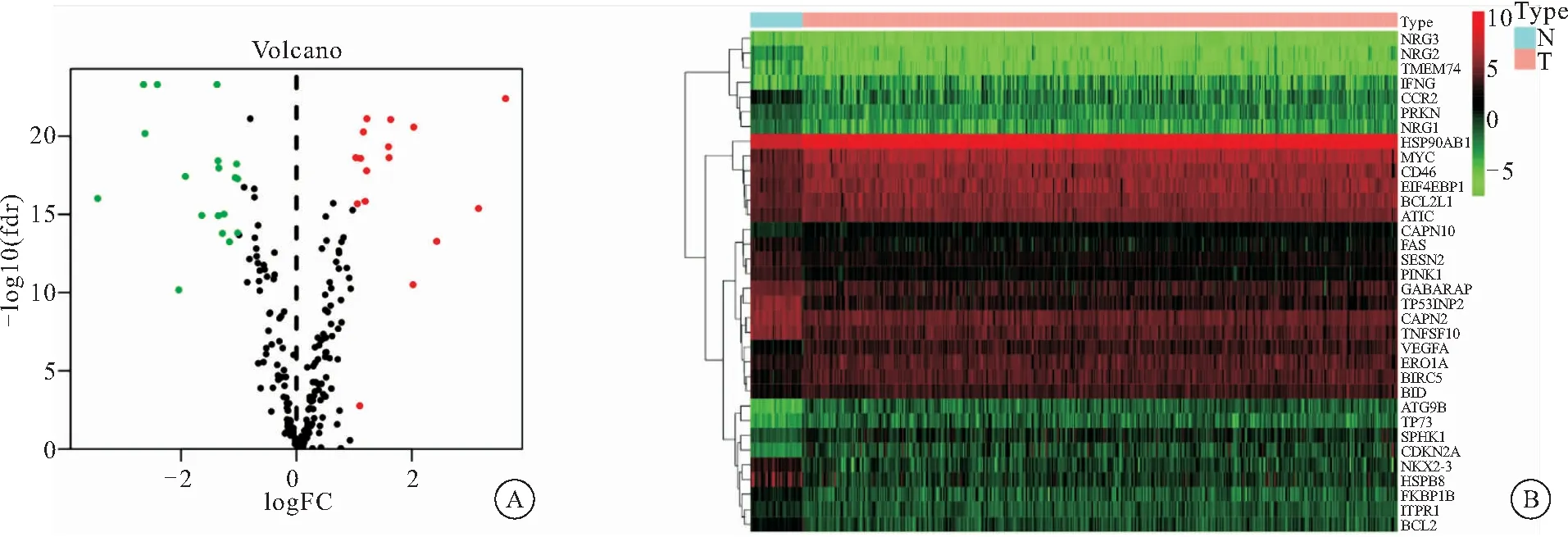
圖1 結腸癌差異表達自噬基因

表1 結腸癌相關差異表達自噬基因
2.2 GO與KEGG富集分析 對篩選出的差異表達自噬基因進行GO以及KEGG功能預測。GO分析的結果顯示,差異表達自噬基因除主要富集在自噬功能以外,在細胞的氧化應激過程,細胞凋亡過程,線粒體膜反應以及細胞色素c的釋放等功能上均有10個以上差異基因的富集(P<0.05),見圖2A。KEGG信號通路分析共得到30條有顯著差異的信號通路,主要集中在自噬、P53信號通路、凋亡、順鉑類藥物拮抗、EGFR酪氨酸酶抑制劑拮抗等(P< 0.05),見圖2B。count值代表富集基因數,count值越大,氣泡面積越大,富集基因越多;由藍到紅,P值越來越小,下同。

圖2 GO與KEGG富集分析結果圖
2.3 篩選與結腸癌預后相關的自噬基因
2.3.1 單因素COX分析 通過單因素COX分析,將自噬基因表達量與患者生存時間與生存狀態進行聯合分析,以P<0.05作為閾值,篩選出與結腸癌患者預后相關的10個自噬基因,見表2。

表2 單因素COX回歸分析
2.3.2 多因素COX分析及模型構建 利用多因素COX比例風險回歸分析,篩選出5個高風險自噬基因分別為WIPI2,RAB7A,ULK3,PELP1,DAPK1,見表3。HR值小于1的是WIPI2,ULK3,PELP1。HR值大于1的是RAB7A,DAPK1。利用篩選出5個高風險自噬基因構建結腸癌預后COX風險回歸模型,見圖3。回歸系數(Coef)分別為WIPI20.613249,RAB7A1.067329,ULK30.475059,PELP10.338861,DAPK10.298811。其中RAB7A基因對本模型風險值的貢獻最大,其次是WIPI-2。

圖3 結腸癌預后COX風險回歸模型

表3 多因素COX回歸分析
2.4 結腸癌預后COX風險回歸模型驗證 基于所構建的預后風險回歸模型,按照中位數將所有患者劃分為高低風險兩組,并繪制出生存曲線,見圖4A。紅線代表高風險組,藍線代表低風險組。結果顯示,高風險值患者生存率與低于低風險值患者,且差異有統計學意義(P<0.001)。將風險值從低到高排序,繪制風險曲線、患者生存狀態以及模型基因表達量的熱圖(圖4B、C、D)。結果顯示,隨著風險值的升高,患者死亡比例升高。結腸癌預后風險回歸模型中,自噬基因RAB7A的表達與風險值呈正相關,自噬基因WIPI2,ULK3,PELP1,DAPK1的表達與風險值呈負相關。

圖4 結腸癌預后COX風險回歸模型驗證結果
2.5 本模型與臨床常見預后評估因素的比較 結合結腸癌臨床常見的預后評估因素,如患者年齡、性別、腫瘤分期、是否轉移等各項生存指標,對本研究所構建模型得到的患者風險值進行單因素以及多因素的獨立預后分析。結果顯示,與臨床常見預后評估因素相比,本研究所構建模型單因素分析HR值為1.464(P<0.001),多因素分析HR值為1.377(P<0.001),證明其可以作為獨立的預后因子,見圖5。
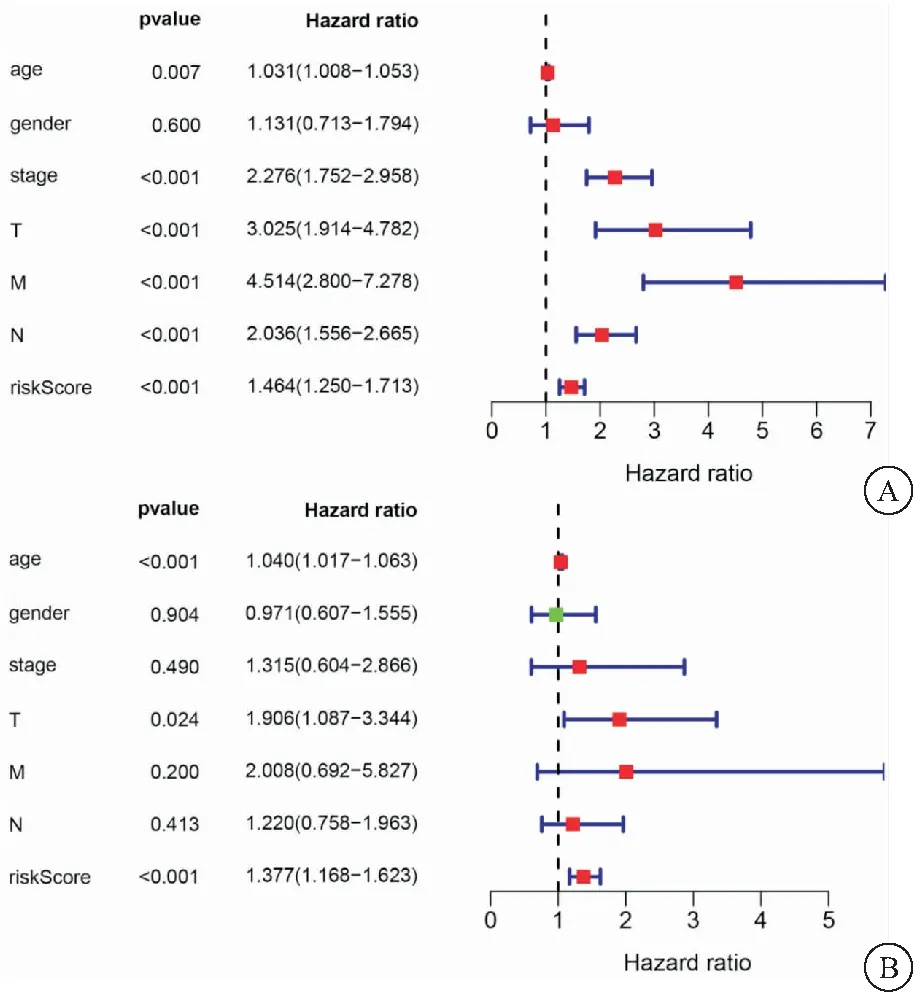
圖5 本模型與臨床常見預后評估因素的比較
2.6 結腸癌預后COX風險回歸模型臨床相關性分析 將本模型中自噬基因的表達量與患者的年齡,性別腫瘤分期,是否轉移等情況進行相關性分析。結果顯示,RAB7A的表達量與結腸癌分期呈正相關,與患者年齡呈負相關;WIPI2與癌癥分期呈正相關。模型所得危險因子與癌癥分期有相關性,見圖6。
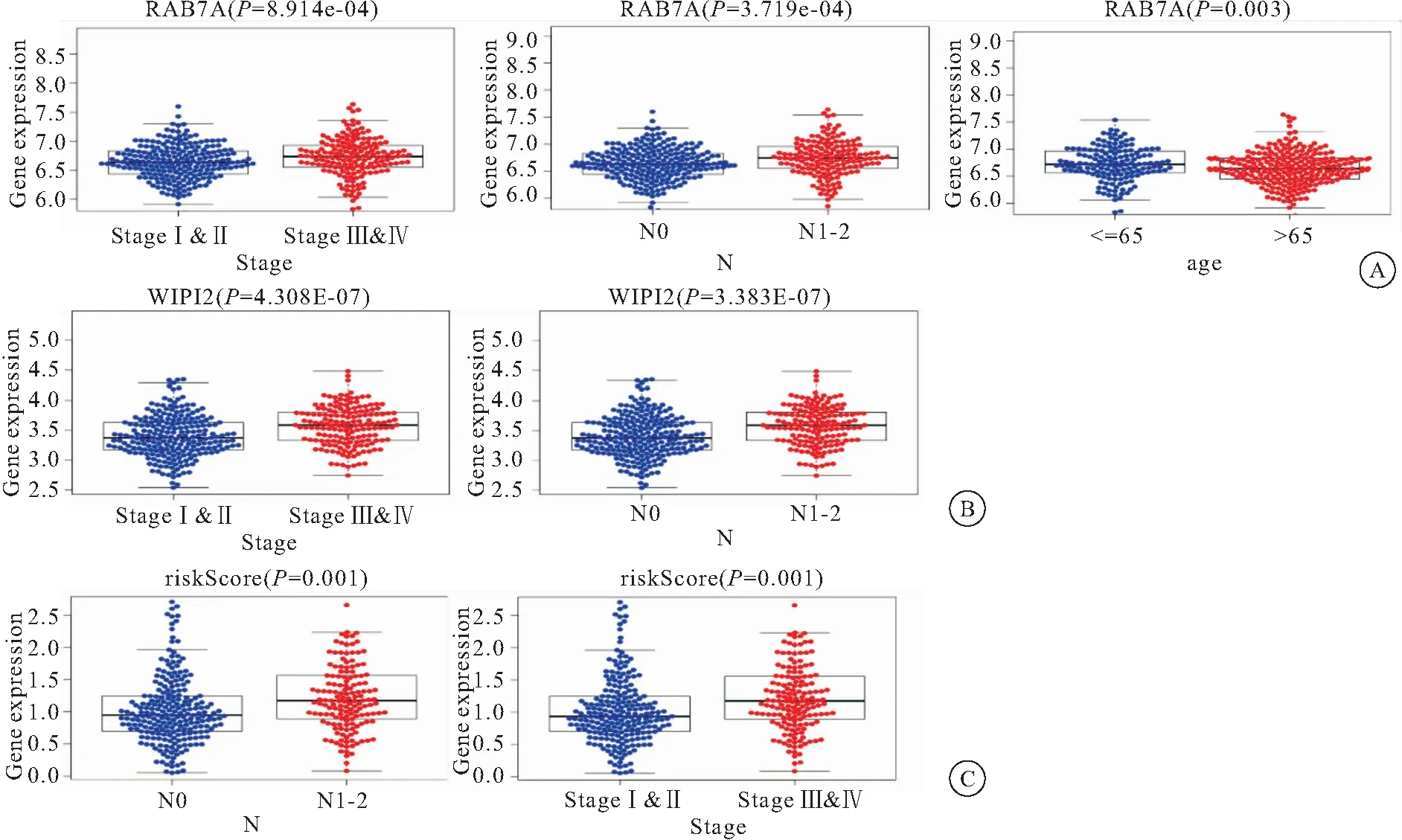
圖6 結腸癌預后COX風險回歸模型與臨床相關性
2.7 人正常結腸細胞與人結腸癌細胞中WIPI2、RAB7A基因表達水平的變化 Real-time PCR檢測結果(圖7)顯示,與人正常結腸細胞NCM460相比,人結腸癌細胞HCT116、RKO中WIPI2、RAB7A基因的表達水平均升高,且差異有統計學意義(P<0.05)。

圖7 人正常結腸細胞與人結腸癌細胞中WIPI2、RAB7A基因表達水平的變化
3 討論
近年來,結腸癌的診斷與治療水平隨著直腸鏡技術的發展以及各種抗癌靶向藥物的研發有了長足的進步[10]。根據加拿大癌癥協會的報道,結腸癌發病率位于全球惡性腫瘤中第3,死亡率位于第4[11-12],相對于診斷與治療水平的較快發展,結腸癌預后的研究仍較為缺乏。最新研究發現,結腸癌與自噬有著密切的關系[13-16],使用免疫組化技術對結腸原發腫瘤進行檢測發現了分子伴侶介導自噬(CMA)水平的升高[17-18],在結腸癌細胞系HCT116中,TP53的沉默會導致網狀吞噬和有絲分裂吞噬,起到保護腫瘤細胞的作用。現有研究表明,結腸腫瘤的形成與自噬過程降解片段極性蛋白(DVL)后導致WNT信號通路的異常激活有關[19]。以上研究均提示自噬相關信號通路的關鍵基因可能成為結腸癌診斷、治療以及預后的重要研究方向。目前,結腸癌預后的判斷主要是通過對腫瘤侵襲深度[20]、淋巴結轉移[21]、血管浸潤[22]、血清癌胚抗原[23]等做出診斷。癌癥分期與轉移情況被普遍認為是比較好的預后指標,但仍然有特異性不高,鑒別困難等缺點。
本研究就自噬相關基因與結腸癌預后的關系進行生物信息學分析,首先對比482例結腸癌腫瘤樣本與42例正常樣本的自噬基因表達,發現了35個差異表達的基因;再利用COX比例風險回歸分析,篩選出5個高風險自噬基因:WIPI2,RAB7A,ULK3,PELP1,DAPK1。利用這五個高風險自噬基因構建結腸癌預后COX風險回歸模型可知:RAB7A基因對本模型風險值的貢獻最大,其次是WIPI-2。RAB7A是Ras超家族中的一員,起到調節膜的轉運和溶酶體的轉運,以及調節生長受體的內吞作用中吞噬體和自噬空泡的產生,轉運,成熟過程[24-25]。RAB7A參與許多的細胞過程[26-28],被稱為癌癥的先導角色[29]。研究表明,抑制RAB7A有效消除了結直腸癌干細胞,并且破壞了癌灶,提示RAB7A可作為結直腸癌靶向治療的新靶點[30]。WIPI2功能主要是作為自噬體形成的早期蛋白,輔助ATG12-ATG5-ATG16L1復合物的形成,調控新生自噬體膜伸長的過程[31]。
基于所得生存曲線(圖4A)可知,高風險組病人生存期較低風險組病人顯著縮短(P<0.05),由風險值與病人生存狀態所得散點圖(圖4B)可知,風險值較高的病人,死亡比例明顯高于低風險值病人,并且隨著風險值的升高,參與構建計算模型的自噬基因表達呈現出明顯的趨勢,說明模型構建與實際病人生存狀況、基因表達狀況相符合。同時為了檢驗本模型相較于傳統癌癥分期轉移等預后指標的臨床意義,將常見患者臨床預后評估因素,與模型所得風險值進行了單因素以及多因素的獨立預后分析。在單因素分析過程中,模型與腫瘤分期與病人預后均顯著相關,且均一性更好,誤差更小;在多因素獨立預后分析中,所構建模型的預后預測作用顯著優于其他臨床指標,說明本模型可作為結腸癌獨立預后因子;構建模型所使用的自噬基因的表達,多與癌癥分期有著顯著地相關性,提示其在結腸癌發生發展過程中可能起到了重要作用,是潛在的結腸癌診斷以及治療靶點。對在本模型風險值貢獻最大的RAB7A基因及WIPI2基因在人正常結腸細胞(NCM460)與人結腸癌細胞(HCT116、RKO)中進行Real-time PCR檢測其表達水平,發現RAB7A、WIPI2基因在結腸癌細胞(HCT116、RKO)中高表達,提示RAB7A、WIPI2基因可能還參與了結腸癌的發生發展。
4 結論
本研究利用COX風險回歸模型構建了基于自噬基因表達水平的結腸癌預后模型,該模型相對于傳統預后預測指標更準確穩定,通過該模型篩選出的差異表達自噬相關基因可作為結腸癌預后的獨立危險因子,輔助臨床對結腸癌患者預后進行更準確的預測。

