超高效液相色譜-三重四級(jí)桿質(zhì)譜同時(shí)檢測(cè)苦蕎中10種真菌毒素
唐振濤 于剛 劉菲 俞凌云 薛康

摘要?[目的]建立QuEChERS-超高效液相色譜-串聯(lián)質(zhì)譜法同時(shí)檢測(cè)苦蕎樣品中10種真菌毒素。[方法]苦蕎樣品經(jīng)水和乙腈提取后,采用QuEChERS方法凈化。通過超高效液相色譜-三重四級(jí)桿質(zhì)譜在多反應(yīng)監(jiān)測(cè)模式(MRM)下進(jìn)行目標(biāo)真菌毒素的分析。試驗(yàn)對(duì)樣品前處理、儀器分析條件進(jìn)行優(yōu)化;考察方法的基質(zhì)效應(yīng)、檢出限、精密度、回收率等參數(shù)。[結(jié)果]根據(jù)基質(zhì)效應(yīng)考察結(jié)果,50%的目標(biāo)真菌毒素具有顯著的信號(hào)抑制/增強(qiáng)效應(yīng)。為了補(bǔ)償基質(zhì)效應(yīng)的影響,選用基質(zhì)配標(biāo)法進(jìn)行目標(biāo)真菌毒素的分析。方法的線性范圍為0.5~50.0 μg/L(對(duì)于黃曲霉毒素B2、G2,線性范圍為0.125~12.500 μg/L),檢出限和定量限分別低至0.011和0.040 μg/L,回收率為89.70%~105.83%,RSD<9%(n=6)。[結(jié)論]建立的方法簡便、可靠,具有較好的靈敏度和準(zhǔn)確性,能有效用于苦蕎樣品中多組分真菌毒素的檢測(cè)。
關(guān)鍵詞?苦蕎;多組分真菌毒素;QuEChERS;超高效液相色譜-三重四級(jí)桿質(zhì)譜
中圖分類號(hào)?TS211.7?文獻(xiàn)標(biāo)識(shí)碼?A
文章編號(hào)?0517-6611(2021)01-0188-06
doi:10.3969/j.issn.0517-6611.2021.01.051
Abstract?[Objective]To establish an analysis method for simultaneous determination of 10 mycotoxins in buckwheat samples based on QuEChERS-ultra-high performance liquid chromatography-tandem mass spectrometry.[Method]As a typical run,mycotoxins were extracted with water and acetonitrile,followed by purification with QuEChERS procedure.The target mycotoxins were analyzed by UPLC-MS/MS in multiple reaction monitoring (MRM) mode.The sample pretreatment and instrumental analysis method were respectively optimized.Finally,matrix effect,detection limits,precision and accuracy were investigated.[Result]According to the investigation of matrix effect,50% of the target mycotoxins have encountered prominent signal suppression / enhancement.To compensate the significant matrix effect,matrix-matched calibration curves were finally employed in this study.The linear range of targets were 0.5-50.0 μg/L (0.125-12.500 μg/L for AFB2,AFG2).Detection limits (LOD) and quantification limits (LOQ) were respectively detected down to 0.011 and 0.040 μg/L.Recoveries were obtained ranging from 89.70% to 105.83% with RSD< 9%.[Conclusion]The established method exhibits several advantages of simplicity,reliability,good sensitivity and accuracy.It is feasible and effective to apply this method for determination of multi-mycotoxins in buckwheat samples.
Key words?Buckwheat;Multi-mycotoxins;QuEChERS;UPLC-MS/MS
苦蕎是蓼科蕎麥屬植物,在我國西南、中南、華北等地均有分布。該類植物能適應(yīng)環(huán)境惡劣的生長環(huán)境,主要作為糧食和飼料供人們使用。苦蕎含有優(yōu)于小麥、玉米等的蛋白質(zhì)及氨基酸,還含有大量維生素和多種礦質(zhì)元素,具有豐富的營養(yǎng)價(jià)值[1]。另一方面,苦蕎富含黃酮類、甾體類、多糖等生物活性成分;藥理學(xué)研究表明苦蕎具有降血壓、降血脂、降血糖、抗氧化、預(yù)防心血管疾病等作用[2-4]。隨著苦蕎藥理作用的研究發(fā)現(xiàn),“藥食同源”的苦蕎及其產(chǎn)品迎來廣闊的市場(chǎng)前景,有關(guān)苦蕎產(chǎn)品的開發(fā)利用也得到越來越多的關(guān)注[5]。然而,與其他谷物一樣,苦蕎面臨著易被真菌毒素污染的難題[6]。真菌毒素污染不僅會(huì)對(duì)人體健康造成巨大危害,還將嚴(yán)重影響苦蕎及其制品的經(jīng)濟(jì)效益[7]。目前有關(guān)苦蕎中真菌毒素的研究還比較少,尤其是多組分真菌毒素的同時(shí)檢測(cè)[6]。
食品中真菌毒素的檢測(cè)方法有很多,包括高效液相色譜法、薄層色譜法、色譜質(zhì)譜聯(lián)用法、酶聯(lián)免疫法等[8-9]。其中,液相色譜-串聯(lián)質(zhì)譜法是最常用的檢測(cè)方法[10-12]。該方法可以實(shí)現(xiàn)多目標(biāo)物的同時(shí)檢測(cè),靈敏度高,能提供化合物的結(jié)構(gòu)信息,具有更高的可靠性。作為復(fù)雜基質(zhì)中多組分真菌毒素的關(guān)鍵步驟,簡單、高效、低成本的樣品前處理方法能進(jìn)一步提高分析的準(zhǔn)確性和實(shí)用性[13]。QuEChERS法因其簡便、有效、溶劑用量少被廣泛用于食品中農(nóng)藥殘留的提取凈化[14]。近年來,已逐漸被用于食品中真菌毒素的前處理并取得一定進(jìn)展[10,15]。由于苦蕎基質(zhì)復(fù)雜,而真菌毒素常以痕量存在,該研究選擇結(jié)合QuEChERS法和超高效液相色譜-串聯(lián)質(zhì)譜,建立了簡便、有效的分析方法,有利于實(shí)現(xiàn)苦蕎樣品中多組分真菌毒素的同時(shí)檢測(cè)。
1?材料與方法
1.1?材料與試劑
10種真菌毒素標(biāo)準(zhǔn)品:黃曲霉毒素B1、B2、G1、G2,玉米赤霉烯酮,伏馬毒素B2,T-2毒素,HT-2毒素,赭曲霉毒素A,柄曲霉素,純度95.0%~98.9%,奧地利Biopure公司;甲醇、乙腈,HPLC級(jí),美國Fisher Scientific公司;甲酸、乙酸銨,MS級(jí),德國Sigma公司;無水硫酸鎂、氯化鈉,分析純,成都科隆化學(xué)品有限公司;尼龍針式濾頭(0.22 μm),天津津騰實(shí)驗(yàn)設(shè)備有限公司;凈化材料(PSA、GCB、C18、Al2O3),上海安譜實(shí)驗(yàn)科技股份有限公司;氧化石墨烯,自制。
1.2?儀器與設(shè)備?超高效液相色譜-三重四級(jí)桿質(zhì)譜(Acquity Xevo TQ-XS,美國Waters公司);C18色譜柱(50 mm×2.1 mm×2.7 μm,美國Waters公司);電子分析天平(XS205DU,梅特勒-托利多儀器有限公司);渦旋混合器(XW-80A,上海滬西分析儀器有限公司);純水機(jī)(Milli-Q integral 3,美國MILLIPORE公司);離心機(jī)(3K30,德國Sigma公司);高速粉碎機(jī)(德國IKA公司)。
1.3?樣品前處理
1.3.1?樣品制備。由成都海關(guān)技術(shù)中心理化實(shí)驗(yàn)室隨機(jī)提供15個(gè)苦蕎樣品。樣品用高速粉碎機(jī)粉碎,過篩;混合均勻后縮分至500 g,密封保存于4 ℃以下,供檢測(cè)用。
1.3.2?樣品提取。取2 g(精確至0.01 g)樣品粉末于50 mL離心管中,加入10 mL去離子水將其浸沒。然后加入10 mL乙腈,渦旋混勻,搖床振蕩30 min。提取后以10 000 r/min的速度離心,將上清液轉(zhuǎn)移到干凈的離心管中。快速加入2 g無水MgSO4和1 g NaCl,并渦旋3 min。再次離心,取上清液備用。
1.3.3?樣品凈化。準(zhǔn)確移取2 mL提取液,加入30 mg C18,渦旋1 min后離心。將1 mL上清液在40 ℃下用氮?dú)饩徛抵两桑尤? mL初始流動(dòng)相,繼續(xù)渦旋1 min。最后用0.22 μm濾膜過濾待測(cè)液,收集至進(jìn)樣瓶,備用。
1.4?儀器分析條件
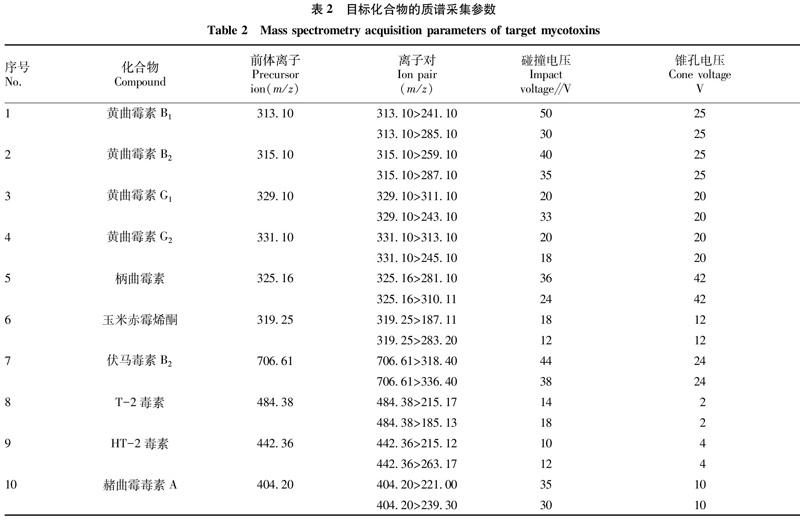
1.4.1?色譜條件。流動(dòng)相:0.1%甲酸水+5 mmol/L乙酸銨(A相),0.1%甲酸甲醇+5 mmol/L乙酸銨(B相);柱溫:40 ℃;進(jìn)樣量:2 μL;梯度洗脫程序見表1。
1.4.2?質(zhì)譜條件。
質(zhì)譜配備電噴霧離子源(150 ℃,正離子模式ESI+);檢測(cè)方式:多反應(yīng)監(jiān)測(cè)模式(MRM);錐孔氣流速:150 L/h;脫溶劑氣溫度及流速:250 ℃,800 L/h;目標(biāo)化合物物的采集參數(shù)(包括離子對(duì)、碰撞電壓、錐孔電壓)見表2。
2?結(jié)果與分析
2.1?提取溶劑的優(yōu)化
由于去離子水能促進(jìn)真菌毒素從樣品基質(zhì)釋放出來,真菌毒素的提取過程中首先加入10 mL去離子水浸泡樣品。在此基礎(chǔ)上,3種提取溶劑被用于樣品基質(zhì)中10種真菌毒素的提取,包括①10 mL去離子水,10 mL甲醇;②10 mL去離子水,10 mL乙腈;③10 mL去離子水,10 mL 1%甲酸乙腈。試驗(yàn)結(jié)果表明,甲醇有機(jī)相不能通過加入無機(jī)鹽與水相分離。另一方面,第3種提取溶劑會(huì)導(dǎo)致伏馬毒素B2的回收率異常高。而采用第2種提取溶劑時(shí),真菌毒素的萃取效率和回收率均能得到較為滿意的結(jié)果。因此,最終選擇10 mL去離子水、10 mL乙腈為提取溶劑。
2.2?凈化材料的優(yōu)化
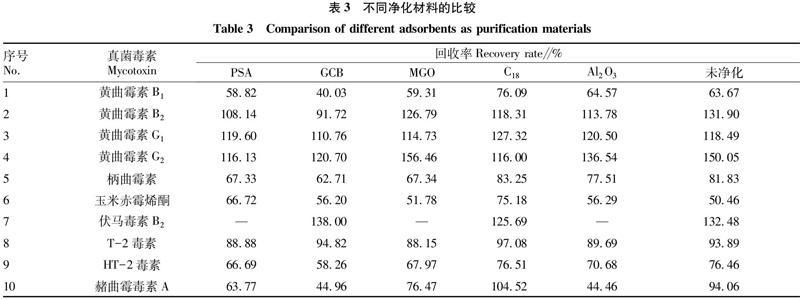
為了降低共提取化合物的干擾,試驗(yàn)測(cè)試了多種類型的凈化材料,包括N-丙基乙二胺(PSA)、石墨化炭黑(GCB)、磁性氧化石墨烯(MGO)、C18和Al2O3。為了比較不同材料的凈化能力,進(jìn)行了6組平行試驗(yàn),包括未凈化的提取溶液。由表3可見,對(duì)于PSA材料,伏馬毒素B2沒有回收率,這可能是因?yàn)镻SA含有氨基官能團(tuán),能與含羧基基團(tuán)的化合物發(fā)生化學(xué)吸附。相似地,與未凈化的提取溶液相比,含有羧基基團(tuán)的赭曲霉毒素A的回收率也較低。對(duì)于吸附能力較強(qiáng)的GCB,柄曲霉素和HT-2毒素的回收率有所降低,而黃曲霉毒素B1和赭曲霉毒素A的回收率更低。對(duì)于MGO,伏馬毒素B2同樣沒有回收率,這可能是由材料的氫鍵吸附造成。另一方面,比較MGO和未凈化提取溶液的試驗(yàn)結(jié)果發(fā)現(xiàn),兩者具有相似的目標(biāo)物回收率。說明MGO對(duì)苦蕎樣品中干擾物的凈化能力比較有限。Al2O3的堿性性質(zhì)造成伏馬毒素B2沒有回收率,而赭曲霉毒素A的回收率有所降低。相比之下,通過C18凈化的目標(biāo)物的回收率有所改善(75.18%~127.32%),它能降低樣品基質(zhì)的干擾,同時(shí)不對(duì)目標(biāo)物產(chǎn)生不必要的吸附。因此,最終選擇C18作為凈化材料。
2.3?基質(zhì)效應(yīng)的考察
通過基質(zhì)配標(biāo)校準(zhǔn)曲線的斜率與溶劑配標(biāo)校準(zhǔn)曲線的斜率百分比值定義方法的基質(zhì)效應(yīng)(信號(hào)增強(qiáng)或抑制,SSE),結(jié)果見表4。該比值代表了干擾物對(duì)目標(biāo)分析物離子化效率的影響。從表4可以看出,黃曲霉毒素G1、G2,T-2毒素,赭曲霉毒素A的基質(zhì)效應(yīng)尚在可接受范圍(80%~120%)。黃曲霉毒素B2和伏馬毒素B2則具有顯著的信號(hào)增強(qiáng)效應(yīng)(SSE值>100%),而其他4種真菌毒素(黃曲霉毒素B1、柄曲霉毒、玉米赤霉烯酮、HT-2毒素)具有25%~40%的信號(hào)抑制效應(yīng)(SSE值<100%)。
根據(jù)考察結(jié)果,50%的目標(biāo)真菌毒素具有顯著的基質(zhì)效應(yīng)。為了補(bǔ)償基質(zhì)效應(yīng)的影響,選用基質(zhì)配標(biāo)法進(jìn)行目標(biāo)分析物的定量分析。基質(zhì)匹配目標(biāo)分析物的MRM色譜圖如圖1所示。
2.4?線性關(guān)系、檢出限和定量限的考察
采用不含真菌毒素的苦蕎樣品,按建立的樣品預(yù)處理方法制備空白基質(zhì)溶液。通過在空白基質(zhì)液中加入相應(yīng)量的真菌毒素混合標(biāo)準(zhǔn)品,配制基質(zhì)匹配的系列標(biāo)準(zhǔn)溶液(0.5~50.0 μg/L,對(duì)于黃曲霉毒素B2、G2,濃度范圍為0.125~12.500 μg/L)。以目標(biāo)化合物的色譜峰峰面積為縱坐標(biāo)、溶液濃度為橫坐標(biāo),進(jìn)行線性回歸分析。方法的回歸方程、決定系數(shù)、線性范圍見表5。方法的檢出限(3倍信噪比)及定量限(10倍信噪比)通過線性方程中最低濃度點(diǎn)計(jì)算得到。
由表5可見,決定系數(shù)(R2)均不小于0.994 0,表明校正曲線在0.125~50.000 μg/L具有較好的線性關(guān)系。10種真菌毒素的檢出限(0.011~0.241 μg/L)及定量限(0.040~0.804 μg/L)表明方法具有較好的定性和定量分析能力。從另一方面來看,黃曲霉毒素B1、玉米赤霉烯酮和赭曲霉毒素A的檢測(cè)能力均能滿足多個(gè)國家對(duì)谷物中這3類真菌毒素的監(jiān)管要求(表6)。而其他7種真菌毒素目前暫無谷物的限量規(guī)定。
2.5?回收率和重現(xiàn)性試驗(yàn)
在12份空白樣品中分別加入一定量的混合標(biāo)準(zhǔn)溶液,得到2個(gè)濃度級(jí)別的6份平行加標(biāo)樣(2和10 μg/L,對(duì)于黃曲霉毒素B2、G2,濃度分別為0.5和2.5 μg/L)。按上述方法制備樣品并進(jìn)行檢測(cè),計(jì)算各真菌毒素的平均回收率和相對(duì)標(biāo)準(zhǔn)偏差(RSD)。結(jié)果表明(表7),平均回收率為89.70%~105.83%,RSD值為0.82%~8.45%,符合歐盟No 401/2006條例對(duì)真菌毒素定量分析的性能標(biāo)準(zhǔn)(回收率在70%~110%,RSD<15%)。
2.6?實(shí)際樣品的檢測(cè)
將建立的方法用于15個(gè)隨機(jī)樣品的檢測(cè)分析。對(duì)于實(shí)際樣品分析,采用相對(duì)離子豐度作為額外的定性分析準(zhǔn)則。樣品的檢測(cè)結(jié)果見表8。
從檢測(cè)結(jié)果(表8和圖2)可以看出,46.7%的樣品存在真菌毒素污染。雖然大部分毒素的污染濃度都低于方法的定量限,污染通常伴隨多種類型的真菌毒素。對(duì)于13號(hào)樣品,黃曲霉毒素B1的濃度超過了歐盟的監(jiān)管限量。而其他被檢測(cè)到的柄曲霉素、伏馬毒素B2、T-2毒素、HT-2毒素暫沒有針對(duì)谷物的限量規(guī)定。
3?討論
該研究成功建立了苦蕎基質(zhì)中10種不同真菌毒素的QuEChERS-超高效液相色譜-串聯(lián)質(zhì)譜分析方法。該方法簡單可靠、靈敏有效,適合大批量樣品的高通量分析。從實(shí)際苦蕎樣品的分析得到以下結(jié)論:①該方法用于苦蕎樣品中多種真菌毒素的檢測(cè)分析是切實(shí)可行的;②應(yīng)探究更多種類的真菌毒素的同時(shí)檢測(cè)方法;③由于真菌毒素污染通常伴隨多種類型的真菌毒素,多組分真菌毒素的污染監(jiān)管是很有必要的。
參考文獻(xiàn)
[1]陳曦.苦蕎功能成分研究文獻(xiàn)綜述[J].食品安全導(dǎo)刊,2018(33):162.
[2]林兵,胡長玲,黃芳,等.苦蕎麥的化學(xué)成分和藥理活性研究進(jìn)展[J].現(xiàn)代藥物與臨床,2011,26(1):29-32.
[3]ZHANG Z L,ZHOU M L,TANG Y,et al.Bioactive compounds in functional buckwheat food[J].Food research international,2012,49(1):389-395.
[4]賈冬英,姚開,張海均.苦蕎麥的營養(yǎng)與功能成分研究進(jìn)展[J].糧食與
飼料工業(yè),2012(5):25-27.
[5]張余,黃小燕,劉昌敏,等.苦蕎營養(yǎng)保健成分及其食品開發(fā)研究進(jìn)展與展望[J].糧食與油脂,2019,32(8):12-14.
[6]ARROYO-MANZANARES N,HUERTAS-PREZ J F,GARCA-CAMP AA A M,et al.Simple methodology for the determination of mycotoxins in pseudocereals,spelt and rice[J].Food control,2014,36(1):94-101.
[7]FUNG F,CLARK R F.Health effects of mycotoxins:A toxicological overview[J].Journal of toxicology:Clinical toxicology,2004,42(2):217-234.
[8]TURNER N W,SUBRAHMANYAM S,PILETSKY S A.Analytical methods for determination of mycotoxins:A review[J].Analytica chimica acta,2009,632(2):168-180.
[9]李蓉,黃瑩偲,王勇,等.食品中真菌毒素檢測(cè)技術(shù)的研究進(jìn)展[J].中國衛(wèi)生檢驗(yàn)雜志,2015,25(18):3195-3198.
[10]FRENICH A G,ROMERO-GONZLEZ R,GMEZ-PREZ M L,et al.Multi-mycotoxin analysis in eggs using a QuEChERS-based extraction procedure and ultra-high-pressure liquid chromatography coupled to triple quadrupole mass spectrometry[J].Journal of chromatography A,2011,1218(28):4349-4356.
[11]LIU Q T,KONG W J,GUO W Y,et al.Multi-class mycotoxins analysis in Angelica sinensis by ultra fast liquid chromatography coupled with tandem mass spectrometry[J].Journal of chromatography B,2015,988:175-181.
[12]CHO H D,SUH J H,F(xiàn)ENG S,et al.Comprehensive analysis of multi-class mycotoxins in twenty different species of functional and medicinal herbs using liquid chromatography-tandem mass spectrometry[J].Food control,2019,96:517-526.
[13]譚杰,杜苑琪,肖小華,等.食品中霉菌毒素樣品前處理及分析方法研究進(jìn)展[J].分析測(cè)試學(xué)報(bào),2017,36(6):829-840.
[14]ANASTASSIADES M,LEHOTAY S J,TAJNBAHER D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J].Journal of AOAC International,2003,86(2):412-431.
[15]YOGENDRARAJAH P,VAN POUCKE C,DE MEULENAER B,et al.Development and validation of a QuEChERS based liquid chromatography tandem mass spectrometry method for the determination of multiple mycotoxins in spices[J].Journal of chromatography A,2013,1297:1-11.
- 安徽農(nóng)業(yè)科學(xué)的其它文章
- 基于布魯姆教育目標(biāo)分類法的線上線下混合式教學(xué)模式在水生生物學(xué)課程教學(xué)中的應(yīng)用探索
- 海南自貿(mào)港建設(shè)背景下的水產(chǎn)養(yǎng)殖學(xué)教學(xué)改革探索
- 網(wǎng)絡(luò)環(huán)境下海洋生物數(shù)字實(shí)驗(yàn)教學(xué)資源建設(shè)
- 小農(nóng)戶與現(xiàn)代農(nóng)業(yè)銜接的邏輯
- 驢胎盤活性成分及功能特性分析
- 農(nóng)林院校“在線平臺(tái)+翻轉(zhuǎn)課堂”教學(xué)模式的課程思政研究與實(shí)踐

