茶樹精油對擴展青霉線粒體功能的影響
陳雪昱,鄒秀容,2,韋瑩瑩,許 鳳,王鴻飛,邵興鋒,*
(1.寧波大學食品與藥學學院,浙江 寧波 315800;2.韶關學院英東食品學院,廣東 韶關 512005)
擴展青霉(Penicillium expansum)引發的青霉病是造成蘋果[1]、西紅柿[2]、櫻桃番茄[3]等果蔬采后腐爛的主要原因。化學殺菌劑是目前防治此類真菌病害的主要手段,但其局限性明顯,易導致真菌產生耐藥性,對人體健康和農業生態產生危害,這迫使研究人員尋找對人類健康和環境安全的方法來替代或部分替代化學殺菌劑。近年來,植物精油作為一種天然的綠色農藥、環境友好型的生防試劑,廣泛用于多種果蔬的采后真菌病害防控,不但抑菌譜廣,且安全可靠[4]。在櫻桃番茄[3]、甜桔[5]、胡蘿卜[6]、藍莓[7]等果蔬上的應用都表明,植物精油具有顯著的防腐保鮮效果。
茶樹精油(tea tree oil,TTO)是由桃金娘科(Myrtaceae)白千層屬(Melaleuca)灌木樹種互生葉白千層(Meloleuca ahernifolia)的新鮮枝葉經水蒸氣蒸餾得到的芳香精油,包含松油烯-4-醇,α-松油醇和1,8-桉葉油等揮發性物質[8]。TTO無毒、氣味清新怡人,被認為是抗菌、抗氧化和抗癌藥品的良好選擇[9]。Shi Ce等[10]研究發現TTO可以抑制金黃色葡萄球菌的生長和腸毒素的產生,且精油濃度越高,其抑制作用越明顯。靜瑋等[11]研究TTO對香蕉的影響時發現,TTO能顯著抑制炭疽病菌菌絲的生長,有利于香蕉的保鮮。鐘業俊等[12]研究也表明,TTO能延緩香蕉腐爛。程賽等[13]用熏蒸法處理草莓,發現TTO可抑制灰葡萄孢霉(Botrytis cinerea)和根霉的孢子萌發以及菌絲生長,降低其發病率,延長草莓的貨架期;TTO也可以有效控制櫻桃番茄上由B.cinerea和P.expansum導致的腐爛[14]。因此,TTO具備商業化應用前景。
本課題組前期的研究發現,TTO的特征組分松油烯-4-醇和1,8-桉葉素可以作用于B.cinerea的不同亞細胞部位[15]和不同靶基因[16],進而通過破壞B.cinerea的膜結構導致細胞內物質泄漏[17]、影響B.cinerea線粒體功能[18]來發揮抑菌作用。TTO對P.expansum的抑制效果弱于對B.cinerea的抑制[19],這可能與P.expansum含有更高的細胞膜脂質和甾醇有關[14]。當TTO劑量在6.5 mL/L時可完全抑制P.expansum的菌絲生長[14],造成P.expansum細胞膜中的脂質和甾醇含量的下降,進而破壞呼吸代謝和細胞膜透性,導致P.expansum菌絲體和超微結構的顯著改變[14]。本實驗以TTO處理的P.expansum為對象,進一步深入研究活性氧(reactive oxygen species,ROS)的積累及線粒體功能相關酶活性的變化,并采用掃描電子顯微鏡(scanning electron microscopy,SEM)和透射電子顯微鏡(transmission electron microscopy,TEM)觀察線粒體自身形態和超微結構受TTO的影響,以期能更好地揭示TTO對P.expansum生理功能的干擾機制,為TTO在果蔬采后領域的商業化應用提供理論參考。
1 材料與方法
1.1 菌株、材料與試劑
擴展青霉(P.expansum)購自中國農業微生物菌種保藏中心。
TTO由福州美樂蓮生物科技有限公司提供,符合ISO 4730規定(松油烯-4-醇質量分數>30%、1,8-桉葉素質量分數<5%),是一種GRAS(generally recognized as safe)物質,可用于食品行業。
ROS測試盒、ATP酶(ATPase)試劑盒、檸檬酸合成酶(citrate synthase,CS)檢測試劑盒、異檸檬酸脫氫酶(isocitrate dehydrogenase,ICDH)檢測試劑盒、α-酮戊二酸脫氫酶(α-ketoglutarate dehydrogenase complex,α-KGDH)檢測試劑盒、蘋果酸脫氫酶(malate dehydrogenase,MDH)檢測試劑盒、琥珀酸脫氫酶(succinate dehydrogenase,SDH)檢測試劑盒 南京建成生物工程研究所;鋨酸、環氧樹脂包埋劑、醋酸雙氧鈾 美國SPI-CHEM公司。
1.2 儀器與設備
QHZ-12A型組合式恒溫振蕩培養箱 江蘇省太倉市華美生化儀器廠;H2500R-2型高速冷凍離心機 長沙湘儀離心機儀器有限公司;Infinite M200 Pro多功能熒光酶標儀 瑞士Tecan公司;HCP-2臨界點干燥機、20nm E-1010真空離子濺射鍍金膜機、S-3400N SEM、H7650 TEM 日本日立公司;1260高效液相色譜儀 美國安捷倫公司。
1.3 方法
1.3.1 TTO對P.expansum的處理
1.3.1.1 TTO對P.expansum孢子的處理
根據Tian Jun等[20]的方法并略加修改,進行TTO對P.expansum孢子的處理。參考Li Yonghua等[14]報道的TTO對P.expansum的最小抑菌濃度(minimum inhibition concentration,MIC),本實驗設置TTO的處理濃度為6.5 μL/mL(即MIC)。P.expansum菌種經活化后,轉接到PDA培養基(去皮馬鈴薯200 g,加水1000 mL煮沸30 min,過濾后加入20 g葡萄糖和20 g瓊脂)上25 ℃培養3 d,用無菌生理鹽水洗下孢子,用血球計數板調節孢子濃度至2×107個/mL。孢子分別在濃度為1/4 MIC、1/2 MIC、MIC和2 MIC的TTO中處理2 h,處理后5 000 r/min離心5 min,并用0.05 mol/L磷酸鹽緩沖液(phosphate buffered saline,PBS)(pH 7.0)清洗3 次,離心收集孢子。
1.3.1.2 TTO對P.expansum菌絲的處理
P.expansum菌種在PDA培養基上25 ℃培養3 d后用無菌生理鹽水沖洗孢子,用血球計數板調至孢子濃度為106個/mL。移取3 mL孢子懸浮液,加入到含有150 mL PDB培養基(去皮馬鈴薯200 g,加水1 000 mL煮沸30 min,過濾后加入20 g葡萄糖)的錐形瓶中,25 ℃下150 r/min搖床培養3 d。在收集菌體2 h前(即搖床培養70 h時),在錐形瓶中分別加入一定量的含TTO的1%無菌吐溫-80液體培養基,使TTO濃度分別為1/4 MIC、1/2 MIC、MIC和2 MIC;以加入不含TTO的6%無菌吐溫液體培養基為對照組(即錐形瓶中僅含有1%的吐溫-80)。每個組別設3 個平行,所有的錐形瓶在搖床25 ℃ 150 r/min繼續培養2 h,再4 000 r/min離心10 min,并用4 ℃無菌的生理鹽水清洗3 遍后收集得到菌絲,用于后續的線粒體提取和線粒體功能相關代謝酶活性研究。
1.3.2 孢子ROS相對含量的測定
ROS的相對含量按照ROS測試盒說明書步驟進行測定,使用多功能熒光酶標儀測定熒光值,以對照組熒光值為100%,計算各處理組與對照組熒光值的比值,記為ROS相對含量。
1.3.3 菌絲線粒體的提取
線粒體的提取參考羅曼等[21]的方法并稍作改進,所有過程均在4 ℃下操作完成。配制線粒體分離介質(含0.01 mol/L Tris、1 mmol/L Na2EDTA、10 g/100 mL蔗糖,pH 7.4)并預冷。將1.3.1.2節收集到的菌絲于研缽中加入液氮進行快速充分研磨,將研磨后的樣品與線粒體分離介質按照1∶8(m/V)的比例加入預冷的離心管中,4 ℃、4 000 r/min離心10 min。收集上清液再于4 ℃、10 000 r/min離心15 min后保留沉淀,沉淀物再次按照1∶8(m/V)的比例加入線粒體分離介質后漩渦振蕩20 s使其懸浮,繼續4 ℃、10 000 r/min離心15 min。重復上述步驟洗滌2 次,向最終的沉淀物中加入1 mL線粒體分離介質,用移液槍吹打均勻,即得到線粒體原液,并于-40 ℃保存備用。
1.3.4 菌絲線粒體的形態結構觀察
采用SEM觀察線粒體形態,具體參照Yu等[15]的方法。將MIC TTO處理組菌絲和對照組所提取的線粒體樣品,利用體積分數2.5%的戊二醛固定,樣品經乙醇逐級洗脫,放入臨界點干燥機中進行干燥,再在高真空離子濺射鍍膜機進行金/鈀涂層,于SEM下放大40 000 倍觀察和拍照,每個重復組中取2 個平行進行觀察。
采用TEM觀察線粒體超微結構,具體參照Yu等[15]的方法。將經MIC TTO處理組菌絲和對照組所提取的線粒體樣品,于體積分數2.5%的戊二醛中固定,再用體積分數1%鋨酸固定,后經乙醇逐級脫水、環氧樹脂包埋、聚合后修塊,超薄切片。切片經醋酸雙氧鈾和檸檬酸鉛染液分別進行鈾、鉛雙染后,于TEM下放大120 000 倍觀察和拍照,每個重復組中取2 個平行進行觀察。
1.3.5 菌絲體內ATP含量和三羧酸循環相關酶活力的測定
1.3.5.1 ATP含量測定
ATP含量測定參考Jiang Weibo等[22]的方法。取1.3.1.2節收集到的MIC TTO處理組和對照組菌絲各2 g,加入10 mL 0.6 mol/L高氯酸溶液,冰水浴1 min,8 000×g離心10 min,吸取6 mL上清液,用1 mol/L KOH溶液調節其pH值至6.5~6.8之間,冰水浴30 min使高氯酸鉀大量沉淀,過濾除去沉淀。ATP含量采用高效液相色譜法測定,色譜柱為配備的XDB C18柱(150 mm×4.6 mm),柱溫25 ℃,緩沖液為50 mmol/L KH2PO4-K2HPO4(含1 mmol/L EDTA,pH 6.0),流動相:V(緩沖液)∶V(甲醇)=97.5∶2.5,15 min等梯度洗脫,流速為1.0 mL/min。檢測波長為259 nm,進樣量為10 μL。以ATP為標準品,以保留時間定性,峰面積定量,每個進樣重復3 次。
1.3.5.2 ATPase活力測定
稱取1.3.1.2節收集到的MIC TTO處理組和對照組的菌絲各1 g,加5 mL 0.05 mol/L PBS (pH 7.2),超聲破碎15 min后4 ℃、1 500 r/min離心10 min獲得粗酶液。ATPase活力用ATPase試劑盒進行測定。
1.3.5.3 三羧酸循環相關酶活力測定
取1/4 MIC、1/2 MIC、MIC、2 MIC TTO處理組和對照組菌絲樣品各0.2 g,加5 mL 0.05 mol/L PBS(pH 7.2),超聲破碎15 min后4 ℃、1 500 r/min離心10 min獲得粗酶液。用相應試劑盒測定CS、ICDH和α-KGDH活力。
1.3.5.4 MDH和SDH活力測定
稱取1/4 MIC、1/2 MIC、MIC、2 MIC TTO處理組和對照組菌絲樣品各0.2 g,分別加入1.8 mL生理鹽水,冰水浴條件下機械勻漿,2 500 r/min離心10 min獲得粗酶液。用相應試劑盒測定MDH和SDH活力。
1.4 數據統計與分析
所有實驗重復3 次,數據圖片用Origin Pro 8.0軟件繪制。采用SASS 17軟件的單因素方差分析中的鄧肯氏多重比較進行顯著性差異分析,P<0.05表示差異顯著。
2 結果與分析
2.1 TTO處理對P.expansum孢子ROS相對含量的影響
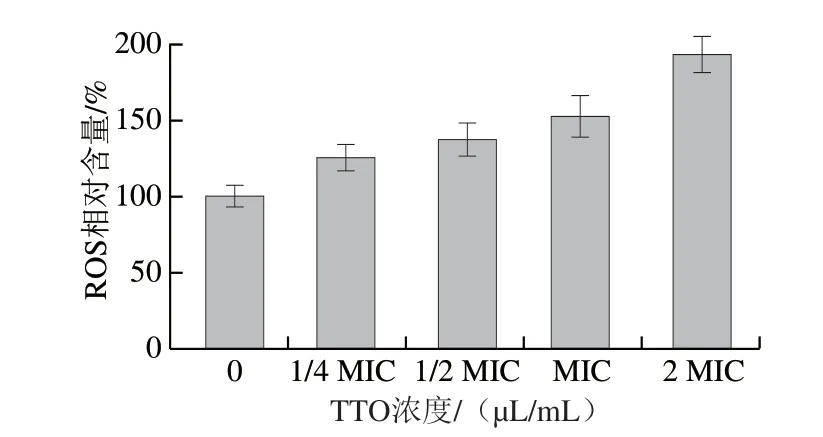
圖1 TTO對P.expansum孢子中ROS相對含量的影響Fig.1 Effect of TTO on ROS relative content of P.expansum spores
由圖1可知,隨著精油濃度的增加,P.expansum孢子中ROS相對含量增加。與對照組相比,1/4 MIC、1/2 MIC、MIC、2 MIC TTO處理組的ROS相對含量分別上升了125%、137%、152%和193%。結果表明,不同濃度TTO處理均能使孢子內ROS大量積累。
2.2 TTO處理對P.expansum菌絲體內線粒體形態和超微結構的影響
SEM觀察發現對照組P.expansum線粒體呈正常均勻的短棒狀,形態飽滿、表面光滑、完整、有規則;TTO處理組P.expansum的線粒體則出現皺縮、干癟、不規則凹陷,形狀異常(圖2A)。TEM觀察發現對照組P.expansum內外線粒體膜清晰可見,線粒體脊排列規則有序,而TTO處理組P.expansum的線粒體則呈現出腫脹的形態,短脊斷裂、消失,囊泡出現(圖2B),說明TTO使P.expansum線粒體基質腫脹、透明化,導致線粒體原先的內部結構被破壞,基質損失。

圖2 P.expansum菌絲體內線粒體形態(A)及超微結構(B)變化Fig.2 Changes in mitochondrial morphology (A) and ultrastructure (B) of P.expansumc observed by TEM and SEM
2.3 TTO處理對P.expansum菌絲體內ATP含量和ATPase活力的影響
如圖3所示,對照組P.expansum菌絲體細胞內部ATP含量為2.13 μg/g,而MIC TTO處理后P.expansum菌絲體細胞內部ATP含量為0.43 μg/g,下降了79.8%,表明MIC TTO處理極顯著降低了P.expansum菌絲體細胞內部ATP的含量(P<0.01),導致了細胞內部ATP的流失。ATPase的活力呈現出與ATP含量相同的變化趨勢,對照組ATPase活力為8.53 U/g,MIC TTO處理組ATPase活力為2.62 U/g,下降了69.3%(P<0.01)。結果表明,MIC濃度TTO處理導致菌絲體細胞內部ATP泄漏,并抑制了ATPase活力。

圖3 TTO處理對P.expansum菌 絲體內ATP含量(A)和ATPase活力(B)的影響Fig.3 Effect of TTO on the content of ATP (A) and the activity of ATPase (B) in P.expansum mycelia
2.4 TTO處理對P.expansum菌絲體內CS、ICDH、α-KGDH活力的影響

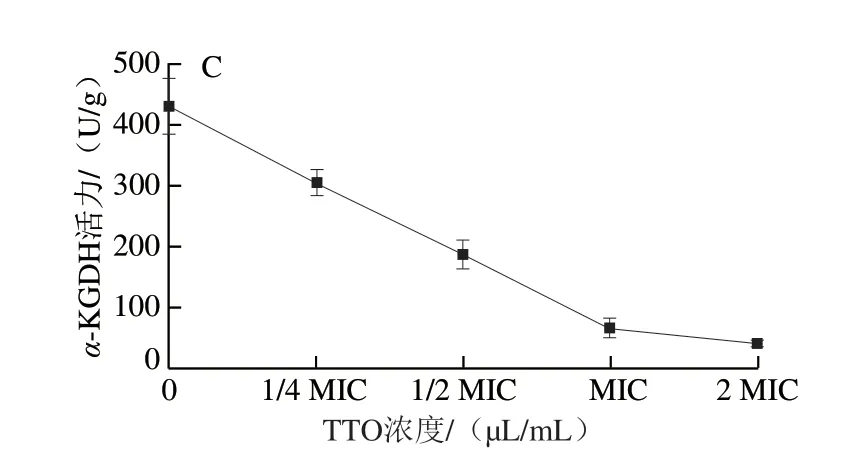
圖4 TTO對P.expansum 菌絲體內CS(A)、ICDH(B)和α-KGDH(C)活力的影響Fig.4 Effect of TTO on the activities of CS (A), ICDH (B) and α-KGDH (C)in P.expansum mycelia
由圖4可知,TTO處理組P.expansum中CS、ICDH、α-KGDH活力隨著TTO處理濃度的增加均呈現出下降的趨勢。當TTO濃度為1/2 MIC時,相對于對照組,CS、ICDH、α-KGDH活力分別下降了81.33%、58.81%和56.41%。當TTO濃度增加至MIC時,CS、ICDH、α-KGDH活力與對照組相比較分別下降了85.8%、72.6%和84.6%。而當TTO濃度增加到2 MIC時,CS、ICDH、α-KGDH活力與對照組相比分別下降了90.15%、88.49%和90.68%,酶活力基本被抑制,說明P.expansum的三羧酸(tricarboxylic acid,TCA)循環受到抑制。
2.5 TTO處理對P.expansum菌絲體內MDH和SDH活力的影響

圖5 TTO對P.expansum 菌絲體內SDH活力(A)和MDH活力(B)的影響Fig.5 Effect of TTO on the activities of SDH (A) and MDH (B)in P.expansum mycelia
如圖5所示,隨著TTO濃度的增加,SDH和MDH活力均明顯下降。當TTO濃度為1/4 MIC時,P.expansum的SDH和MDH活力分別為27.5 U/g和117.7 U/g,同對照組相比分別下降了36.5%和7.82%。當TTO濃度增加到MIC時,SDH和MDH活力與對照組相比分別下降了59.6%和69.8%。而當TTO濃度增加到2 MIC時,SDH和MDH活力同對照組相比分別下降了82.7%和80.6%。結果表明,TTO處理可通過降低線粒體功能關鍵酶活力,從而影響P.expansum中線粒體的正常功能,從而抑制菌體活性。
3 討 論
近年來,植物精油作為一種天然的綠色農藥、環境友好型的生防試劑,廣泛用于多種果蔬的采后真菌病害防控,不但抑菌譜廣,且安全可靠[4]。但植物精油潛在的抑菌機制還沒有被完全了解,以前的研究認為植物精油對細胞膜有作用,包括對細胞膜的損傷,影響脂質、甾醇以及膜脂肪酸含量的變化[20,23-24],最終導致細胞物質的外泄和細胞的死亡。也有一些研究報道植物精油和其主要成分也可以通過影響線粒體的結構和功能產生抗菌活性[20,25],如本課題組的前期研究發現TTO可以顯著影響B.cinerea線粒體的形態和功能[18]。
線粒體是真核生物細胞內提供能量產生和代謝的關鍵細胞器,除此外還起到維持pH值穩定、調節膜電位、細胞代謝與凋亡的信號傳遞等作用[26]。Zheng Shiju等[25]研究表明檸檬醛可以通過影響線粒體來發揮其抑菌活性,而且隨著檸檬醛濃度的增加,線粒體的凹陷越明顯,內部結構被破壞越嚴重。原因是線粒體膜的通透性增加,膜內小分子物質的損失和細胞新陳代謝的差異導致了線粒體的損傷,從而影響線粒體的組織和功能[20]。在本研究中,通過SEM和TEM觀察,可以清晰發現TTO對線粒體的內外部結構產生作用,導致線粒體內部呈現出空腔和混亂,表面凹陷破損,內部成分被嚴重破壞,從而使線粒體無法正常發揮功能。細胞內外ATP含量的變化可以用來反映線粒體膜發生了不可逆轉的破壞[25]。本實驗發現,TTO處理后細胞內部ATP含量明顯下降,所以TTO處理確實使線粒體膜的通透性發生變化,造成線粒體表面缺陷,從而導致細胞內部ATP的泄漏和細胞外部ATP含量的增加。ATP的泄漏通常意味著能量產生途徑的損傷。ATPase是細胞內產生能量的關鍵酶。在ATPase的分解作用下,ATP中存儲的能量被釋放出來,用于生物的生命活動,例如細胞分裂、生長和礦質元素的吸收等[25]。本研究得出,TTO處理明顯抑制了ATPase的活性,表明TTO處理不僅造成線粒體破損,導致細胞內部ATP泄漏,還對細胞內能量產生途徑造成損傷,從而影響菌體活性,達到抑菌效果。
線粒體內部的TCA循環途徑可以提供細胞生命活動所需要的能量和減少還原力[27],TCA循環的破壞會導致細胞死亡[28]。CS、ICDH、α-KGDH、MDH和SDH都是在TCA循環、線粒體功能中發揮重要作用的酶。CS可以促進乙酰輔酶A的縮合,形成檸檬酸鹽、輔酶A和一個質子[29]。ICDH可以調節異檸檬酸進入TCA循環或者乙醛酸循環[30]。α-KGDH活力下降會導致TCA循環產生NADH和隨后細胞合成ATP的能力下降[31]。MDH可以將蘋果酸鹽轉化為草酰乙酸鹽[32]。SDH可以將氧化的琥珀酸鹽轉化為延胡索酸鹽,還可以將電子從琥珀酸鹽轉移到泛醇[33]。Zheng Shiju等[25]報道稱檸檬醛可以抑制青霉的TCA循環,而且隨著檸檬醛濃度的增加,CS、ICDH、α-KGDH的活性下降。在本研究中,MIC TTO處理幾乎完全抑制了CS、ICDH、α-KGDH的活性。Wu Xiuzhen等[34]研究表明羽苔素E能夠通過降低假絲酵母線粒體脫氫酶的活性來發揮抗菌活性。Tian Jun等[20]報道稱蒔蘿精油可以降低黃曲霉中脫氫酶的活性,表明蒔蘿精油可以通過破壞細胞膜的通透性來發揮抗菌活性。也有報道稱肉桂精油可以通過降低SDH和MDH活性來影響根霉菌的能量代謝[35],楊樹芽活性提取物對青霉處理后也出現了同樣的效果[36]。在本研究中,P.expansum菌絲體內的SDH和MDH的活力均隨著TTO處理濃度的增加而降低。可見,在TTO處理下,線粒體內TCA循環和線粒體功能相關的幾個重要酶的活性均被抑制,TCA循環和線粒體功能受到嚴重干擾,導致細胞無法正常代謝,菌體活性降低或喪失。說明TTO處理可破壞P.expansum線粒體相關代謝途徑,從而有效抑菌。
同時,線粒體呼吸鏈是內生ROS的主要來源,尤其是在線粒體受到破壞后[20]。ROS的積累會導致酶失活、膜破壞和細胞死亡[37]。ROS的積累也被認為是細胞凋亡的主要生物標記,還會導致細胞形態學的改變、細胞核的斷裂、染色質的凝集、細胞腫脹等[38]。蒔蘿油處理會導致黃曲霉ROS的積累和氧化損傷[20]。硼酸鹽處理也會使盤長孢狀刺盤孢子內部ROS積累,導致線粒體的損傷[39]。Wu Xiuzhen等[34]報道稱羽苔素E可以導致白色念珠菌線粒體的破壞和內部ROS的產生。Zheng Shiju等[25]研究發現檸檬醛處理會導致一個和多個電子傳遞鏈組分的顯著缺乏,損傷青霉的抗氧化系統和增加細胞內部的氧化壓力。本研究結果表明TTO處理可以誘導P.expansum體內ROS的產生和積累,這與線粒體的功能紊亂會導致細胞氧化損傷有關。
TTO處理導致了P.expansum孢子體內ROS的大量積累,損壞了菌絲線粒體形態和超微結構,造成了菌絲體內ATP流失,降低了菌絲體內線粒體功能相關酶類的活性。因此,認為線粒體功能的嚴重受損是TTO對P.expansum發揮抑制作用的重要原因。

