沙門氏菌檢測生物傳感器研究進展
吳有雪,吳美嬌,田亞晨,王 政,郭 亮,劉 程,方水琴,劉 箐
(上海理工大學醫療器械與食品學院,上海 200093)
沙門氏菌(Salmonella)感染是人們持續關注的公共衛生安全問題,據我國2015年食源性疾病監測數據顯示,沙門氏菌造成的食源性疾病占食源性疾病爆發總數的11.66%,是造成食源性疾病的第三大致病菌[1]。另外,2015年澳大利亞和2017年歐盟的食源性疾病監測數據顯示[2],由沙門氏菌引發的食源性疾病分別占食源性疾病爆發總數的63.03%、22.12%,是最主要的食源性致病菌。沙門氏菌正不斷威脅人們的生命健康,因此,對于食品中沙門氏菌的檢測十分重要。
沙門氏菌是一種革蘭氏陰性桿菌,有2 650多種血清型[3]。鼠傷寒型、甲型副傷寒型沙門氏菌易導致腸熱病,其中,鼠傷寒血清型沙門氏菌是最主要的造成全身感染的沙門氏菌[4]。傳統的沙門氏菌檢測方法包括分離培養和生化鑒定、免疫分析法、核酸分析法等,由于其靈敏度低、操作繁瑣、耗時耗力而逐漸被取代,各種新型的檢測方法不斷發展。生物傳感器是將生物信號與物理或化學換能器結合并轉化為可以監測信號的一類裝置[5],由于生物傳感器在沙門氏菌檢測中表現出優良的性能,逐漸得到了廣泛的應用。在各種類型的傳感器中,基于納米材料的生物傳感器是目前性能最好的生物傳感器[6]。這是由于納米材料獨特的結構可表現出力學、熱學、磁學、光學以及電學等不同方面的性質,將納米粒子的性質應用于生物信號的傳導以及生物信號的固化,有利于提高檢測的靈敏性,增強檢測的實時性及簡便性。使用生物傳感器檢測沙門氏菌操作更為簡便、檢測時間更短,有利于實現沙門氏菌的現場實時檢測。本文就沙門氏菌傳統檢測技術和檢測中各類生物傳感器進行了詳盡分析,并對沙門氏菌生物傳感器的應用進展進行了闡述,為沙門氏菌檢測技術的發展提供研究基礎和技術支持。
1 沙門氏菌傳統檢測技術
沙門氏菌傳統檢測技術主要包括常規培養法、核酸分析法、免疫學檢測法等。常規培養法主要依據各種行業標準和國家標準,這些標準的檢測方法可靠性高,但存在一些局限性。由于表面抗原的改變或丟失,同種血清型沙門氏菌的抗原性可能不同,致使血清學檢測方法的敏感性較低,容易產生假陰性[7-8]。此外,腸桿菌科之間生化反應多有交叉,可能會出現假陽性[9-10]。核酸分析法是對沙門氏菌特異性的核酸序列進行擴增或者識別的一種技術[11]。沙門氏菌含有特異性的保守序列侵襲蛋白A(invasion protein A,invA)基因[12],以此片段設計引物和探針進行聚合酶鏈式反應(polymerase chain reaction,PCR)鑒定是實驗室中常用的沙門氏菌檢測方法。目前所用的核酸分析法特異性高、準確性高,但需要專業的儀器設備和工作人員良好的操作水平,對于大規模爆發的沙門氏菌感染事件無法達到快速檢測的要求。免疫學檢測法依賴于抗原抗體的特異性結合,將生物信號放大為可以監測的化學信號,以達到檢測細菌的目的[13]。與常規培養法相比,免疫學檢測法特異性強、靈敏度高,是病原菌檢測中常用的方法。然而,這些方法在沙門氏菌檢測方面有一些潛在的缺點,包括耗時長、存在交叉反應等。
2 生物傳感器
生物傳感器是一類能感應生物反應并將生物反應經過信號放大轉化為可以檢測到的光、電等化學信號的裝置,其構造主要包括識別元件(抗原、抗體、酶、核酸、微生物、細胞、組織等)、信號轉導元件、信號放大元件(圖1[14])。生物傳感器檢測沙門氏菌是以抗原抗體的特異性識別、核酸或適配體對菌體的特異性識別為基礎,將生物信號放大并轉化為光學或者電化學信號,通過建立化學信號與沙門氏菌濃度之間的關系達到檢測的目的[15]。

圖1 生物傳感器基本組件圖[14]Fig.1 Basic components of biosensors[14]
2.1 光學沙門氏菌檢測生物傳感器
光學生物傳感器借助光吸收、熒光、聚集誘導發光、散射等光學現象實現生物信號的可監測化。基于光學原理的沙門氏菌檢測是利用光學材料對抗原、抗體或適配體進行修飾,然后通過抗原與抗體之間或者適配體與菌體之間的特異性結合,以材料光學特性的變化反映細菌濃度的變化,實現對沙門氏菌的檢測。表1總結了不同光學生物傳感器在沙門氏菌檢測中的應用,與傳統的檢測方法相比,各種生物傳感器檢測方法的靈敏度更高、檢測時間更短、檢測成本更低且不需要大型的儀器設備。除熒光標記形式的生物傳感器外,大多數生物傳感器都無需標記,操作更為簡便。其中,表面等離子共振(surface plasmon resonance,SPR)生物傳感器定量檢測范圍更廣、檢測時間更短,符合現場實時檢測的要求,具有很高的研究價值和廣泛的應用前景。
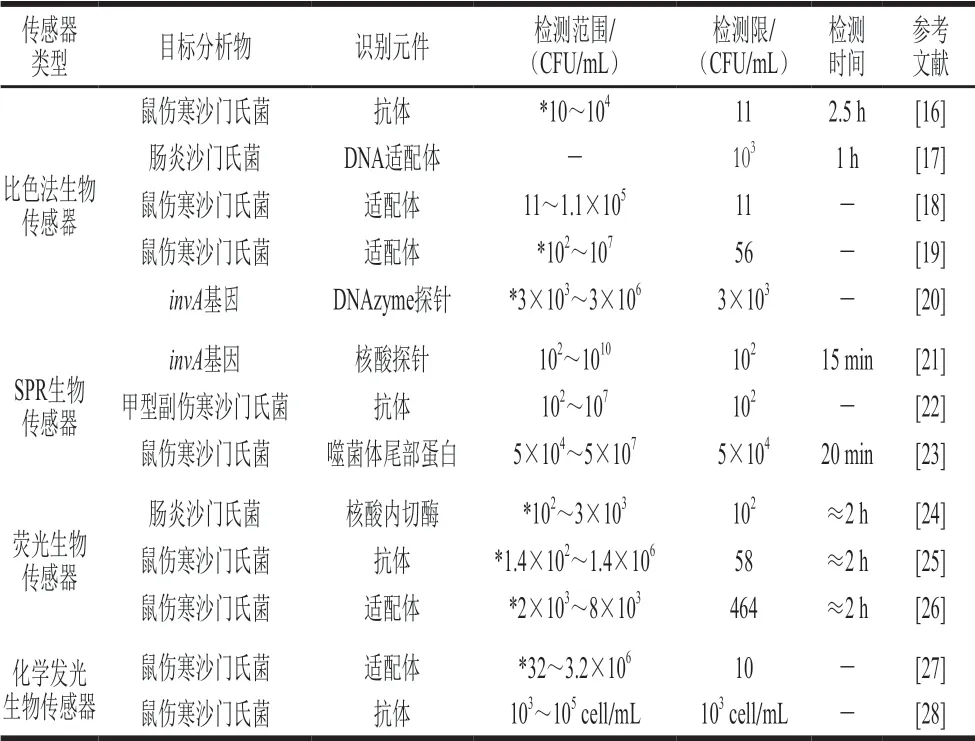
表1 不同光學生物傳感器在沙門氏菌檢測中的應用Table 1 Application of different optical biosensors in Salmonella detection
2.1.1 比色法生物傳感器
比色分析法是基于溶液對光的選擇性吸收而產生的可視化顏色或依靠光譜學儀器檢測光學變化的一類分析方法。利用比色分析法獨特的光學特性可以實現沙門氏菌的快速檢測,同時,納米顆粒、適配體等的引入在沙門氏菌檢測中發揮了重要的作用,提高了靈敏度,實現了檢測的可視化。
以抗原抗體特異性結合的免疫學檢測法與生物傳感器相結合,實現了沙門氏菌檢測的高靈敏度和高特異性。Wang Lei等[16]利用沙門氏菌抗體修飾的磁性顆粒形成磁柵分離柱來特異性捕獲沙門氏菌,抗體修飾的Pt@ZIF-8納米催化劑能夠催化3,3’,5,5’-四甲基聯苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)顯色。該比色生物傳感器達到了低至11 CFU/mL的沙門氏菌檢測限,靈敏度高。此外,適配體與探針在沙門氏菌傳感器中的應用也實現了高靈敏度及快速檢測的目的。Ma Xiaoyuan等[29]利用4-巰基苯甲酸和硫酸化的鼠傷寒沙門氏菌適配體對刺狀金納米粒子進行功能化修飾,并以此作為表面增強拉曼散射(surface-enhanced Raman scattering,SERS)的納米探針,利用適配體特異性捕獲沙門氏菌,建立夾心式的適配體生物傳感器檢測平臺。根據1 586 cm-1處SERS強度的線性關系實現沙門氏菌的定量檢測,線性檢測范圍為10~105CFU/mL,其檢測限達到4 CFU/mL。除抗體、適配體外,DNAzyme探針也可作為識別元件對沙門氏菌進行檢測。Luo Rong等[20]建立了基于DNAzyme探針自組裝金納米粒子的比色傳感器方法(圖2[20]),在靶序列存在的情況下,靶序列與捕獲探針結合,進一步與金納米粒子(gold nanoparticles,AuNPs)上修飾的檢測探針結合,形成夾心式結構。修飾在AuNPs上的DNAzyme探針與血紅素形成G-四鏈體-血紅素復合物,該復合物可催化H2O2與TMB的反應,發生顏色的變化,從而實現對沙門氏菌invA基因的檢測,其檢測限可達到3×103CFU/mL。該方法肉眼可見地實現了基因片段的鑒定,具有省時、簡便的特點。
2.1.2 SPR生物傳感器
SPR是光入射到金屬膜-液體界面上,金屬介質表面由于自由電子共振增強了對入射光的吸收,從而導致折射率改變的一種光學現象。SPR生物傳感器是基于SPR光學特性的檢測儀器,通過分析物與固定在SPR傳感器上的生物識別分子相結合的方式導致折射率變化,由生物分子的含量與折射率的線性關系反映樣品中沙門氏菌的濃度。Mazumdar等[30]利用SPR傳感器表面的金屬片連接沙門氏菌抗體,通過捕獲抗體與沙門氏菌結合引起SPR角度的變化檢測沙門氏菌,檢測限為1.25×105cell/mL。
為了更好地提高SPR生物傳感器的靈敏性,研究人員將金屬片與納米粒子相結合以增加折射率的變化,在沙門氏菌檢測中得到廣泛的應用。Liu Xia等[31]將磁性納米粒子修飾的抗體連接Au片,將其固定在SPR傳感器的表面以捕獲沙門氏菌,沙門氏菌與抗體結合后導致折射率發生改變。此傳感器對于腸炎沙門氏菌的檢測限低至14 CFU/mL,并在14~1.4×109CFU/mL內呈現良好的線性關系,該方法靈敏度高、檢測范圍廣,是一種很好的檢測腸炎沙門氏菌的方法。Lan Yubin等[32]也利用Au包裹的SPR傳感器特異性捕獲鼠傷寒沙門氏菌,檢測雞肉中沙門氏菌的含量,檢測限為106CFU/mL。同時,等離子聚合物的發現也提高了沙門氏菌快速檢測的速率,有效縮短了檢測時間。Makhneva等[33]利用戊二醛激活沉積在SPR傳感器表面的等離子體聚合物,以連接抗體,形成抗體的固定化平臺。通過抗原抗體結合引起的折射率變化反映沙門氏菌的濃度,其檢測限為105CFU/mL,檢測時間縮短至10 min。此方法檢測時間很短,但與上述基于納米粒子的SPR生物傳感器相比,檢測限差了4 個數量級,有待進一步的改善。
2.1.3 熒光生物傳感器
一些物質經過紫外光的照射后,其含有的各原子被激發,處于激發態的原子間發生原子能級的躍遷,從而反射出各種可見光,使物質呈現熒光現象。基于熒光的發生原理,利用物質之間的相互作用產生的熒光增強、熒光猝滅、催化熒光等現象,已被廣泛應用于微生物的鑒定。基于熒光現象的生物傳感器實現了沙門氏菌快速靈敏的檢測,且大大縮短了檢測時間。
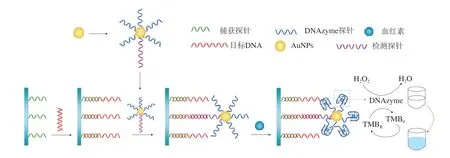
圖2 DNAzyme探針自組裝的金納米粒子作為單標記物的沙門氏菌比色傳感器[20]Fig.2 DNAzyme probe self-assembled gold nanoparticles used as a single label in colorimetric sensor for Salmonella detection[20]
Xiong Ying等[34]利用histone-ds-poly(AT)模板化的銅納米粒子的熒光信號作為信號轉導子,AT模板化的銅納米粒子連接捕獲抗體,實現對霍亂沙門氏菌的捕獲,沙門氏菌進一步結合氧化葡萄糖氧化酶標記的檢測抗體。氧化葡萄糖氧化酶可控制熒光物質的合成,由熒光信號的變化即可得出霍亂沙門氏菌濃度的變化,此熒光免疫生物傳感器對霍亂沙門氏菌具有極好的敏感性,檢出限為8.8×104CFU/mL,比基于TMB的傳統免疫分析法低3 個數量級。但此方法需要對檢測抗體進行標記,操作步驟繁瑣且每次標記的質量存在誤差。此外,一些無需標記的檢測方法也被用于沙門氏菌的檢測,Srinivasan等[26]建立了一種檢測鼠傷寒沙門氏菌的無標記適配體熒光傳感器的方法(圖3[26]),當適配體和AuNPs與羅丹明(rhodamine,RB)共混時,RB通過熒光共振能量轉移(fluorescence resonance energy transfer,FRET)發生明顯猝滅,鼠傷寒沙門氏菌加入后與適配體特異性結合導致RB熒光的恢復,熒光強度增強,從而顯示出樣品中鼠傷寒沙門氏菌濃度與熒光強度的線性關系,該方法在2×103~8×103CFU/mL呈現良好的線性關系,最低檢測限為464 CFU/mL。此外,量子點的發現也開創了新的沙門氏菌檢測方法,Wang Beibei等[35]基于最大發射量在514 nm(綠色發射)和578 nm(橙色發射)的量子點建立了FRET系統。腸炎沙門氏菌的結合導致FRET體系被破壞,雙色量子點的能量共振轉移被阻斷,使得綠色發射量子點熒光強度上升,橙色發射量子點熒光強度下降,此熒光強度變化與沙門氏菌濃度有良好的線性關系,檢測線性范圍為75~5×105CFU/mL,檢測限為10 CFU/mL。此方法檢測的線性范圍廣、檢測限低、操作簡便,并可對沙門氏菌進行定量檢測。
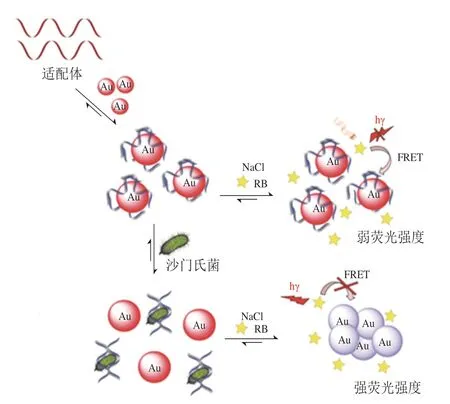
圖3 無標記適配體沙門氏菌熒光生物傳感器[26]Fig.3 Fluorescent biosensor with unlabeled aptamers for Salmonella detection[26]
2.1.4 化學發光生物傳感器
物質間發生化學反應,由激發態到基態過程中產生的光輻照現象或者激發態物質經能量轉移生成新物質并躍遷回基態而產生的光輻照現象都稱為化學發光現象。基于化學發光現象設計的生物傳感器使沙門氏菌簡便、靈敏、可視化的檢測成為可能。
Hao Liling等[27]采用適配體修飾的Fe3O4磁性納米顆粒作為捕獲探針,N-(4-氨丁基)-N-乙基異魯米諾結合AuNPs作為信號探針,構建穩態的化學發光體系。此穩態化學發光傳感器可特異靈敏地檢測鼠傷寒沙門氏菌,線性檢測范圍為32~3.2×106CFU/mL,最低檢測限為10 CFU/mL。另一項研究表明,Mn2+摻雜的NaYF4:Yb, Tm具有上轉換發光特性,Mn2+摻雜的NaYF4:Yb, Tm上轉換發光納米粒子與AuNPs間可產生靜電相互作用,導致發光猝滅現象的產生[36]。阻斷它們之間的相互作用即可導致發光的恢復,因此,Cheng Keyi等[36]利用此現象制備了一種高靈敏度的發光生物傳感器檢測鼠傷寒沙門氏菌。AuNPs與適配體連接的上轉換發光納米粒子可產生發光猝滅現象,添加鼠傷寒沙門氏菌后,由于上轉換發光納米粒子-適配體-鼠傷寒沙門氏菌的形成而導致發光的恢復。根據發光的強度可反映鼠傷寒沙門氏菌的濃度,其線性范圍為12~5×105CFU/mL,檢測限低至11 CFU/mL。以上兩種發光生物傳感器利用物質獨特的發光性能,無需任何標記,且操作簡便、靈敏度高、線性檢測范圍廣。
2.2 電化學沙門氏菌檢測生物傳感器
近年來電化學生物傳感器由于其高靈敏度、高通用性、儀器的便攜化受到人們的廣泛關注[37],這些傳感器依賴于抗原、抗體、核酸、適配體等的生物偶聯,將生物信號經電子、電阻傳導轉化為可以監測的化學信號。其中,最常見的生物傳感器包括電流型生物傳感器、阻抗型生物傳感器、電導型生物傳感器等。表2總結了不同電化學生物傳感器在沙門氏菌檢測中的應用,多數的電化學生物傳感器實現了對沙門氏菌的定量檢測,靈敏度高、檢測時間短。其中,電流型生物傳感器定量檢測范圍更廣,對于電流的測定更為常見。因此,此傳感器有望得到進一步的研究和完善,并得到推廣。
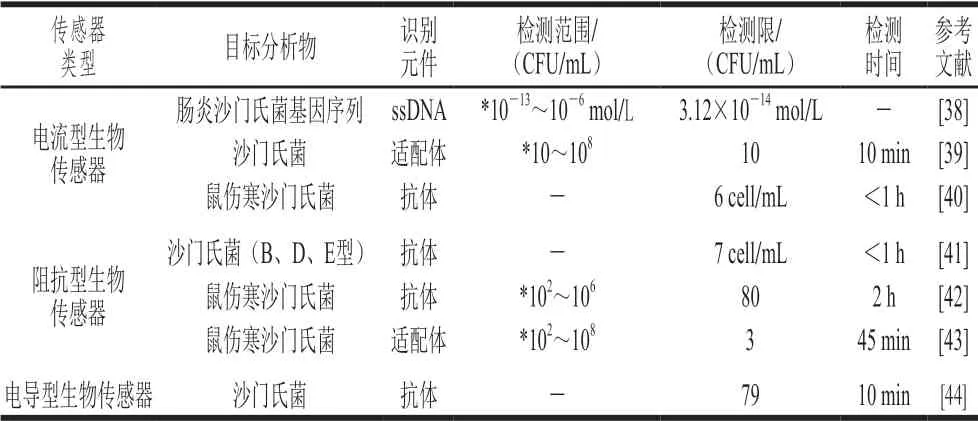
表2 不同電化學生物傳感器在沙門氏菌檢測中的應用Table 2 Application of different electrochemical biosensors in Salmonella detection
2.2.1 電流型生物傳感器
電流型生物傳感器是基于電流變化作為生物信號放大標志的檢測技術,通過生物信號產生離子聚合物電學特性的變化或者電子轉移而引起電極表面電流的變化,從而將生物信號轉變為電流信號。目前,已有多種電流型生物傳感器應用于沙門氏菌的檢測。
常用的電流型生物傳感器以免疫學檢測為基礎,Silva等[40]基于聚合物離子選擇電極對零電流離子流變化的高度敏感性原理,將AuNPs聚合物包膜涂附在自制電極表面,作為輸出信號放大的元件,并作為抗體的固化平臺。沙門氏菌結合前,電極內充液中離子流入達到穩定狀態,加入沙門氏菌后,傳感器表面的固定抗體與沙門氏菌結合引起離子通量的阻塞效應,從而產生電位的偏移,通過電位偏移量可檢測樣品中的鼠傷寒沙門氏菌(圖4[40])。檢測時間小于1 h,檢測限低至6 cell/mL。該方法的靈敏度高、操作簡便、檢測時間較短,但是無法進行沙門氏菌的定量檢測。Rao等[45]采用DNA重組技術制備重組鞭毛融合蛋白包裹絲網印刷電極,形成鞭毛融合蛋白-血清沙門氏菌-磷酸酶標記抗體的檢測平臺,以堿性磷酸酶水解產生的1-萘酚作為安培法的檢測信號,可靈敏地檢測人血清中的沙門氏菌,并與健康人血清的檢測結果形成明顯的對照。此外,對苯二酚在辣根過氧化物酶存在的條件下氧化還原H2O2,可以引起峰值電流的降低,Ye Yongkang等[46]利用此電流信號的變化設計了一種檢測沙門氏菌invA基因的電化學生物傳感器。該方法將聚吡咯還原的氧化石墨烯納米復合涂層在玻碳電極表面作為感應電流的信號元件,將辣根過氧化物標記的DNA與目標基因片段結合以催化對苯二酚與H2O2的氧化還原反應,該反應引起電化學信號的變化,實現了invA基因的檢測。該生物傳感器能重復穩定地檢測沙門氏菌,檢測范圍為9.6~9.6×104CFU/mL,檢測限為8.07 CFU/mL。
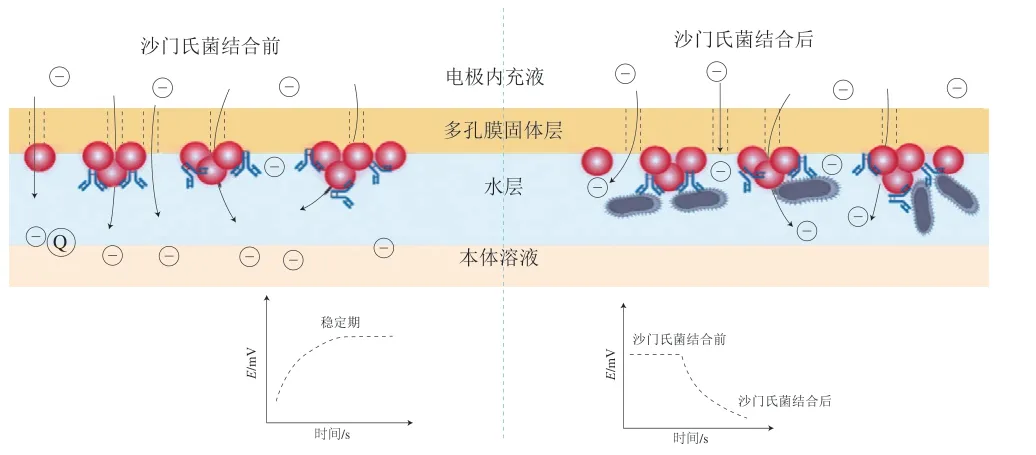
圖4 沙門氏菌電位免疫傳感器[40]Fig.4 Potential immunosensor for Salmonella detection[40]
2.2.2 阻抗型生物傳感器
阻抗型生物傳感器一般基于兩種原理,一種是細菌生長產生的代謝物可以引起電導率的變化;另一種是細菌與電極表面的相互作用引起阻抗的變化[47]。目前,阻抗型生物傳感器由于具有體積小、成本低、檢測快的特點,已廣泛應用于沙門氏菌的檢測。
Mutreja等[48]在石墨烯-氧化石墨烯修飾的絲網印刷碳電極上連接沙門氏菌外膜蛋白D抗體作為鼠傷寒沙門氏菌的檢測探針,抗體與沙門氏菌的特異性結合引起電極表面阻抗的變化,通過免疫傳感器的阻抗變化來反映沙門氏菌的濃度,該方法可特異性地檢測水和果汁中的沙門氏菌,檢測靈敏度達10 CFU/mL。此外,納米材料在阻抗生物傳感器中的應用縮短了菌體富集的時間,使檢測更加省時、靈敏度增強。Nguyen等[49]利用磁性二氧化硅納米管(magnetic silica nanotubes,MSNTs)進行沙門氏菌的富集和阻抗免疫傳感器信號的增強,鼠傷寒沙門氏菌抗體固定在交叉微電極上,鼠傷寒沙門氏菌與MSNTs上連接的抗體進行特異性結合,導致阻抗響應下降,從而實現沙門氏菌的檢測。該傳感器從細菌分離到檢測完成僅需30 min,且對103~107CFU/mL下的鼠傷寒沙門氏菌有良好的阻抗響應。除抗體外,適配體與沙門氏菌的結合也在阻抗型生物傳感器中得到了應用。Sheikhzadeh等[43]對適配體與傷寒沙門氏菌結合后影響吡咯-3-羧酸與吡咯共聚物的電學性能特性進行研究,沙門氏菌的結合引起體系中阻抗的變化,阻抗的變化量反映了樣品中沙門氏菌的含量,其線性檢測范圍為102~108CFU/mL,定量限為100 CFU/mL,檢出限為3 CFU/mL。
2.2.3 電導型生物傳感器
電導型生物傳感器以導電聚合物作為電化學轉換器,將生物信號轉化為電信號,通過電導率的變化反映細菌的濃度,從而實現對細菌的檢測。聚苯胺作為常用的導電聚合物,由于其優良的液態穩定性、良好的電子特性以及較強的生物分子相互作用,已被應用于生物傳感器。Muhammad-Tahir等[44]構建了由樣品墊、結合墊、捕獲墊和吸水墊組成的傳感器。將聚苯胺結合的抗體固定于捕獲墊上,捕獲墊兩端鍍有銀電極并與電子數據采集系統相連,以此形成電導型生物傳感器。通過抗原與捕獲墊上的抗體結合產生電導率的變化從而檢測沙門氏菌。該方法檢測限為79 CFU/mL,檢測時間縮短至10 min,實現了較高的靈敏度以及快速檢測的目的。與其他的電化學傳感器相比,其制作方法簡便,但是電導率與沙門氏菌濃度之間無線性關系,無法進行定量檢測。
3 結 語
近年來,由沙門氏菌感染引起的食源性疾病越來越多,人們對沙門氏菌檢測的關注度逐漸增強,沙門氏菌檢測方法也在不斷的更新。傳統的沙門氏菌檢測方法(如常規培養法、核酸分析法、免疫學檢測法等)具有某些局限性。而基于免疫學和核酸分析的生物傳感器檢測技術由于靈敏度高、檢測時間短、操作簡便、不需要專門的操作技術而逐漸得到發展。
納米材料的引入以及多種檢測方法的結合使生物傳感器在病原菌檢測方面得到廣泛應用。除常用的比色生物傳感器和電化學生物傳感器外,對壓電生物傳感器[50]的應用也進行了不斷的創新。Han Song等[51]采用壓電傳感器結合連續流系統,實現了對糞便樣品中艱難梭菌(Clostridium difficile)毒素B基因的直接檢測。此外,微流控系統集成的生物傳感器實現了多種病原菌的便攜式檢測[52]。An Xisen等[53]采用單細胞微流控芯片實現了鼠傷寒沙門氏菌的檢測,檢測限為50 CFU/mL,但檢測時間較長(約5 h),無法實現現場直接快速的檢測。核磁共振生物傳感器也已用于牛奶中沙門氏菌的檢測[54],實現了2.4×104CFU/mL沙門氏菌的檢測,該生物傳感器抗干擾能力強、特異性強,有利于實現沙門氏菌的現場檢測,但檢測靈敏度有待提高。以上生物傳感器的靈敏度、特異性和抗外界干擾能力得到了很大的提高,大大縮短了檢測時間,并擺脫了傳統檢測方法對大型儀器設備以及操作人員的依賴性。但是,目前所研究的傳感器無法實現多種沙門氏菌的同時檢測;生物傳感器的識別元件多為抗體,抗體制備周期長導致傳感器生產周期長;且檢測結果大多需要儀器讀取等。因此,可以將電化學的穩定性以及光學的可視化相結合,并引入納米材料進行生物信號的放大,不斷地縮短檢測時間和降低成本,實現檢測結果的可視化、檢測設備的便攜性和微型化;另外,納米抗體作為一種高特異性、高親和力的新型抗體,其分子質量小、結構簡單,能在工程菌中大量表達,在室溫下保存相當穩定,具有較高的耐熱性和穩定性,可以代替普通抗體,理論上能夠延長生物傳感器的使用時間、提高穩定性。生物傳感器在沙門氏菌的檢測方面發揮了重大作用,未來將會得到進一步的研究與推廣,甚至在所有食源性致病菌檢測中得到廣泛應用。

