Δ12/Δ15脂肪酸脫飽和酶在發酵食品中應用的研究進展
吳 琛,姜 楠,田文雪,王儒紅,欒濱羽,史海粟,武俊瑞,烏日娜,岳喜慶
(沈陽農業大學食品學院,遼寧 沈陽 110866)
Δ12/Δ15脂肪酸脫飽和酶(Δ12/Δ15 fatty acid desaturase,FADS12/15)幾乎存在于所有生命體中,具有高度保守性,其在脂肪酸需氧合成途徑中催化必需脂肪酸(essential fatty acid,EFA)的合成,調控多不飽和脂肪酸(polyunsaturated fatty acid,PUFA)的從頭合成和長鏈多不飽和脂肪酸合成、調節ω-3脂肪酸和ω-6脂肪酸比例,促進其發揮益生作用。隨著生物技術的發展,選取高催化活性的植物、動物和微生物FADS12/15基因進行過表達,提高亞油酸(linoleic acid,LA,)和α-亞麻酸(α-linolenic acid,ALA,)水平,為EFA和長鏈多不飽和脂肪酸傳統合成提供了新方法。發酵食品作為實驗中可控制的微生物生態系統,其微生物多樣性為FADS12/15基因工程菌構建提供了便利條件。在此基礎上,選用優良發酵菌株構建高產不飽和脂肪酸(unsaturated fatty acid,UFA)工程菌株,應用于食品發酵工業,將滿足消費者對功能食品的需求。
1 FADS12/15催化機理及其關鍵作用
FADS12由協調催化中心的3 個高度保守的組氨酸序列(HX3~4H、HX2~3HH、H/QX2~3HH)編碼[1],屬于膜結合脫飽和酶,在脂肪酸代謝和維持細胞膜功能中具有重要作用[2-7]。FADS12作為PUFA合成的關鍵限制酶,通過胞質結構域和跨膜螺旋1中的殘基與油酸(oleic acid,OA,親水性輔酶A基團通過靜電相互作用形成氫鍵,催化OA-LA反應[8-10]。OA是EFA合成中首個UFA,具有雙重作用[11];LA作為ω-3和ω-6途徑合成花生四烯酸(ara chidonic acid,AA,、二十碳五烯酸(eicosapentaenoic acid,EPA,、二十二碳六烯酸(docosahexaenoic acid,DHA,等的UFA底物,具有重要生理作用和工業價值[12-21],因此,FADS12的催化作用在脂質代謝和人體健康中發揮不可替代的功能。FADS12廣泛分布在幾乎所有植物和微生物中,除無脊椎動物外,在大多數動物中不存在[22-25],不同物種間催化活性各不相同[26],植物中最高催化活性為93.80%(紅花,Carthamus tinctorius)、酵母中最高為94.00%(巴斯德畢赤酵母GS115,Pichia pastorisGS115)、霉菌中最高為88.00%(高山被孢霉1S-4,Mortierella alpine1S-4)、藻類中最高為99.42%(小球藻NJ-7,Chlorella vulgarisNJ-7)。
FADS12在脂肪酸代謝中為UFA合成提供最初底物,而UFA在膜結構和功能方面起重要作用,調節參與脂質代謝的蛋白質基因轉錄,調控脂肪酸脫飽和酶和延伸酶的表達。近年來,對于微生物和植物中的FADS12研究繁多,微生物源FADS12/15基因的鑒定、功能分析、催化活性的提高等增加EFA和UFA含量的生物技術手段應用廣泛。FADS12/15在生產LA、積累特定脂肪酸、改善脂肪酸組成、提高生物膜流動性及耐受性中扮演不可或缺的角色[27-33],通過基因工程等手段促進不同物種間FADS12/15基因的高效表達,提高FADS12/15催化活性對于食品發酵行業的發展意義重大。
2 FADS12/15參與脂肪酸代謝途徑
脂肪酸脫飽和酶可分為3 類:1)酰基-酰基載體蛋白脫飽和酶;2)酰基-脂質脫飽和酶;3)酰基-輔酶A脫飽和酶。FADS12/15屬于酰基-脂質脫飽和酶,其參與脂肪酸代謝途徑如圖1所示。高等真核生物細胞膜中PUFA合成主要通過FADS12和FADS15參與的代謝途徑[35-36],在此基礎上以LA和ALA為核心底物,通過系列脂肪酸脫飽和酶、延伸酶和異構酶催化合成PUFA[37-39]。

圖1 FADS12/15參與脂肪酸代謝途徑[34]Fig.1 Fatty acid metabolism pathways in which FADS12/15 are involved[34]
FADS12催化OA轉化為LA,在OA碳鏈的第9位碳原子和甲基端碳之間,利用細胞色素b5和NADH-細胞色素b5還原酶系統提供的兩個電子和一個氧分子,完成第12位碳雙鍵的引入,產生LA。LA作為必需多不飽和脂肪酸,在FADS15和其他脂肪酸脫飽和酶代謝作用下產生ALA、γ-亞麻酸(γ-linolenic acid,GLA,、共軛亞油酸(conjugated linolenic acid,CLA,、AA、EPA、DHA等對哺乳動物具有重要功能的長鏈和超長鏈脂肪酸[40-48]。這些脂肪酸與甘油結合形成三酰基甘油,長鏈的三酰基甘油在小腸中被胰脂肪酶水解,產物2-單酰基甘油與其他脂肪酸溶解在膠束中由小腸黏膜細胞吸收,重新合成為三酰基甘油,形成乳糜微粒,通過乳腺淋巴管釋放參與循環,運輸至周圍組織,完成脂肪酸的消化吸收與代謝[49-50]。
根據距離碳鏈甲基端最近雙鍵的位置,UFA又可分為ω-3和ω-6 PUFA[51-52],對人體生長發育、認知功能和視覺功能、調節基因表達、膜磷脂活性至關重要,但兩者及其衍生物在功能上略有差異[53-56]。ω-3 PUFA與癌癥、炎性疾病、脂肪肝、自身免疫反應和心血管疾病、糖尿病、肥胖等慢性病發病率密切相關[57-65],ω-6 PUFA中的AA、雙高-GLA是重要的前體物質,AA衍生物類花生酸具有炎性[66-67],EPA、DHA則具有抗炎性作用。ω-6脂肪酸可在相應的脫飽和酶作用下轉化為ω-3脂肪酸,兩者的前體脂肪酸分別為LA和ALA,因此,催化LA和ALA形成的FADS12/15在調節UFA比例、EFA分布中具有重要作用[68]。
3 FADS12/15生物來源
歷年來,FADS12/15因其在復雜的脂肪酸代謝中的關鍵作用一直被眾多研究者關注,近10 年來,對FADS12/15的研究逐漸由代謝機理向基因水平擴展。其中以基因工程和酶工程為核心的生物技術是最重要的研究手段,鑒定FADS12/15基因、探究FADS12/15功能性、提高不同生物中FADS12/15基因表達水平已成為研究熱點。通過對植物、動物和微生物來源的FADS12/15基因進行修飾表達來提高該酶活性的研究趨勢日益發展[69-71],許多基因工程油料作物、動物和海洋微生物已通過成功表達FADS12/15基因,顯著提高LA、ALA、GLA、CLA等脂肪酸在不同物種中的積累。Wang Yanan等[33]發現在產油紅東酵母菌(Rhodosporidium toruloides)中過表達高山被孢霉(M.alpina)和鐮刀菌(Fusarium verticillioides)FADS12基因后,LA含量增加為原來的5 倍;Zhang Yao等[72]通過使FADS6和FADS12基因在卷枝毛霉(Mucor circinelloides)中同源過表達將GLA含量提高至總脂肪酸的43%,高出對照菌株38%;Lamers等[30]通過在許旺酵母(Schwanniomyces occidentalis)中同源和異源過表達FADS12基因,使LA含量提高至0.08 g/g生物量。
目前,不同物種中FADS12/15的鑒定體系已較為成熟,其脂肪酸代謝功能研究步驟完整,FADS12/15與人體健康之間的聯系[73-76]、自身催化作用的底物選擇性研究趨勢不斷擴大,應用基因工程等現代生物技術提升不同物種FADS12/15活性水平,促進發酵食品原料和發酵菌種應用效益,對未來發酵食品發展意義重大。
3.1 植物來源FADS12/15
植物中FADS12/15以微粒體脂肪酸脫飽和酶形式存在,根部FADS12/15含量受環境因素影響而呈顯著波動變化[77],莖和葉中FADS12/15位于葉綠體,含量微少。植物種子和果實是油脂的主要來源,FADS12/15含量豐富[78]。眾多植物中,油料作物是迄今為止最重要植物基油脂來源,但不同油料作物中FADS12活性差異明顯,脂肪酸的組成和含量差異巨大。大麻(Cannabis sativa)中FADS12催化活性最高,為72.00%,而同為油料作物的花生和油棕僅為29.41%和27.56%(表1)。過去20 年內,研究者進行了大量工作破譯編碼脂肪酸生物合成中重要的酶基因,且進展顯著[79-82]。近幾年,植物生物技術的發展為FADS12/15研究帶來新契機,基因工程和分子遺傳學在提高植物脂肪酸含量中的應用促使對植物FADS12/15的研究上升至嶄新的高度[83],尤其是根癌農桿菌(Agrobacterium tumefaciens)的高基因整合率、表達水平穩定的特點有利于FADS12/15基因表達,極大地促進了植物中FADS12/15代謝機理研究。
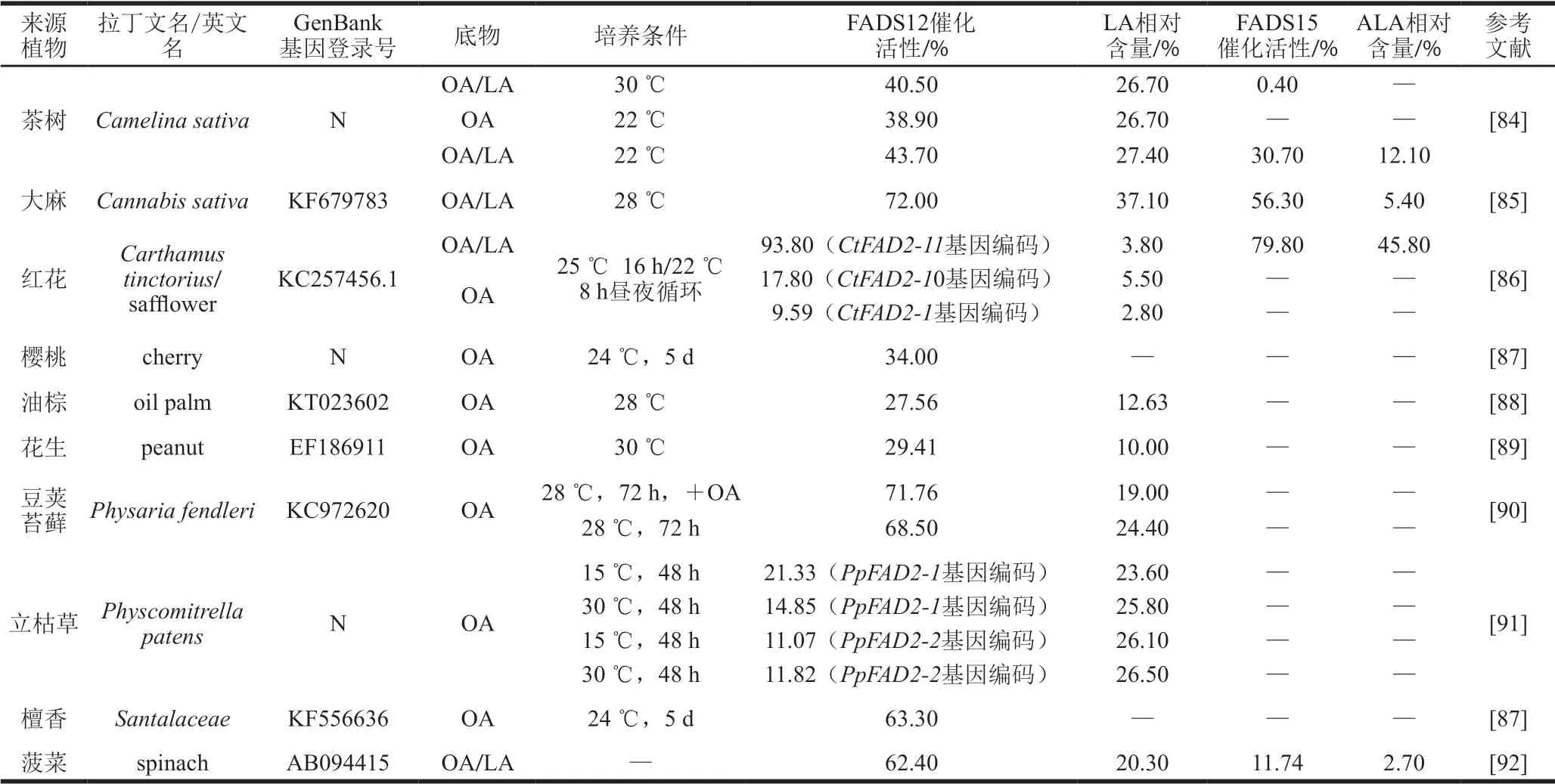
表1 植物來源FADS12/15催化活性Table 1 Catalytic activity of plant-derived FADS12/15
3.2 動物來源FADS12/15
哺乳動物自身不能合成OA和LA,FADS12/15來源微少。如表2所示,線蟲FADS12催化活性在6.25%~88.43%之間,秀麗隱桿線蟲和異線蟲具有FADS15催化活性,無脊椎動物秀麗隱桿線蟲(Caenorhabditis elegans)是最具代表性的FADS12/15來源動物[93-96]。C.elegans以細菌為食,擁有合成二十碳四烯酸和EPA所需的全部酶類[97]。不同于傳統哺乳動物和陸地動物,C.elegans可以利用FADS12將OA轉化為LA,通過FAT-1ω-3脫飽和酶催化ω-6脂肪酸轉化為ω-3脂肪酸,提高ω-3/ω-6 PUFA比例[98-101],其作為FADS12來源的潛在動物[102],喂食高產飽和或單不飽和脂肪酸細菌,定向、高效合成LA、AA和EPA具有廣闊前景。金小蜂、煙夜蛾、灰斑古毒蛾、白薯天蛾和臭椿皮蛾等昆蟲中FADS12/15含量豐富[103],但不能被有效利用,而蠶蛹中高活性FADS12/15可使其ALA相對含量達到72.80%,成為補充EFA的優質動物來源。FADS12/15在三文魚、硬骨魚[104]、羅非魚[105]、鮭魚[106]、鯰魚[107]等海洋魚類中調控脂肪酸代謝途徑,這些魚類ω-3/ω-6 PUFA含量豐富,是膳食獲取FADS12/15和PUFA的重要海洋資源。
3.3 微生物來源FADS12/15
3.3.1 FADS12/15細菌來源
細菌中存在FA D S 1 2 的菌種有金黃色葡萄球菌ATCC 34304(Thraustochytrium aureumATCC 34304),催化活性為35.80%[109]。雙歧桿菌(Bifidobaacterium lactobacillus)、丙酸桿菌(Propionate bacillus)、乳桿菌(Lactobcaillus)、乳球菌(Lactococcus)等益生菌中多為共軛脂肪酸異構酶研究[110],細菌來源的FADS12/15研究報道較少,在最常用的活性功能鑒定宿主細菌大腸桿菌(Eschrichia coli)中也鮮見FADS12/15相關報道。大腸桿菌TOP 10(E.coliTOP 10)和大腸桿菌DH5α(E.coliDH5α)是應用廣泛的表達宿主菌株,將FADS12/15基因克隆連接到pGEM-T[111]、pUC57[112]、pMD18-T[113]、pMLD30[114]等載體中,導入感受態大腸桿菌TOP 10(E.coliTOP 10)或大腸桿菌DH5α(E.coliDH5α)中是確定FADS12/15特性及功能性的首要研究步驟。目前,眾多學者使用大腸桿菌TOP 10(E.coliTOP 10)或大腸桿菌DH5α(E.coliDH5α)作為模式菌株,鑒定目標基因為具有編碼FADS12/15活性功能的酶基因,通過構建FADS12/15-載體表達系統提高催化活性或改變產油脂菌株原有脂肪酸組成,積累不飽和脂肪酸以增加菌株的應用價值已成為常規研究思路。
3.3.2 FADS12/15酵母菌來源
在酵母中,FADS12/15主要來自巴斯德畢赤酵母(P.pastoris)、解脂耶氏酵母(Yarrowia lipolytica)、斯氏油脂酵母(Lipomyces starkeyi)、林油脂酵母(Lipomyces kononenkoae)、近平滑假絲酵母(Candida parapsilosis)、多形漢遜酵母(Hansenula polymorpha)和解脂假絲酵母(Candida lipolytica),菌株間催化活性相差較大(表3)。一些常見工業化酵母一般只含有一種脂肪酸脫飽和酶或極少含有脂肪酸脫飽和酶。與細菌FADS12相似,釀酒酵母(Saccharomyces cerevisiae)中只含有一種OLE1基因編碼的位于內質網膜上的FADS9,在正常生長條件下,不能產生LA和亞麻酸(ALA和GLA)[115],因此不含有FADS12。在解脂耶氏酵母(Y.lipolytica)、斯氏油脂酵母(L.starkeyi)和巴斯德畢赤酵母(P.pastoris)中,FADS12催化活性分別為82.49%、80.31%和46.40%,C.lipolytica中僅為11.00%。巴斯德畢赤酵母GS115(P.pastorisGS115)自身存在的FADS12/15與其他真菌FADS12具有高度一致性,并與克魯維酵母(Saccharomyces kluyveri)FADS15具有57%的一致性,具有雙重脫飽和酶活性,這解釋了其催化活性高達94.00%。

表2 線蟲FADA12/15催化活性Table 2 Catalytic activity of nematode-derived FADA12/15
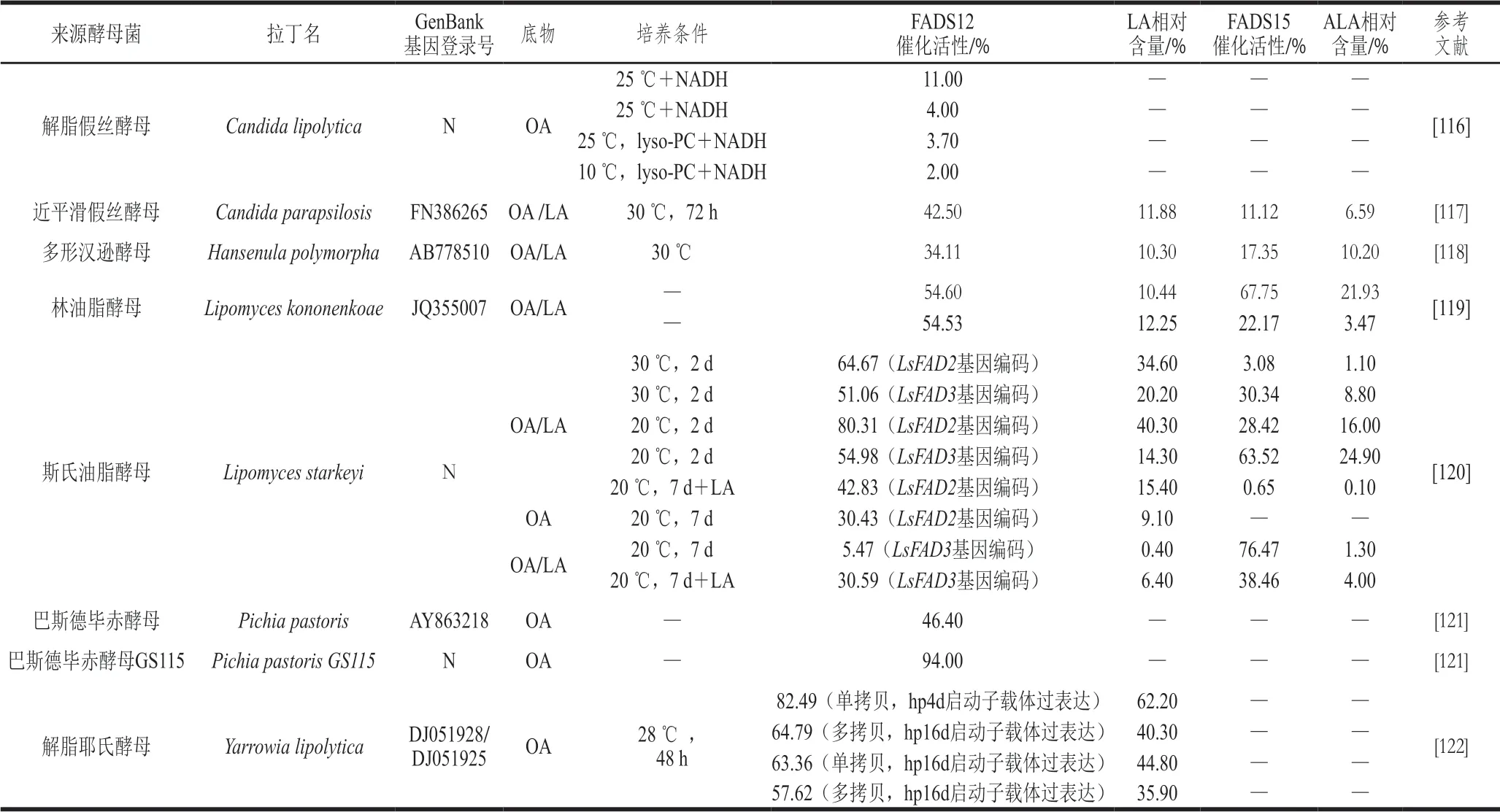
表3 酵母菌來源FADS12/15催化活性Table 3 Catalytic activity of yeast-derived FADS12/15
3.3.3 FADS12/15霉菌來源
微生物中霉菌為FADS12/15的重要來源,絲狀產油真菌高山被孢霉屬合成大量PUFA和C18脂肪酸,作為主要研究霉菌,M.alpine中的脂肪酸脫飽和酶研究廣泛,其FADS12是第一個克隆非植物來源FADS12基因的實例[123]。如表4所示,霉菌來源FADS12/15在毛霉屬中分布比例較大,高山被孢霉屬為主要來源。Shi Haisu等[124]總結了高山被孢霉屬生產PUFA的關鍵優勢,并證明高山被孢霉ATCC 32222(M.alpineATCC 32222)Δ6脂肪酸脫飽和酶具有ALA底物偏好性,為M.alpineFADS12/15在PUFA研究提供重要方向。不同種屬FADS12催化活性在17.60%~88.70%之間,在不同溫度條件下催化活性存在差異,其中M.alpine1S-4的FADS12催化活性最高,為88.70%。M.alpine1S-4長期以來被應用于工業生產AA[125],近年來,眾多研究者通過同源或異源表達M.alpine1S-4的FADS12/15基因,改造受體菌株脂肪酸組成,人為定向生產PUFA,成功擴展了FADS12/15在EFA生產中的應用。
3.3.4 FADS12/15藻類來源
FA D S 1 2/1 5 在小球藻(C.v u l g a r i s)、藍藻(C y a n o b a c t e r i a)、綠藻(G re e n a l g a)、萊茵衣藻(Ch ala mydomonas reinhardtii)、微擬球藻(N a n n o c h l o ro p s i s o c e a n i c a)、羅德衣藻(Chlamydomonas raudensis)和等鞭金藻(Isochrysis g a l b a n a)中存在。如表5 所示,除等鞭金藻(I.galbana)外,其他藻類FADS12催化活性均在58.00%以上,C.vulgarisNJ-7高達99.42%。藻類是FADS12/15和ω-3脂肪酸的潛在海洋資源來源[134],其脂肪酸組成受培養模式[135]、營養壓力[136]和環境因素[137]顯著影響,氮源是影響藻類FADS12/15基因轉錄水平的有效因素[138-139],通過氮饑餓或氮剝奪促進FADS12/15基因表達,對擴大藻類FADS12/15來源意義重大[140-144]。大部分藻類FADS12/15代謝產物LA或ALA相對含量低于10%,不同溫度、鹽分、光照和生長階段都會對FADS12/15參與的脂肪酸代謝產生顯著影響,合理調節藻類生長條件提高FADS12/15活性,有利于推動FADS12/15在海洋資源中的應用。
4 FADS12/15在發酵食品中應用
4.1 發酵乳制品
4.1.1 酸奶
酸奶制作的主要動物乳源是牛乳,其次是羊乳和驢乳,牛乳中自然含有FADS12/15,但在常規條件下活性有限,LA和ALA含量微少。長期食用酸奶可提高人體ω-6脂肪酸水平[151],但羊乳中FADS12/15代謝活性較低,缺少對人體健康有益的長鏈脂肪酸因子,使其發酵制品消費受到限制,膳食補充彌補FADS12/15活性不足以增加PUFA攝入量是重要的替代方法[152]。酸奶在發酵過程中pH值影響FADS12/15分子催化活性區解離狀態和底物解離狀態,致使短鏈和中鏈脂肪酸含量逐漸增加而PUFA含量缺乏[153],選用高活性FADS12/15基因工程益生菌增補脂肪酸含量在酸奶中的應用將發揮重要作用。此外,補充油性飼料和調控粗、精飼料比例促進原料乳FADS12/15基因表達[154-156],添加耐酸性FADS12/15益生菌株發酵劑提高FADS12/15活性,補加OA、LA等底物脂肪酸[157]和植物油脂[158],豐富EFA種類和含量等方法為FADS12/15在酸奶中應用提供有效手段[159-161]。
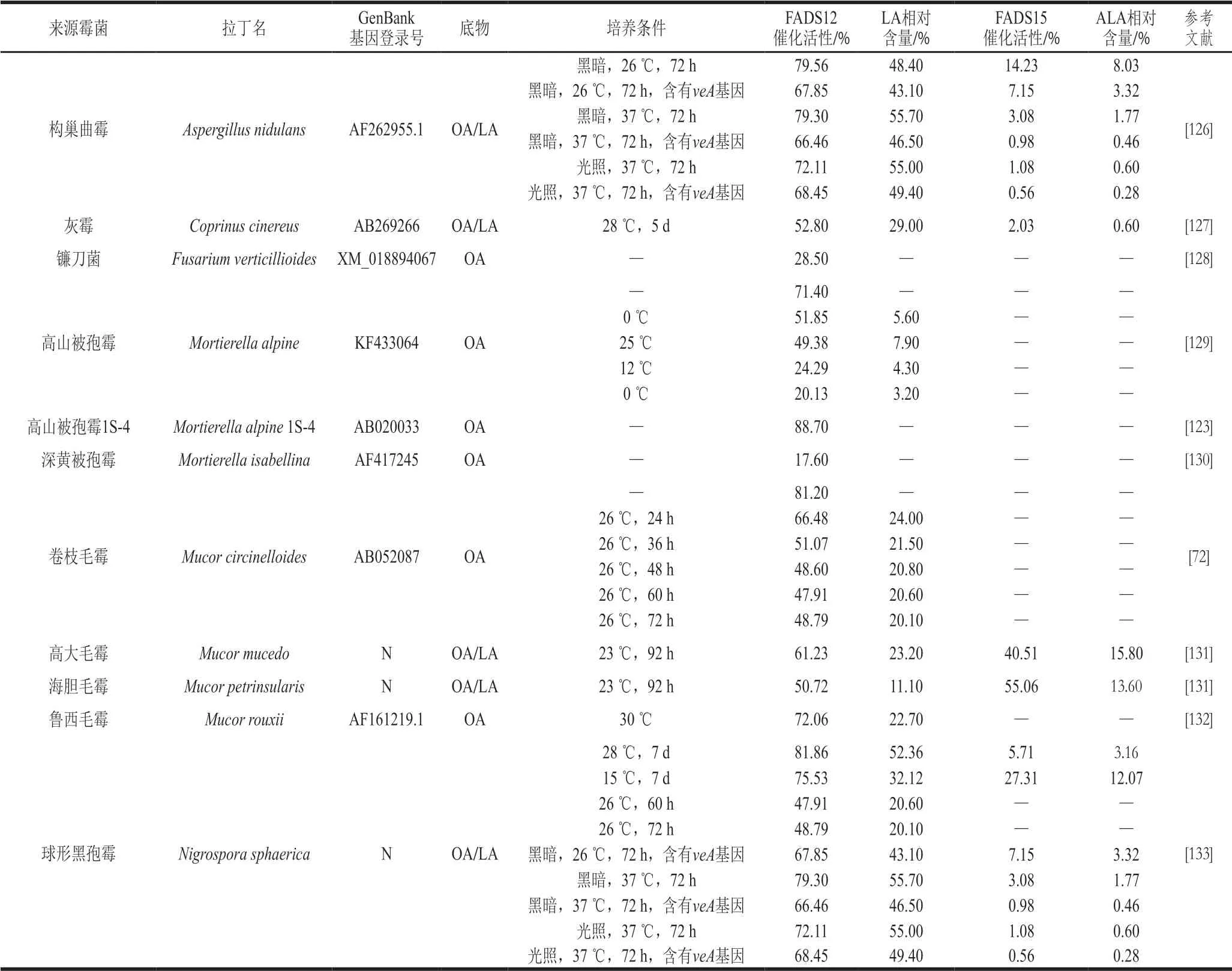
表4 霉菌來源FADS12/15催化活性Table 4 Catalytic activity of mold-derived FADS12/15
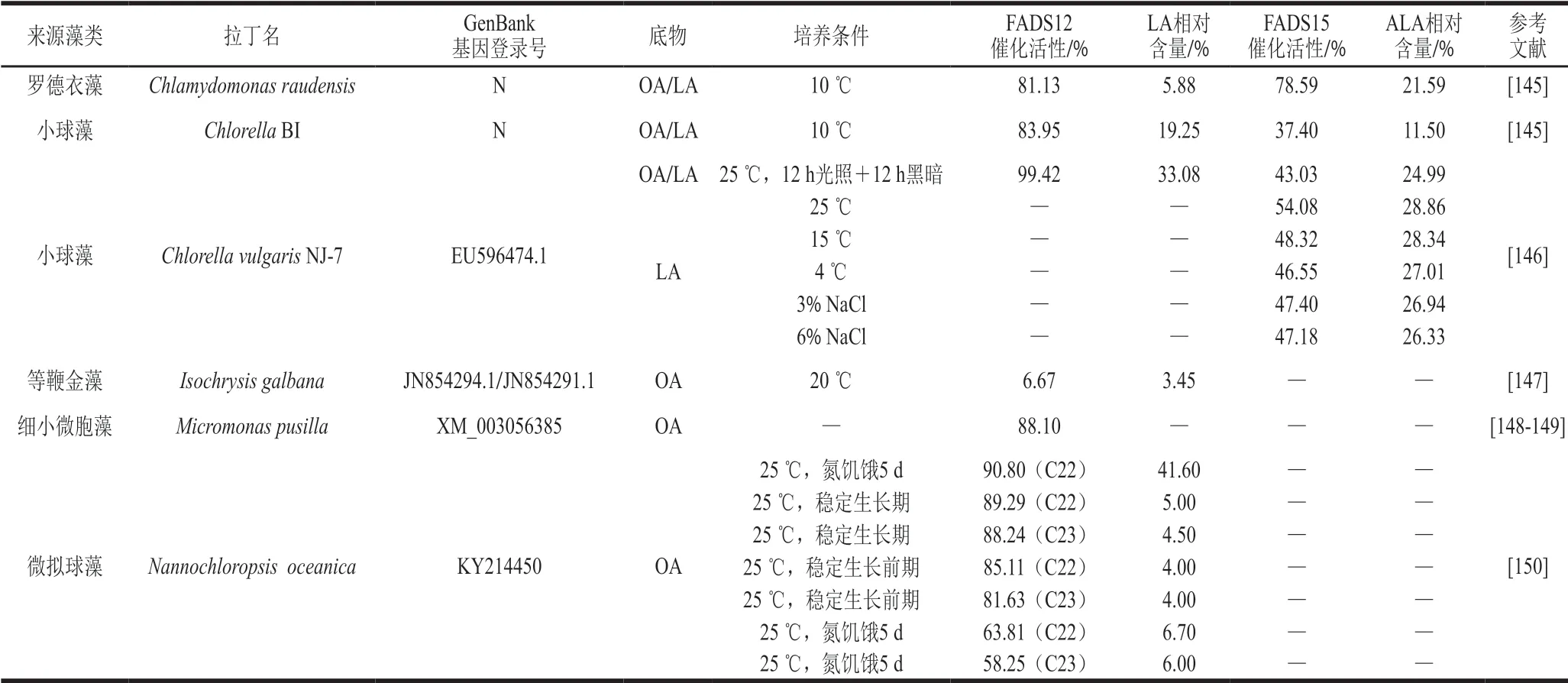
表5 藻類來源FADS12/15催化活性Table 5 Catalytic activity of algae-derived FADS12/15
4.1.2 干酪
干酪制作主要選用羊乳(山羊乳、綿羊乳)、牛乳(水牛乳、牦牛乳、奶牛乳)或混合乳[161]。原料乳中的脂肪是影響干酪風味、質構、色澤和穩定性的重要成分[162]。脂肪中的PUFA是干酪發揮益生作用的健康因子,飲食調整提升FADS12/15催化活性、豐富PUFA含量是有效策略[163-169]。Petkov[170]和Borkova[171]等給母羊喂食富含ω-3/ω-6 PUFA藻類,調節FADS12催化活性,增補羊乳中長鏈脂肪酸;Vargas-Bello-Perez等[172]通過給予奶牛橄欖油補充飲食,促進了FADS15基因表達,增加了干酪中ALA含量。近年來,干酪中有益脂肪酸含量提升的可行性已成為關注重點,FADS12/15研究對于增加CLA、ω-3/ω-6 PUFA含量,滿足消費者的健康需求意義重大[173-175]。但食用干酪后脂肪酸是否能夠突破人體消化屏障,如何參與體內脂肪酸代謝等問題證據尚不充足,FADS12/15在干酪中研究意義深遠。
在泌乳初期得到的富含OA的原料乳中添加高產FADS12/15發酵菌株,富集LA和ALA,對提升干酪品質和營養價值至關重要[176-177]。在此基礎上,結合基因工程技術,Sakuradani等[123]構建米曲霉宿主-載體系統表達FADS12基因,修飾米曲霉中脂肪酸組成,拓展了FADS12/15在干酪中的應用。此外,Luo Xue等[68]成功鑒定出白霉干酪中白地霉FADS12基因具有雙功能特性,可分別催化OA、LA產生LA和ALA;Mano等[178]引入ω-3脂肪酸脫飽和酶基因進行工程設計獲得解脂耶氏酵母(Y.lipolytica)基因工程菌株,將干酪乳清ALA含量提高至10.5 mg/g(以細胞干質量計),增加了基因工程技術在干酪中的綜合利用效益。除上述FADS12研究外,其他干酪霉菌FADS12研究報道較少,FADS12在干酪中應用仍處于起始階段。常用發酵劑菌種FADS12/15功能性鑒定和其活性提高將極大促進干酪營養價值和市場份額,擴展FADS12/15在發酵乳制品中應用。
4.2 發酵果蔬制品
4.2.1 泡菜
泡菜以卷心菜、蘿卜、黃瓜等原料輔以各種調味料制作而成,是傳統的乳酸菌發酵食品[179],富含維生素、礦物質、益生菌和有機酸[180],營養價值極高[181]。泡菜中乳桿菌屬(Lactobacillus)、隱球菌屬(Cryptococus)、小球菌屬(Micrococus)和腸球菌屬(Enterococci)含量豐富[182-184],為原料發酵提供了豐富的酶系,FADS12/15的存在為泡菜風味和特有品質的形成作出重要貢獻[185]。果蔬中內源性FADS12/15基因表達量受眾多因素調控[186-188],對其進行基因修飾極為困難,眾多研究者將目光轉向發酵菌種FADS12/15產量的提高。利用生物學技術擴大發酵微生物的FADS12/15基因表達量和催化活性機理的相關研究已陸續開展,梅甜甜等[189]利用具有FADS12/15活性序列載體轉化S.cerevisiae成功提高催化活性,提升LA轉化率至2.9%;張天緣[190]篩選S.cerevisiae作為表達宿主,通過構建紫蘇FADS15基因原核表達載體,使ALA含量增加至0.91%。結合不同物種FADS12/15基因異源表達研究成果,借鑒已有成熟基因工程技術提升泡菜發酵菌株FADS12/15活性有望成為未來泡菜制作新趨勢。
4.2.2 酸菜
酸菜主要以卷心菜或白菜為原料,經過乳酸菌發酵利用乳糖轉化為乳酸,賦予酸菜獨特的口感和風味。酸菜中優勢菌門為厚壁菌門(Firmicutes)、變性菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)和放線菌門(Actinobacteria)[191-192],優勢細菌和真菌屬為乳酸菌、乳酸桿菌屬(Lactobacillus)、明串珠菌屬(Leuconostoc)、假單胞菌(Pseudomonas)和德巴利酵母屬(Debaryomyces)[193-196],優勢菌種為德氏乳桿菌(Lactobacillus delbrueckii)、植物乳桿菌(Lactobacillus plantarum)、鳥桿菌(Lactobacillus aviarius)、庫氏畢赤酵母(Pichia kudriavzevii)和漢遜德巴利酵母(Debaryomyces hansenii)[197-199]。酸菜中豐富的細菌多樣性為FADS12/15基因操作提供菌株來源,其含有的優勢真菌為FADS12/15研究提供了高效可操作媒介,外源酶基因真菌表達系統相對細菌而言,具有翻譯加工后修飾所需要的酶,在相關調控機制下更易形成有生物活性的酶構象,選用酸菜中優勢真菌作為FADS12/15基因表達受體細胞,獲得高生物活性FADS12/15,構建基因工程菌應用于酸菜發酵過程,對于蔬菜原料附加產值和營養功效的提高具有重要意義。
4.3 發酵豆制品
4.3.1 腐乳
腐乳是利用微生物法改變植物蛋白風味和營養的傳統發酵食品,根據風味色澤可分為紅腐乳、白腐乳、青腐乳。參與腐乳發酵微生物主要為毛霉菌屬(Mucor)、根霉菌屬(Rhizopus)、酵母菌和細菌屬,曲霉菌屬(Aspergilus)是重要微生物種屬[200]。解春芝等[201]測定不同種類腐乳中主要脂肪酸為OA和LA,為FADS12/15活性研究提供了基礎;程浩等[202]從毛霉腐乳中篩選分離單一發酵菌種進行脂肪酸組成分析,結合發酵條件優化促進FADS12/15分泌以增加生產用菌經濟效益。FADS12/15研究應用于提升大豆種子油脂UFA含量,以富含UFA大豆為原料發酵生產腐乳,降低飽和脂肪酸對人體健康不利影響,這能有效調整傳統腐乳益生功效,促進傳統發酵食品行業發展[203]。近幾年來,曲霉菌屬(Aspergilus)中FADS12/15研究日趨廣泛,其中米曲霉被認為是表達真核生物蛋白質最突出的宿主之一[204],其外源表達系統越來越受到重視,結合基因工程技術優化表達系統,擴展米曲霉FADS12/15研究意義深遠[205]。
4.3.2 豆醬
豆醬是傳統的發酵豆制食品,主要發酵菌屬為乳酸桿菌屬(Lactobacillus)、芽孢桿菌屬(Bacillus)、葡萄球菌屬(Staphylococcus)、四聯球菌屬(Tetragenococcus)、德巴利酵母菌屬(Debaryomyces)、曲霉菌屬(Aspergillus)、毛霉菌屬(Mucor)和青霉菌屬(Penicillium)[206-209]。在發酵過程中其微生物演替極為復雜,這為微生物FADS12/15研究帶來困難,因此,豆醬中微生物FADS12/15研究報道尚少,但Pham[210]、Belie[211]和Tian Baoming[212]等通過植物生物技術將FADS12/15基因導入大豆植株幼苗,利用生長環境激發FADS12/15代謝通路,成功提高了大豆中FADS12/15含量。Bilyeu等[213]證明了大豆中含有的3 種ω-3脂肪酶基因能夠提高亞麻酸水平,為提升大豆中FADS12/15活性研究奠定了基礎,在此基礎上優化加工工藝進一步促進大豆內源性FADS12/15基因表達,催化自身油脂代謝,富集UFA,將成為提高豆醬營養價值和益生作用的研究方向[214]。
4.4 發酵酒類
發酵酒類(白酒、啤酒、葡萄酒、果酒、黃酒、奶酒)主要微生物為霉菌屬、酵母屬、細菌屬和放線菌屬,豐富的微生物多樣性為復雜的發酵代謝產物研究提供可能,脂質代謝產物對酒類風味影響明顯,發酵酒中的脂肪酸主要是乙酸、丙酸、丁酸、己酸等短鏈脂肪酸,也有加入LA、ALA、GLA作為功能因子彌補FADS12/15不足的代謝缺陷,提高酒的健康功效。FADS12/15在酒中的研究還未能引起研究者足夠的關注,但隨著人們對健康功能飲品的追求,FADS12/15功能作用探索可作為未來的研究方向。以微生物作為媒介,通過生物技術手段改良發酵菌種FADS12/15活性,有望替代外源脂肪酸添加發揮益生作用。Kajiwara等[215]將擬南芥FADS12基因在S.cerevisiaeIFO 10150和INVSc1中表達,提高了S.cerevisiae的乙醇耐性,為發酵菌株FADS12活性研究提供了基礎,常用發酵菌種H.polymorpha和C.lipolyticaFADS12/15催化活性已獲得驗證,進一步在高乙醇含量環境下調控FADS12/15生物活性,將為功能性白酒發展帶來新希望。
5 結 語
FADS12/15來源廣泛,種屬間催化活性差異明顯,是生理功能性PUFA生產的關鍵酶源。FADS12/15活性影響生物體內脂肪酸組成,但哺乳動物自身不能合成EFA,通過發酵食品攝入脂肪酸對人類健康影響意義重大。因此,FADS12/15在食品發酵工業中的應用越來越受到重視,利用FADS12/15生產LA,通過過表達提高微生物EFA、AA、EPA、DHA等功能性脂肪酸的積累,從而提升發酵食品營養功能的應用前景廣闊;針對微生物自身分泌油脂特性,選取高活性FADS12/15基因,構建基因工程菌株應用于傳統發酵食品,優化發酵工藝高效積累脂肪酸,提高產品功能性的發展潛力巨大;除傳統發酵食品外,FADS12/15在干酪中的應用將進一步滿足消費者對高端功能性食品需求,成為最具潛力的發酵應用。此外,深入研究發酵食品中優勢微生物FADS12/15特性,提高產品UFA種類,增加產品益生作用符合現代食品發展的新趨勢。

