納米魚骨對鰱魚肌球蛋白凝膠性能的影響
時浩楠,張夢玲,張 晉,尹 濤,胡 楊,尤 娟,熊善柏,劉 茹
(華中農(nóng)業(yè)大學(xué)食品科學(xué)技術(shù)學(xué)院,國家大宗淡水魚加工技術(shù)研發(fā)分中心(武漢),湖北 武漢 430070)
魚骨是魚片和魚糜等水產(chǎn)品加工過程中產(chǎn)生的主要固體副產(chǎn)物之一,每100 g魚中含有10~15 g魚骨[1-2]。魚骨中鈣含量豐富,營養(yǎng)價值和生物利用率高[3],是優(yōu)質(zhì)的天然鈣源。但目前魚骨主要被用于生產(chǎn)魚骨粉、低價飼料等[4],或直接作為下腳料丟棄[5],并未得到充分利用。魚糜凝膠制品因其食用方便、美味可口而深受消費(fèi)者歡迎[6]。肌球蛋白是魚糜形成凝膠最重要的功能性蛋白,加熱可使肌球蛋白變性,暴露的活性基團(tuán)間相互作用形成凝膠網(wǎng)絡(luò)結(jié)構(gòu)[7-8]。有研究表明,將魚骨尺寸降低至微米級能顯著提高魚骨的生物利用率、釋放率和溶解度等[9-10],釋放出的鈣離子還能激活魚內(nèi)源性轉(zhuǎn)谷氨酰胺酶,進(jìn)而促進(jìn)肌球蛋白間的共價交聯(lián),提高魚糜的凝膠強(qiáng)度[11-12]。納米魚骨(nano-scaled fish bone,NFB)對內(nèi)源性轉(zhuǎn)谷氨酰胺酶激活能力低于CaCl2,但對魚糜凝膠性能的增強(qiáng)效果卻優(yōu)于CaCl2[2],說明加入NFB能夠增強(qiáng)凝膠性能不僅與Ca2+有關(guān),還可能與NFB的魚骨尺寸有關(guān)。NFB安全無毒且生物利用率顯著高于微米魚骨(micro-scaled fish bone,MFB)[13-14],因此,比較研究MFB和NFB對肌球蛋白凝膠特性的影響對魚骨的高值化利用具有重要意義。
本實(shí)驗(yàn)以鰱魚骨為原料制成NFB、MFB,并以CaCl2為對照,比較研究不同鈣源作用下肌球蛋白的靜態(tài)流變學(xué)性能、動態(tài)流變學(xué)性能,并結(jié)合肌球蛋白在加熱過程中蛋白質(zhì)構(gòu)象變化及分子間相互作用,探討不同鈣源對肌球蛋白凝膠特性的影響,為將魚骨應(yīng)用于魚糜制品生產(chǎn)提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
鰱魚(每條體質(zhì)量1 000~1 500 g)購自華中農(nóng)業(yè)大學(xué)菜市場。使用采肉機(jī)分離出魚骨,經(jīng)一次冰水漂洗后,于-18 ℃保存,提取肌球蛋白的原料為當(dāng)天購買的新鮮鰱魚肉。
牛血清白蛋白、三羧甲基氨基甲烷(Tris)(均為分析純) 美國Sigma Aldrich公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)(分析純)阿拉丁試劑(上海)有限公司;其余試劑均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
1750型紫外-可見光分光光度計、RF-5301型熒光光譜儀 日本島津公司;Avanti J-26 XP高速冷凍離心機(jī)美國Beckman Coulter公司;AR2000ex型動態(tài)流變儀美國TA公司;MKCA6-2骨泥機(jī) 日本Masuko公司。
1.3 方法
1.3.1 肌球蛋白提取及蛋白質(zhì)質(zhì)量濃度測定
參考Park等[15]的方法并稍作修改,僵直前的鰱魚脊背肉用食品調(diào)理機(jī)絞碎,加入10 倍體積含0.1 mol/L KCl、質(zhì)量分?jǐn)?shù)0.02% NaN3和20 mmol/L Tris-HCl的緩沖液(pH 7.5),均質(zhì)1~2 min。均質(zhì)液于4 ℃下放置15 min后8 000 r/min離心5 min,去除上清液,將沉淀懸浮于5 倍體積含0.45 mol/L KCl-20 mmol/L Tris-HCl緩沖液(pH 6.8,含5 mmol/Lβ-巰基乙醇、0.2 mol/L Mg2CO3、1 mmol/L乙二醇雙(2-氨基乙基醚)四乙酸)中,同時加入ATP-Na2使肌球蛋白與肌動蛋白解離,ATP-Na2的終濃度控制為5 mmol/L。于4 ℃下放置1 h后,10 000 r/min離心10 min,用10 倍體積1 mmol/L KHCO3稀釋上清液,于4 ℃下放置15 min,然后12 000 r/min離心10 min。沉淀重新用2.5 倍體積含0.5 mol/L KCl和5 mmol/Lβ-巰基乙醇的20 mmol/L Tris-HCl緩沖液(pH 7.5)懸浮,于4 ℃下放置15 min,再用2.5 倍體積的1 mmol/L KHCO3稀釋并加MgCl2至終濃度為10 mmol/L,于4 ℃下放置過夜,然后12 000 r/min離心15 min,所得沉淀溶于0.5 mol/L NaCl-20 mmol/L Tris-HCl緩沖液(pH 7.5)中,即得到肌球蛋白溶液。采用Lowry法[16]測定蛋白質(zhì)質(zhì)量濃度。
1.3.2 MFB和NFB的制備
參考Yin Tao等[17]的方法,將魚骨蒸煮、漂洗、破碎后,加入1 倍質(zhì)量的冰水。微粒化處理制備MFB,處理?xiàng)l件:磨盤轉(zhuǎn)速3 000 r/min、磨盤間隙0.3 mm,研磨2 次。進(jìn)一步將MFB加水調(diào)整至總固形物質(zhì)量分?jǐn)?shù)為5%。納米化處理制備NFB,處理?xiàng)l件:磨盤轉(zhuǎn)速3 000 r/min、磨球填充率85%、磨球直徑0.5 mm、球磨時間6 h。所得MFB和NFB樣品的總鈣含量采用火焰原子吸收光譜法[18]測定。
1.3.3 樣品處理
根據(jù)不同指標(biāo)測定時對肌球蛋白溶液質(zhì)量濃度的要求,使用0.5 mol/L NaCl-20 mmol/L Tris-HCl緩沖液(pH 7.5)調(diào)整蛋白溶液質(zhì)量濃度,分別加入MFB、NFB和CaCl2,將樣品中總鈣濃度調(diào)至40 mmol/L(空白組不添加鈣離子),該樣品可直接用于流變學(xué)性能測試。用于其他指標(biāo)測試的肌球蛋白溶液還需進(jìn)行如下處理:1)未加熱處理:樣品不進(jìn)行加熱;2)S處理:40 ℃下加熱60 min;3)S+K處理:40 ℃下加熱60 min后90 ℃下加熱30 min。加熱后樣品立即用流水使其冷卻至室溫,于4 ℃冰箱保存,并在30 min內(nèi)測定相關(guān)指標(biāo)。
1.3.4 靜態(tài)流變學(xué)性能測定
采用SPSS 23.0統(tǒng)計學(xué)軟件對數(shù)據(jù)進(jìn)行處理,計數(shù)資料以百分?jǐn)?shù)(%)表示,采用x2檢驗(yàn),以P<0.05為差異有統(tǒng)計學(xué)意義。
采用AR2000ex型動態(tài)流變儀在flow模式下掃描,測定條件:蛋白質(zhì)量濃度10.0 mg/mL、溫度4 ℃、錐板直徑為40 mm(錐板與平臺角度2°)、載物臺與平板間距52 μm、數(shù)據(jù)獲取模式Continuous step,以剪切速率為變量(變量范圍0.1~1 000 s-1)、變量掃描模式為線性(linear)、采集變量點(diǎn)數(shù)為33,即可得到剪切應(yīng)力隨剪切速率變化曲線。采用Cross模型擬合其零剪切黏度,按公式(1)計算。

式中:η0為零剪切黏度/Pa;η∞為無窮剪切黏度/Pa;ηa為表觀黏度/Pa;k為黏度系數(shù);n為流動特性指數(shù);γ為剪切速率/s-1。
1.3.5 動態(tài)流變學(xué)性能測定
參考Ding Yuqin等[19]的方法并稍作修改,采用AR2000ex型動態(tài)流變儀在振蕩模式下和線性黏彈區(qū)的范圍內(nèi)進(jìn)行溫度掃描,測定條件:蛋白質(zhì)量濃度10.0 mg/mL、溫度4 ℃、夾板直徑40 mm、載物臺與平板間距1 mm。加熱程序分升溫階段(1 ℃/min從4 ℃升溫到90 ℃)和降溫階段(10 ℃/min 從90 ℃降溫到4 ℃)。其中,測試過程保持剪切應(yīng)力為1.0 Pa,升溫、降溫階段振蕩頻率為0.01 Hz,對樣品儲能模量G’、損耗模量G”和相位角δ的變化進(jìn)行測定。
1.3.6 表面疏水性的測定
參考Benjakul等[20]的方法,使用50 mmol/L磷酸鹽緩沖液(pH 7.0)將肌球蛋白溶液質(zhì)量濃度分別調(diào)整為0.125、0.25、0.5、1.0 mg/mL,按照1.3.3節(jié)對樣品進(jìn)行處理,使用ANS熒光探針劑測定表面疏水性。使用RF-5301型熒光光譜儀在激發(fā)波長374 nm(狹縫3 nm)和發(fā)射波長485 nm(狹縫3 nm)下測定熒光強(qiáng)度。通過一元線性回歸分析,以熒光強(qiáng)度-蛋白質(zhì)量濃度曲線的初始斜率表征表面疏水性。
1.3.7 活性巰基濃度的測定
參考Ellman法[21]測定活性巰基濃度,將肌球蛋白的質(zhì)量濃度調(diào)整至1.0 mg/mL,按照1.3.3節(jié)處理樣品。將5.5 mL的肌球蛋白溶液與100 μL Ellman試劑混勻,4 ℃下放置1 h,測其在412 nm波長處的吸光度。活性巰基濃度按公式(2)計算。

1.3.8 溶解度的測定
參考Riebroy等[22]的方法,將肌球蛋白質(zhì)量濃度調(diào)整至1.0 mg/mL,按照1.3.3節(jié)處理樣品。取5 mL樣品在4 ℃下8 000×g離心10 min得上清液,使用Lowry法[11]測離心前后蛋白質(zhì)量濃度。溶解度為離心后蛋白質(zhì)量濃度與離心前蛋白質(zhì)量濃度的比例。
1.4 數(shù)據(jù)分析及處理
實(shí)驗(yàn)重復(fù)3 次,每次做3 個平行,采用Excel軟件進(jìn)行數(shù)據(jù)統(tǒng)計,結(jié)果以平均值±標(biāo)準(zhǔn)偏差表示;應(yīng)用Origin 2018軟件作圖;采用SAS 8.0統(tǒng)計軟件中Duncan’s法進(jìn)行顯著性分析,顯著水平設(shè)為P<0.05。
2 結(jié)果與分析
2.1 NFB對肌球蛋白靜態(tài)流變學(xué)特性的影響
圖1為不同鈣源作用下肌球蛋白表觀黏度(ηa)和剪切速率(γ)的關(guān)系曲線。空白組、NFB組和CaCl2組肌球蛋白分子在低剪切速率下表現(xiàn)出較高的黏度,這是肌球蛋白分子間相互纏繞導(dǎo)致的[23]。隨著剪切速率的增加,3 組肌球蛋白表觀黏度下降,均呈先迅速下降后下降速率變緩的趨勢,這是由于肌球蛋白分子按一定方向流動,流體阻力降低,導(dǎo)致表觀黏度下降而呈剪切稀化現(xiàn)象[24]。NFB組肌球蛋白與CaCl2組曲線最接近,ηa明顯高于另外兩組,這是由于NFB、CaCl2釋放出的Ca2+在4 ℃條件下有利于肌球蛋白分子之間形成鈣橋[25]。而MFB顆粒較大,易破壞蛋白質(zhì)之間的作用,且鈣釋放率較低,故其表觀黏度最低[2,14]。
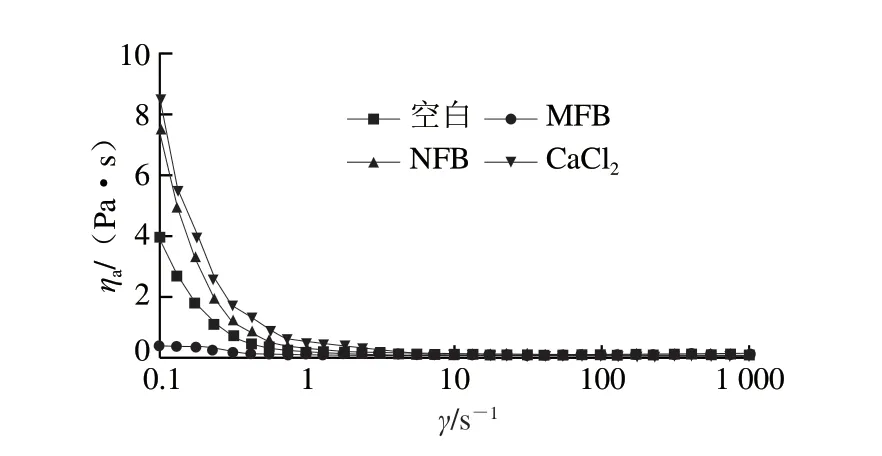
圖1 不同鈣源作用下肌球蛋白的表觀黏度(ηa)和剪切速率(γ)的關(guān)系Fig.1 Relationship between apparent viscosity (ηa) and shear rate (γ) of myosin added with different calcium sources
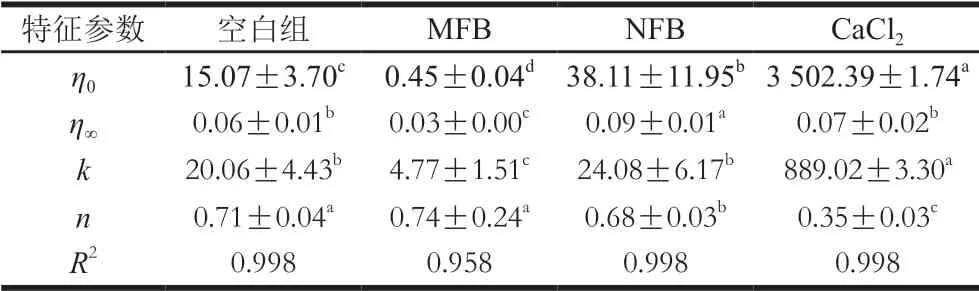
表1 不同鈣源作用下肌球蛋白聚集體Cross模型擬合參數(shù)Table 1 Fitting parameters of Cross model for myosin aggregates added with different calcium sources
采用Cross模型對表觀黏度ηa和剪切速率γ關(guān)系進(jìn)行擬合,結(jié)果見表1(R2均大于0.958),所有特征參數(shù)n均小于1,表現(xiàn)為假塑性流體特性。CaCl2組肌球蛋白的黏度系數(shù)(k)和零剪切黏度(η0)顯著高于其他組,NFB組次之,MFB組肌球蛋白k和η0最小,這進(jìn)一步驗(yàn)證了CaCl2和NFB的加入能夠提高肌球蛋白之間的相互作用,使其流動性下降。而MFB可能破壞了蛋白質(zhì)之間的作用力,而增加了其流動性。
2.2 NFB對肌球蛋白動態(tài)流變學(xué)特性的影響
圖2A1~C1為升溫過程中不同鈣源作用下肌球蛋白動態(tài)流變學(xué)性能的變化。4 組肌球蛋白在升溫過程中變化趨勢類似,tanδ隨溫度升高而降低。在4~30 ℃升溫過程中G’呈下降趨勢,這可能由于在4 ℃條件下肌球蛋白形成的主要是不穩(wěn)定非共價鍵[26],升溫破壞了該非共價鍵,使肌球蛋白流動性增強(qiáng)。30~38.8 ℃加熱過程中所有樣品G’均呈上升趨勢,其中空白組肌球蛋白上升幅度最小。40~45 ℃所有樣品G’輕微下降,這可能是由于肌球蛋白分子輕鏈解離使分子流動性增強(qiáng)或溫度升高,破壞了以氫鍵為主的低溫凝膠網(wǎng)絡(luò)結(jié)構(gòu)[27-28]。溫度高于45 ℃后所有樣品G’迅速升高,這是由于肌球蛋白分子間發(fā)生疏水相互作用及大量二硫鍵生成形成穩(wěn)定的網(wǎng)絡(luò)結(jié)構(gòu)[24]。54.3~80 ℃加熱過程中NFB組G′明顯低于CaCl2組,繼續(xù)加熱至90 ℃,兩組肌球蛋白G’相近,這可能由于溫度升高促進(jìn)NFB釋放更多離子鈣,加強(qiáng)了分子間的疏水相互作用[8],促進(jìn)了肌球蛋白的聚集。MFB的鈣釋放量低于NFB,且顆粒過大,影響了有序凝膠網(wǎng)絡(luò)的形成[11,14];因此MFB組肌球蛋白繼續(xù)加熱G’下降。
如圖2A2~C2所示,整個降溫過程中,4 組肌球蛋白G’和G”都呈上升趨勢,且G’的增幅遠(yuǎn)大于G”,tanδ小幅度波動。這是由于降溫冷卻可促進(jìn)肌球蛋白分子間的氫鍵形成,有利于形成穩(wěn)定的凝膠體系。從90 ℃降溫至40 ℃時,3 組加鈣肌球蛋白的G’高于空白組。而從40 ℃降溫至4 ℃時,MFB組和NFB組肌球蛋白G’相近,低于CaCl2組,但明顯高于空白組。這是因?yàn)轸~骨所釋放的鈣離子促進(jìn)了肌球蛋白的膠凝,但其釋放的Ca2+含量低于CaCl2組。


圖2 不同鈣源作用下肌球蛋白的動態(tài)流變學(xué)性能Fig.2 Dynamic rheological properties of myosin added with different calcium sources
2.3 NFB對肌球蛋白表面疏水性的影響
表2為不同鈣源作用下肌球蛋白在加熱過程中表面疏水性的變化。CaCl2組和空白組肌球蛋白表面疏水性在加熱過程中呈上升趨勢,NFB組和MFB組肌球蛋白經(jīng)40 ℃加熱處理后表面疏水性上升,經(jīng)90 ℃加熱處理后下降。這是因?yàn)榧訜峒半x子鈣的加入促進(jìn)了肌球蛋白分子展開,使原包埋在分子內(nèi)部的疏水性基團(tuán)暴露出來[23,29];但繼續(xù)加熱會使暴露出的疏水性基團(tuán)因相互作用聚集,而導(dǎo)致表面疏水性降低。未加熱條件下NFB組肌球蛋白表面疏水性介于CaCl2組和空白組之間,MFB組表面疏水性最低。這可能是由于魚骨中鈣的釋放率與魚骨粒徑成反比,魚骨粒徑越小其鈣釋放率越高[9]。NFB可溶性鈣的釋放率顯著高于MFB,NFB可在4 ℃條件下誘導(dǎo)肌球蛋白分子構(gòu)象發(fā)生變化,使肌球蛋白分子表面疏水性升高。而MFB可能由于其顆粒較大使部分蛋白沉降,導(dǎo)致可與ANS熒光探針結(jié)合的蛋白含量減少而使表面疏水性下降。推測NFB組、MFB組肌球蛋白在40 ℃加熱階段時疏水性基團(tuán)暴露占主導(dǎo),在90 ℃加熱階段形成了大量疏水相互作用。

表2 不同鈣源作用下肌球蛋白的表面疏水性Table 2 Surface hydrophobicity of myosin added with different calcium sources
2.4 NFB對肌球蛋白巰基含量的影響
表3為不同鈣源作用下肌球蛋白在加熱過程中活性巰基濃度的變化。未加熱條件下,與空白組相比,MFB組肌球蛋白活性巰基濃度增加,而CaCl2、NFB的加入對肌球蛋白的活性巰基濃度無顯著影響。經(jīng)40 ℃加熱60 min后,空白組、NFB組及CaCl2組活性巰基濃度顯著升高,且NFB組肌球蛋白活性巰基濃度介于CaCl2組和空白組之間;經(jīng)90 ℃加熱30 min后,NFB組和CaCl2組活性巰基濃度下降程度均高于空白組,說明NFB和CaCl2的添加促進(jìn)了蛋白質(zhì)間二硫鍵的形成。加熱過程中,MFB組肌球蛋白活性巰基濃度無顯著變化,這進(jìn)一步印證了顆粒較大的MFB干擾了二硫鍵的形成。此外,CaCl2所釋放的離子鈣含量高于NFB[14],其活性巰基濃度變化也最高,推測活性巰基濃度的變化與所添加鈣源釋放的離子鈣濃度密切相關(guān)。Li Yanqing等[30]也得到了類似的結(jié)論,加熱及離子鈣的加入使蛋白的疏水結(jié)構(gòu)發(fā)生變化,包埋在分子內(nèi)部疏水區(qū)域中的巰基基團(tuán)暴露在蛋白-水界面從而促進(jìn)活性巰基發(fā)生反應(yīng)導(dǎo)致活性巰基含量下降。

表3 不同鈣源作用下肌球蛋白的活性巰基濃度Table 3 Reactive sulfhydryl group contents of myosin added with different calcium sources mol/L
2.5 NFB對肌球蛋白溶解度的影響
溶解度可以反映蛋白的聚集情況,表4為不同鈣源作用下肌球蛋白在加熱過程中溶解度的變化。相同加熱條件下,MFB組肌球蛋白溶解度最高,NFB組溶解度介于空白組和CaCl2組之間,而CaCl2組最低,與鈣源的離子鈣釋放量趨勢剛好相反,這是由于Ca2+促進(jìn)了蛋白質(zhì)聚集,從而導(dǎo)致溶解度降低[31];MFB則因?yàn)槠漕w粒較大破壞了蛋白質(zhì)間的相互作用,導(dǎo)致肌球蛋白聚集程度降低[11]。這與流變學(xué)實(shí)驗(yàn)結(jié)果相符,進(jìn)一步說明了肌球蛋白經(jīng)加熱處理后溶解度均降低,蛋白質(zhì)分子經(jīng)加熱后結(jié)構(gòu)變得松散,α-螺旋向β-轉(zhuǎn)角和無規(guī)卷曲結(jié)構(gòu)轉(zhuǎn)變[23],原包埋在內(nèi)部的部分活性基團(tuán)暴露在表面,分子間形成疏水相互作用(表2)和二硫鍵(表3),導(dǎo)致蛋白質(zhì)聚集,溶解度下降。NFB的添加有利于提高肌球蛋白凝膠特性。
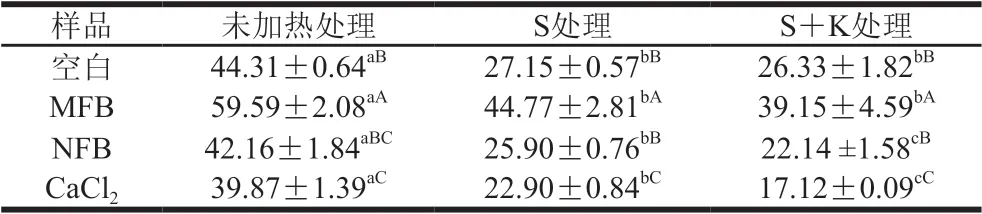
表4 不同鈣源作用下肌球蛋白的溶解度Table 4 Solubility of myosin in the presence of different calcium sources %
3 結(jié) 論
靜態(tài)流變學(xué)結(jié)果表明,Cross模型可以很好地擬合肌球蛋白表觀黏度ηa和剪切速率γ之間的關(guān)系,各組肌球蛋白樣品特征參數(shù)n均小于1,呈現(xiàn)出剪切稀化現(xiàn)象。NFB組和CaCl2組肌球蛋白表觀黏度增加,NFB和CaCl2的添加增強(qiáng)了肌球蛋白分子間的相互作用,而MFB因其釋放的鈣離子濃度較低,且顆粒較大,使蛋白質(zhì)分子間相互作用程度降低,產(chǎn)生相反的效果。進(jìn)一步結(jié)合動態(tài)流變學(xué)結(jié)果及蛋白質(zhì)分子間作用和構(gòu)象變化發(fā)現(xiàn),肌球蛋白分子間二硫鍵的生成及疏水相互作用的發(fā)生與鈣源釋放的鈣離子濃度密切相關(guān),NFB和CaCl2在加熱過程中釋放的大量鈣離子促進(jìn)了肌球蛋白分子間生成二硫鍵,疏水相互作用增強(qiáng),肌球蛋白聚集程度升高。NFB對肌球蛋白凝膠性能的促進(jìn)作用與CaCl2相近,明顯優(yōu)于MFB。綜上,NFB的加入能夠增強(qiáng)肌球蛋白的凝膠性能,這可為將NFB作為一種天然安全低價的鈣源應(yīng)用于魚糜制品中提供一定的理論依據(jù)。

