沙利度胺對重型β地中海貧血患者紅系細胞γ珠蛋白基因表達及分化的作用研究*
黃婉雪,楊 陽,汪曉輝,賴永榕
(廣西醫(yī)科大學第一附屬醫(yī)院,南寧 530021)
地中海貧血(地貧) 是由于遺傳基因缺失或突變所致的慢性溶血性貧血。我國的廣西、廣東、海南、貴州、云南等省是地貧高發(fā)區(qū)[1]。正常情況下,成人的Hb 基本成分血紅蛋白A(HbA)由兩條α 珠蛋白與兩條β珠蛋白鏈組成。在β地貧中,由于β珠蛋白鏈合成減少或缺失,過量的α 珠蛋白鏈沉淀在紅細胞中,導致紅細胞機械和氧化損傷。臨床上表現為溶血性貧血、鐵過載及氧化應激[2]。減少紅細胞中過量的α 珠蛋白鏈可以改善其過量帶來的影響。研究發(fā)現,誘導γ 珠蛋白生產可使其結合過多的α珠蛋白[3],形成胎兒血紅蛋白(HbF),可以減輕β地貧的臨床癥狀[3-4]。最初,研究人員發(fā)現5-氮胞苷[5-6]、羥基脲[7]等藥物可以提升人體內HbF 水平,但其毒副作用限制了臨床使用[8]。近年來研究發(fā)現,沙利度胺能提升HbF 從而有效改善中間型或重型β地貧患者的貧血情況[9-11]。臨床研究發(fā)現,沙利度胺可以減輕β 地貧輸血依賴患者的輸血量要求,提升非輸血依賴患者的血紅蛋白水平[9]。同時,可以減輕脾功能亢進引起的血小板減少帶來的臨床癥狀[12]。賴永榕課題組在研究中發(fā)現,沙利度胺可以誘導正常成人體外培養(yǎng)的紅系細胞γ 珠蛋白的升高,轉錄因子BCL11A、KFL1 可能參與其中的調控[13]。然而,關于沙利度胺提升重型β 地貧患者紅系細胞γ珠蛋白的研究較少。本研究探索沙利度胺對體外培養(yǎng)的重型β 地中海貧血患者人紅系細胞γ珠蛋白基因(HBG)的誘導作用、患者紅系細胞分化及參與調控的BCL11A、KFL1等轉錄因子的表達情況。
1 材料與方法
1.1 主要試劑與材料 CD34+磁珠(Miltenyi Biotec公司,批號:130-046-702);羥基脲(Sigma 公司,批號:MKBR1926 V);沙利度胺(TCI公司,批號:NQ4XL-PJ);逆轉錄試劑盒(TaKaRa 公司,批號:AI40713A);FastStart Univernal SYBR Green Master(ROX) (Roche 公司,批號:31598800) ;Trizol 試劑(LIFE 公司,批號:162905);RIPA 裂解液(碧云天,批號:P0013B);PMSF(索萊寶,批號:20170614);BSA[生工生物工程(上海)有限公司,批號:C500036]。無血清造血細胞培養(yǎng)和擴增培養(yǎng)基(SFEM;Stem Cell Technologies 公司,批號:18F91500);干細胞生長因子(stem cell factor,SCF;peprotech 公司,批號:AF-300-07);促紅細胞生成素(erythropoietin,EPO;peprotech 公司,100-64);白介素-3(IL-3;peprotech公司,AF-200-03);5%人血清(Gemini 公司,貨號100-318);CCK-8 試劑盒(beyotime,批號:C0038);珠蛋白單克隆抗體(CST 公司,批號:393865);BCL11A 單克隆抗體(CST 公司,批號75432S)和GAPDH 單克隆抗體(CST 公司,批號:2118S);抗兔IgG 二抗(CST 公司,批號:7074S);HbF-PE (BD 公司;批號:560041);HbA-FITC (biorbyt 公司;批號:orb15725);CD71(PE-Mouse Anti-Human)(BD 公司批 號:555537);CD235a(FITC-Mouse Anti-Human)(BD公司,批號:90249040)。
1.2 細胞收集與培養(yǎng) 細胞來源于廣西醫(yī)科大學第一附屬血液內科確診重型地中海貧血住院患者骨髓液。在廣西醫(yī)科大學第一附屬醫(yī)院倫理委員會的批準及征得患者的知情同意后,采用骨髓穿刺術采集其骨髓液。使用CD34+磁珠分選單個核細胞懸液獲得的CD34+細胞。細胞通過兩相液體培養(yǎng)模型向紅系分化。在最初14 d(第一階段),SFEM、SCF (50 ng/mL)、EPO (3 000 ng/mL)、IL-3(50 ng/mL)、1%雙抗、5%人血清培養(yǎng);擴大CD34+細胞數量。在接下來的7 d(第二階段),EPO(3 000 ng/mL)、1%雙抗、5%人血清擴增細胞并使其向紅系分化。沙利度胺溶解于DMSO。等量DMSO 溶劑為DMSO 組,100 μmol/L 羥基脲為陽性對照組,100 μmol/L、200 μmol/L、300 μmol/L 沙利度胺為實驗組。
1.3 實時熒光定量PCR (qPCR)檢測γ 珠蛋白與參與調控的轉錄因子的轉錄水平
檢測HBG、α 珠蛋白基因(HBA)、β 珠蛋白基因(HBB)及相關轉錄因子BCL11A、ATF4、HRI、KLF1、KLF2、GATA1、SOX6、TAL1表達。提取各組細胞總RNA,測定濃度和純度。根據逆轉錄試劑盒說明書將RNA 反轉錄為cDNA。HBG 及轉錄因子基因轉錄水平在CFX96 TM Read Time System(BIO-ROD)PCR 儀器上進行檢測。PCR 反應條件:94 ℃預變性5 min,94 ℃變性45 s,60 ℃退火45 s,72℃延伸30 s,共45個循環(huán)。采用2-△△CT法進行計算基因表達水平,實驗重復3 次。引物均由上海擎科生物科技有限公司合成,引物序列見表1。
1.4 蛋白免疫印跡法(Western blotting,WB)檢測γ珠蛋白與轉錄因子BCL11A翻譯水平 收集處理不同分化時間的后各組細胞,RIPA裂解細胞提取總蛋白。BCA 法進行蛋白定量,分別取20 pg 總蛋白上樣,濕法轉至PVDF 膜,5%的BSA 封閉,一抗γ 珠蛋白、BCL11A、GAPDH(1∶1 000)4 ℃冰箱孵育過夜,加入抗兔IgG 二抗(1∶1 000)。使用ECL 顯色,X 線膠片曝光后,凝膠成像分析系統(tǒng)進行圖像采集。GAPDH為內參標記抗體。
1.5 流式細胞術 選取最適濃度與檢測紅系分化免疫熒光染色:PBS 洗滌3 遍,2%多聚甲醛固定,使用破膜劑增加細胞膜透性,HbF-PE 和HbA-FITC 流式抗體染色。細胞的表型特征檢測:利用流式細胞儀分析紅細胞在不同分化時期細胞表面抗原的表達。使用CD71-PE;CD235a-FITC 標記的單克隆抗體對細胞進行雙染色(30 min),采用BD 公司和FlowJo流式細胞儀軟件進行分析。

表1 引物序列
1.6 CCK-8 實驗 將不同濃度沙利度胺作用不同時間的細胞以104個細胞/孔密度接種到96 孔板中,每組設置3 個副孔。將10 μL CCK-8 溶液添加至每孔中。37 ℃孵育4 h 后,在酶標儀中選擇450 nm 波長檢測細胞活性。
1.7 統(tǒng)計學方法 采用SPSS 17.0 軟件對數據進行統(tǒng)計學分析,計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗,以P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 沙利度胺誘導重型β 地中海貧血患者紅系γ珠蛋白提升的最適濃度與時間 利用CCK8檢測不同藥物濃度與作用時間對于重型β地貧患者紅系細胞生長抑制的情況(圖1A)。結果顯示,200 μmol/L沙利度胺作用72 h 時抑制率達56.92%。利用qPCR檢測不同藥物濃度與作用時間對HBG mRNA 表達的影響(圖1B)。200 μmol/L、300 μmol/L 沙利度胺作用72 h 后,γ 珠蛋白轉錄水平比DMSO 組升高2倍(P<0.05),與陽性對照組比較,差異無統(tǒng)計學意義(P>0.05)。隨后,利用流式細胞儀檢測不同濃度作用72 h 下,HbA 與HbF 的表達(圖1C~圖1E)。流式結果顯示,在200 μmol/L 沙利度胺作用72 h后,HbF 較DMSO 組明顯升高。根據結果選擇200 μmol/L沙利度胺作用72 h為最適條件。
2.2 沙利度胺對重型β 地貧患者紅系的珠蛋白表達的影響 在200 μmol/L 沙利度胺作用重型β 地貧患者紅系72 h 下,采用qPCR 檢測HBG mRNA 在不同分化時間段表達情況(圖2A)。HBG mRNA 在分化第7天開始升高,在紅系細胞分化第14天表達量高于對照組3 倍(P<0.05)。相同作用時間和濃度下,沙利度胺對于HBA 與HBB 在分化過程中的表達無明顯影響(P>0.05,圖2B~圖2C)。最后,利用WB 檢測重型β 地貧患者紅系γ 珠蛋白在分化階段的表達情況(圖2D),200 μmol/L 沙利度胺組γ 珠蛋白在分化第14 天高表達,與qPCR 結果顯示一致。結果顯示,沙利度胺可以在分化中不影響紅系HBA、HBB 轉錄水平的情況下,提升γ 珠蛋白的轉錄和翻譯水平,并且在分化第14天時提升最明顯。
2.3 沙利度胺對重型β 地中海貧血患者紅系分化的影響 200 μmol/L 沙利度胺作用β 地貧患者紅系72 h 后,利用流式細胞儀檢測細胞表面CD71、CD235a 在各個分化時間段表達(圖3A~圖3C)。隨著分化時間的增加,兩組紅系表面分化標記物CD71、CD235a 逐漸增高。但200 μmol/L 沙利度胺組紅系表面分化標記物較DMSO 組在分化后期有所降低(P<0.05),提示沙利度胺對紅系分化產生抑制效果。
2.4 參與重型β 地中海貧血患者紅系γ 珠蛋白與分化調控基因的表達情況 200 μmol/L沙利度胺作用β 地貧患者紅系72 h 后,利用WB 檢測BCL11A的表達情況。200 μmol/L 沙利度胺組BCL11A 的轉錄及翻譯水平較DMSO 組減少(P<0.05,圖4A~圖4B)。利用qPCR 檢測β 地貧患者參與紅系調控的轉錄因子在不同分化時間段的表達(圖4C~圖4I),結果顯示,與DMSO 組相比,200 μmol/L 沙利度胺組ATF4 在分化第21 天表達下降(P<0.05);HRI 在分化第14、第21 天表達下降(P<0.05);KLF1 在分化第7、第21 天表達下降(P<0.05);KLF2 在分化中的表達與DMSO 組比較,差異無統(tǒng)計學意義(P>0.05);GATA1 表達量在分化第7、第21 天下降(P<0.05);SOX6 在分化第14、第21 天表達下降(P<0.05);TAL1在分化第21天表達下降(P<0.05)。使用沙利度胺后,紅系細胞內BCL11A 下降,同時HRI、ATF4 均為下降趨勢,提示沙利度胺可能通過HRI、ATF4 通 路 下 調BCL11A。KLF1、GATA1、SOX6、TAL1 的下調變化可能在沙利度胺提升紅系細胞內γ珠蛋白的過程中發(fā)揮作用。
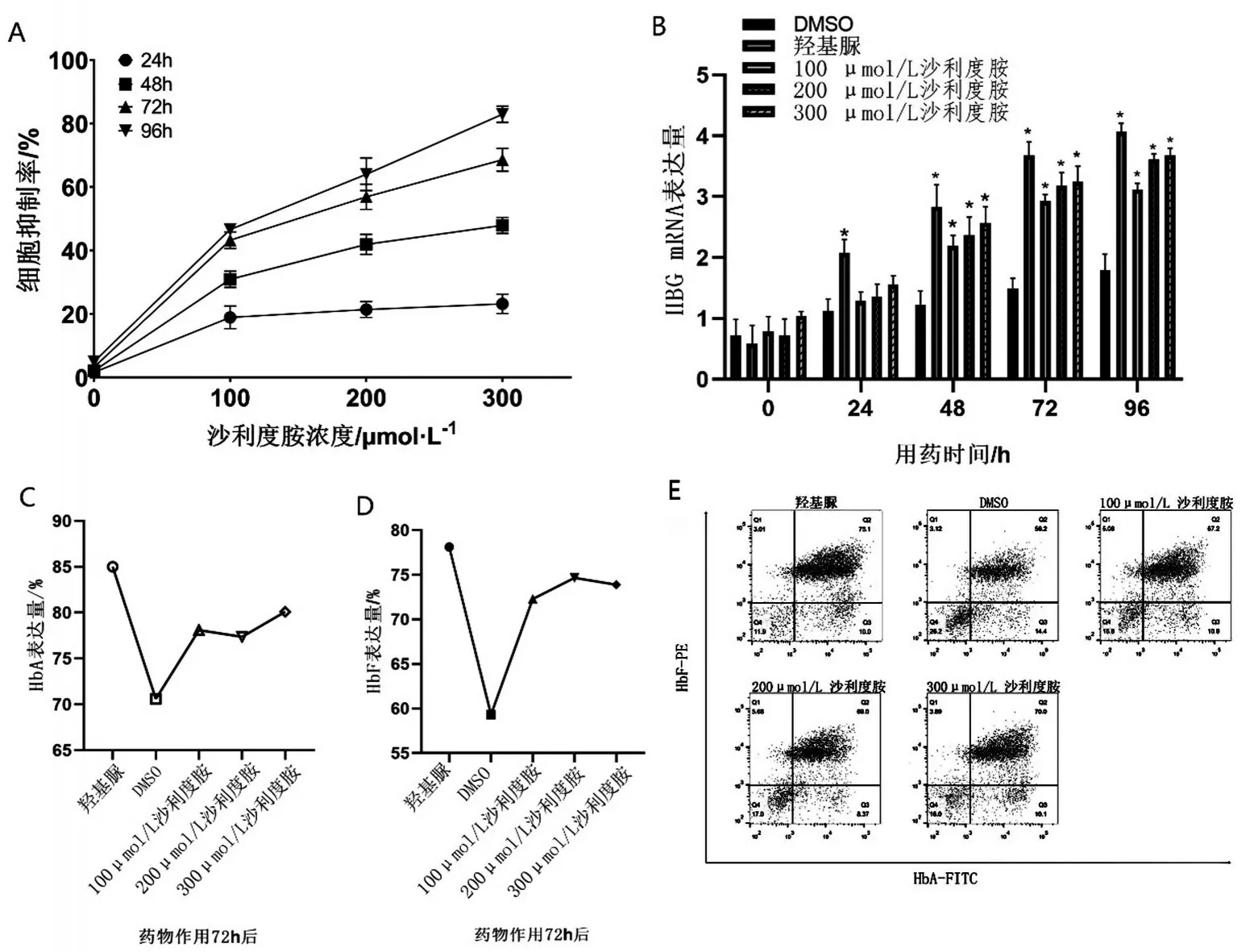
圖1 藥物濃度與作用時間對于提升β地中海貧血患者紅系γ珠蛋白的比較
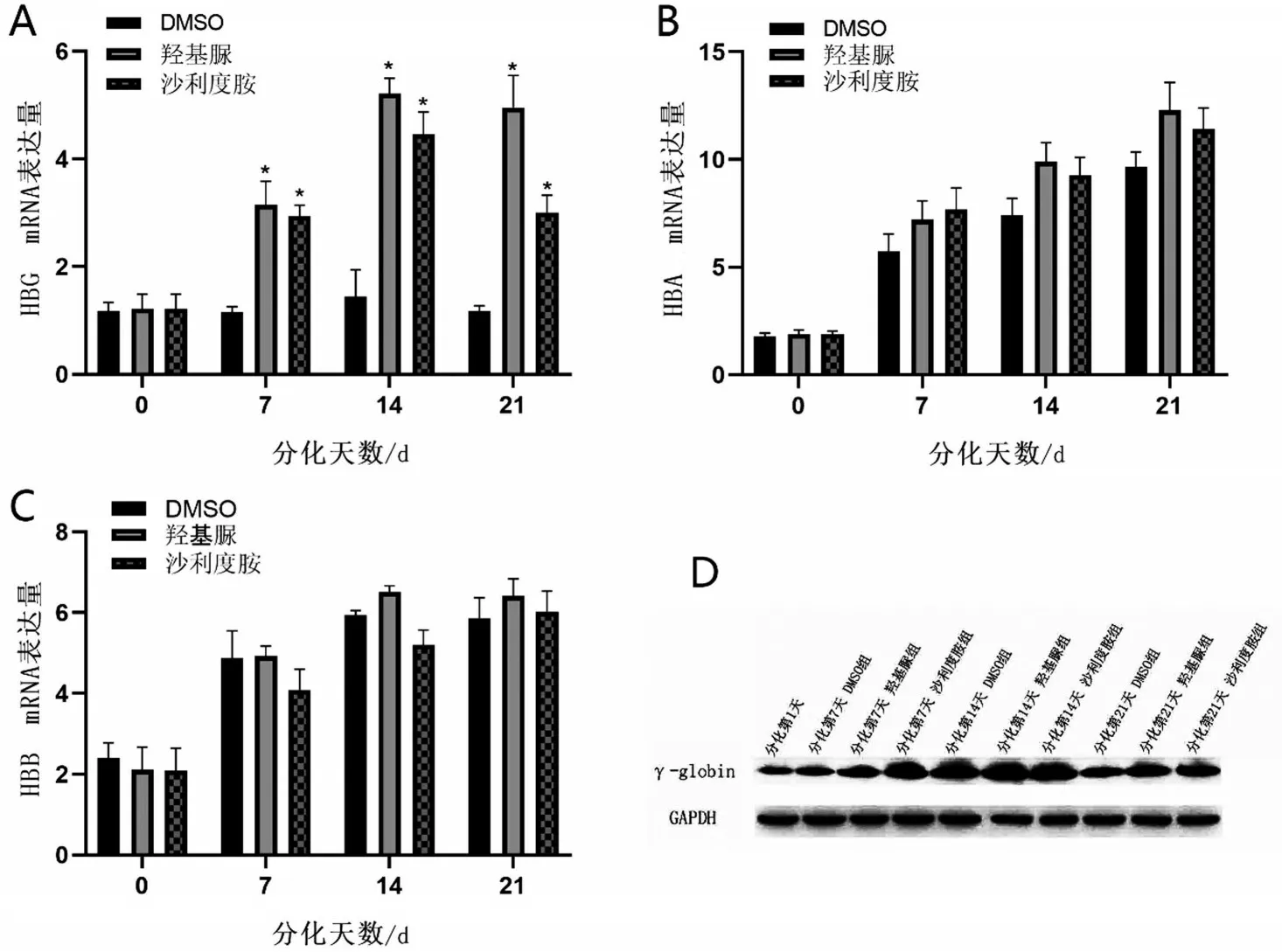
圖2 沙利度胺對于β地中海貧血患者紅系的γ珠蛋白的影響
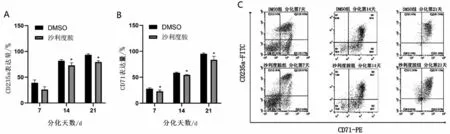
圖3 沙利度胺對β地中海貧血患者紅系分化的影響
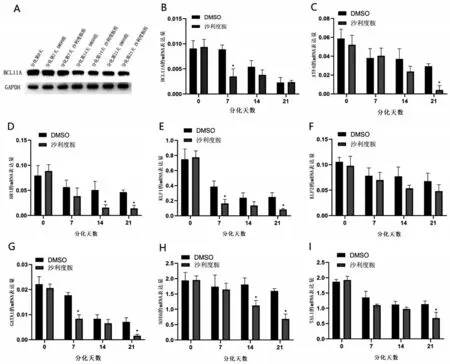
圖4 參與調控β地中海貧血患者紅系γ珠蛋白的轉錄因子基因在分化過程中的表達情況
3 討論
本研究發(fā)現,沙利度胺可以在不影響α 珠蛋白與β 珠蛋白的轉錄水平下,提升體外培養(yǎng)的重型β地貧紅系細胞內γ 珠蛋白轉錄和翻譯水平。與DMSO 組相比,γ 珠蛋白轉錄和翻譯水平隨著分化時間推移而增加且在第14天達到最高。其次,在沙利度胺的作用下,紅系細胞的表面分化標記物表達較對照組下降(P<0.05),提示沙利度胺影響了紅系分化。另外,與對照組相比,轉錄因子BCL11A的表達在分化第7 天降低;KLF1、GATA1 在分化第7、第21 天表達下降;HRI、SOX6 在分化第14、第21 天表達下降;ATF4、TAL1 在分化第21 天表達下降(P<0.05)。上述轉錄因子可能在沙利度胺提升重型β地貧紅系細胞內γ珠蛋白的過程中發(fā)揮作用。
CD71 為轉鐵蛋白受體,在紅系分化早期高表達[14]。CD235a 為紅系成熟表面標記物[15],隨著紅系的成熟而表達增加。在分化過程中,沙利度胺組CD235a較DMSO組降低(P<0.05)。提示沙利度胺可能通過減緩體外培養(yǎng)的重型β地貧紅系細胞的分化和成熟。研究表明,HRI 可以通過ATF4 調控BCL11A[16]。本研究中,HRI、ATF4 在分化過程中表達降低,提示沙利度胺可能通過HRI、ATF4 通路下調BCL11A。又有研究表明,在珠蛋白基因簇轉化的過程中,KLF1、GATA1 參與抑制γ 珠蛋白表達的過程[17];KLF1 與GATA1 在分化第7、第21 天下調可能與其參與沙利度胺誘導紅系HBG 表達的過程有關。SOX6 與TAL1 不僅可以抑制γ 珠蛋白的表達,同時在紅系分化中參與紅系增殖與成熟,調控分化[18-19];在本實驗中SOX6 與TAL1 在分化末期第21天均下降,SOX6與TAL1可能也參與沙利度胺誘導紅系HBG表達、影響紅系分化過程。
目前,一些研究已注意到沙利度胺能提升重型β地貧患者體內γ珠蛋白[20-21]。但少有研究探索沙利度胺提升γ珠蛋白涉及的機制。本研究采用二階段培養(yǎng)體系體外培養(yǎng)重型β 地貧患者紅系細胞,此體系模擬體內環(huán)境,結果更具可靠性。結果證實了沙利度胺能誘導體外培養(yǎng)重型β 地貧患者紅系細胞γ珠蛋白轉錄、翻譯水平升高。同時發(fā)現,沙利度胺可能通過減緩紅系細胞的分化成熟,增加未成熟紅細胞的增殖,從而有效誘導HbF 產生。在誘導過程中,轉錄因子BCLl1A、KLF1、GATA1 的下調可能是沙利度胺誘導HBG表達的作用機制之一;并且沙利度胺有可能在分化末期通過影響轉錄因子SOX6與TAL1,從而減緩紅系的分化,調節(jié)珠蛋白轉錄,從而有效誘導γ珠蛋白。

