CO2電催化還原的分子活化機理研究進展*
曹茂啟,孫賽蘭,龍成梅,毛海立,羅 駿,鄒洪濤,吳大旺
(黔南民族師范學院化學化工學院,貴州 都勻 558000)
在過去的30年里,全球CO2排放量增加了一倍,按照目前的化石燃料消耗速度,預計到2040年將增加兩倍,CO2排放量劇增的一個重要影響將是全球平均氣溫升高,對全球環境產生深遠影響[1]。隨著太陽能和風力發電成本的持續下降,電化學還原CO2正在成為一種降低大氣中CO2含量的有效策略,將可再生的電力能源以化學鍵的形式儲存在高能量密度的燃料中是一種可行的方案[2]。CO2和水通過電化學的方法轉化為碳基燃料的研究已經引起了電化學家們的極大興趣。但與電解水制氫相比,電催化CO2還原離工業化還有很多的基礎及技術問題需要解決,特別是必須克服在能源效率、反應選擇性和總轉化率方面的重大障礙[3]。
從可再生能源中獲取電能然后利用電子驅動化學轉化,是碳基化學品和燃料可持續生產和再生一個非常吸引人的方案。要想實現上述轉變,開發高豐度、高性能的電催化劑勢在必行,它不僅要能提供較低的能量損失和更高的效率,而且要求具有高活性和高穩定性。然而,CO2電催化劑還原的機理仍然有很多不清晰的地方,這阻礙了高效率CO2還原生成燃料催化劑的進一步開發,深入理解CO2電催化還原為燃料初始步驟有著重要的科學意義。
如圖1所示,電化學電解槽通過可再生電力的驅動將CO2和水轉化為化學物質和燃料。由此產生的燃料可以長期儲存,也可以被分配或消耗,釋放出的CO2被捕獲作為起始的反應物質,形成一個綠色的能源回路。此外,由此產生的CO和甲酸鹽小分子物質可以用作更復雜的化學合成原料。
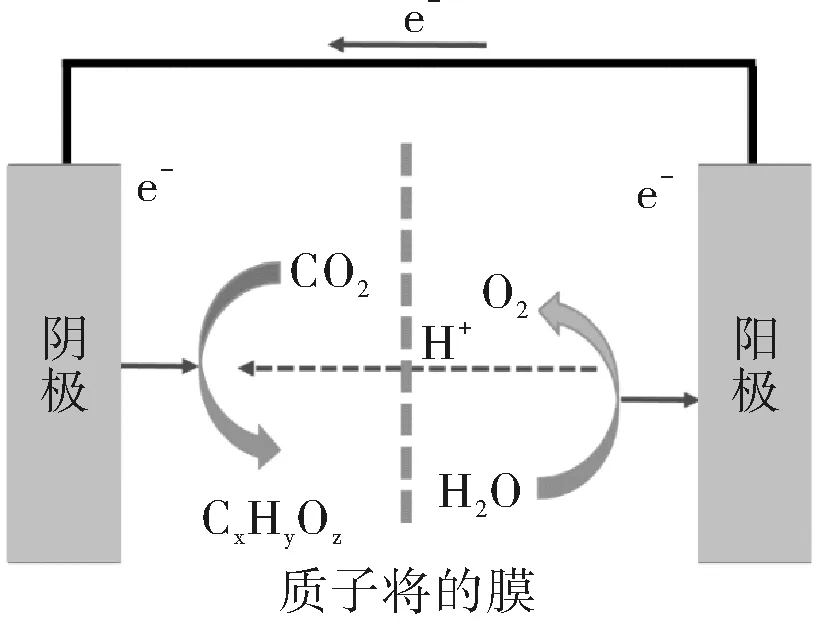
圖1 電催化CO2還原反應示意圖Fig.1 Schematic diagram of electrocatalytic CO2 reduction reaction
表1總結了CO2電化學還原的主要電化學反應及其標準氧化還原電位,包括CO、HCOOH、CH4、CH3OH、C2H4、CH3CH2OH等[4]。一般來說,在CO2電化學還原過程中,CO2分子首先與催化劑表面的原子發生吸附和相互作用,形成*CO2(*為催化劑),然后質子或電子逐步向不同的最終產物轉移。
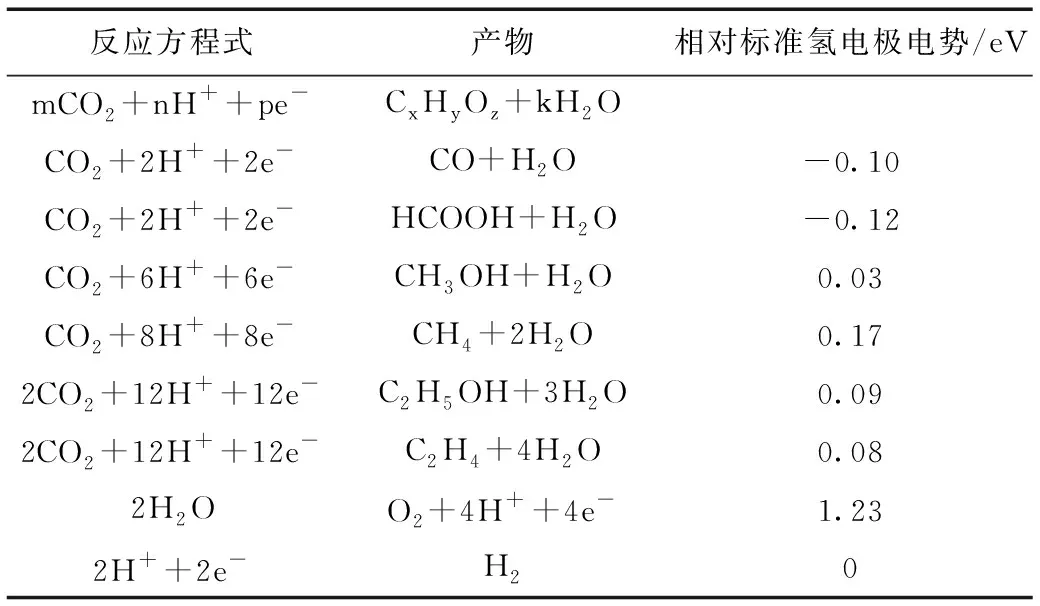
表1 CO2電化學還原主要產物的標準氧化還原電位Table 1 Standard redox potentials for major products of CO2 electrochemical reduction
表2概述了一些在水介質中對特定產物最具活性和選擇性的金屬或金屬衍生的電催化劑。在合適的電催化劑上,可以實現低過電位和高法拉第效率的雙電子轉移產物CO和HCOOH的生成,但CH4、CH3OH、C2H4、CH3CH2OH等多電子轉移產物的過電位明顯較高,選擇性也較低。
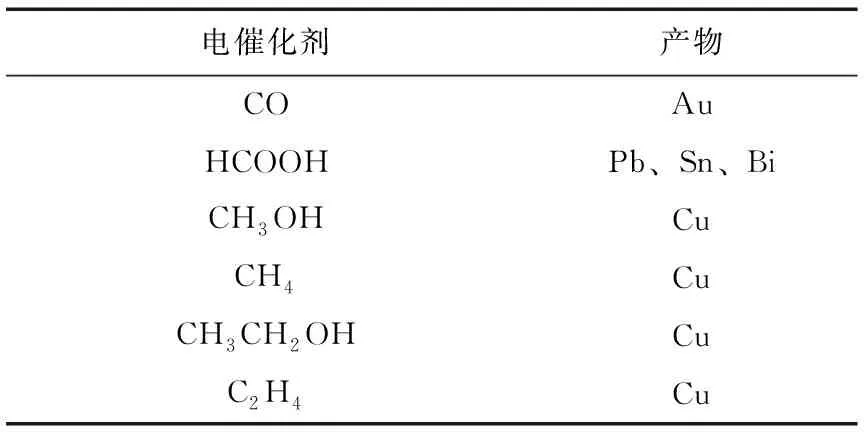
表2 產物及其典型催化劑的對應關系Table 2 The corresponding relationship between the product and its typical catalyst
本文的目的不是詳盡無遺的介紹CO2電催化還原的所有方面,而是有選擇性地重點介紹CO2分子在催化劑表面初始活化對C1產物選擇性及其碳碳偶聯生成C2的分子機理研究進展。
1 二氧化碳分子的初始活化
CO2還原反應的第一步是CO2分子在催化劑表面的初始活化。由于CO2是非常穩定的線性分子,通常認為CO2的活化和還原是困難的,形成CO2自由基中間體的第一個電子轉移具有非常負的氧化還原電位(相對于正常的氫電極為-1.9 V)。然而,通過在CO2和催化劑之間形成化學鍵,電催化劑可以穩定CO2自由基或反應中間體,使得負的氧化還原電位降低。選擇合適的電催化劑,可以在低過電位時將CO2高效的還原為CO或HCOOH[5-6]。這種低過電位下的高效催化作用是因為生成CO或HCOOH的雙電子過程通常只包含一個中間體。
在本文中我們考慮了四種與CO2活化有關的氧化還原反應:

(1)

(2)

(3)

(4)
式(1)和式(2)是所謂的質子-電子協同轉移誘導的CO2活化模式,其已被計算化學方法確認為過渡金屬表面間的選擇性活化趨勢[7]。如圖2所示,M-COOH被認為是有效生成CO的活化模式,而M-OCHO是普遍認同生成HCOOH的活化模式。通過利用計算化學給出的結合能,發現理論預測和實驗之間有很好的一致性,如過渡金屬Pb、Sn、Bi和In等,更喜歡通過CO2的氧結合到催化劑的表面上形成M-OCHO,對HCOOH有很好的選擇性,而其它過渡金屬電極,如Au等,更喜歡通過CO2的碳結合到催化劑的表面上形成M-COOH,對CO及其后續的產物有更好的選擇性,圖3為由CO出發生成CH4和CH3OH的反應路徑。
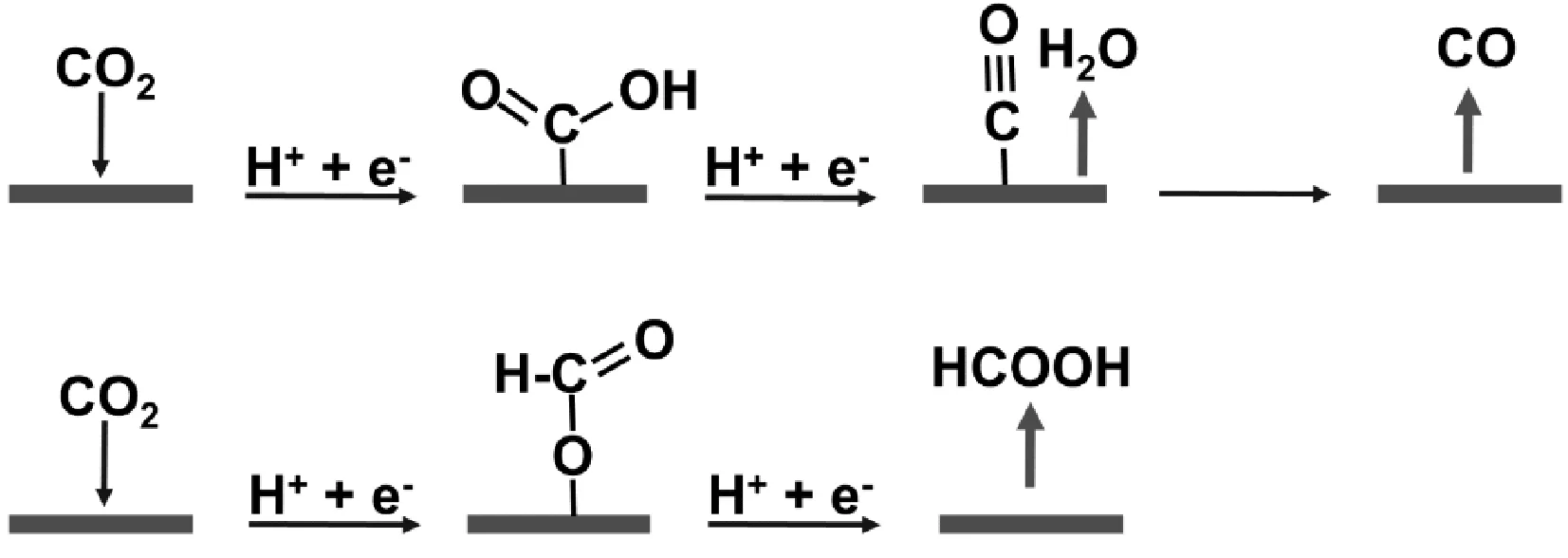
圖2 質子-電子協同轉移誘導二氧化碳活化生成CO和HCOOH的路徑Fig.2 Proton-electron cooperative transfer induces carbon dioxide activation to form CO and HCOOH pathways
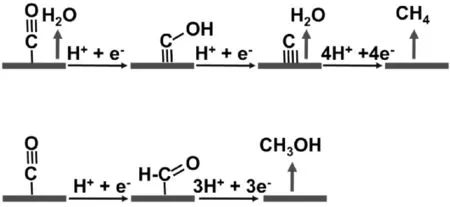
圖3 由CO出發生成CH4和CH3OH的反應路徑Fig.3 The path from CO to CH4 and CH3OH
有趣的是,在分子電催化領域,關于CO2初始活化的觀點似乎略有不同。CO2與催化劑的初始結合不涉及質子-電子協同轉移誘導的步驟,而是通過電子傳遞介導的CO2結合步驟,如式(3)和圖4所示。
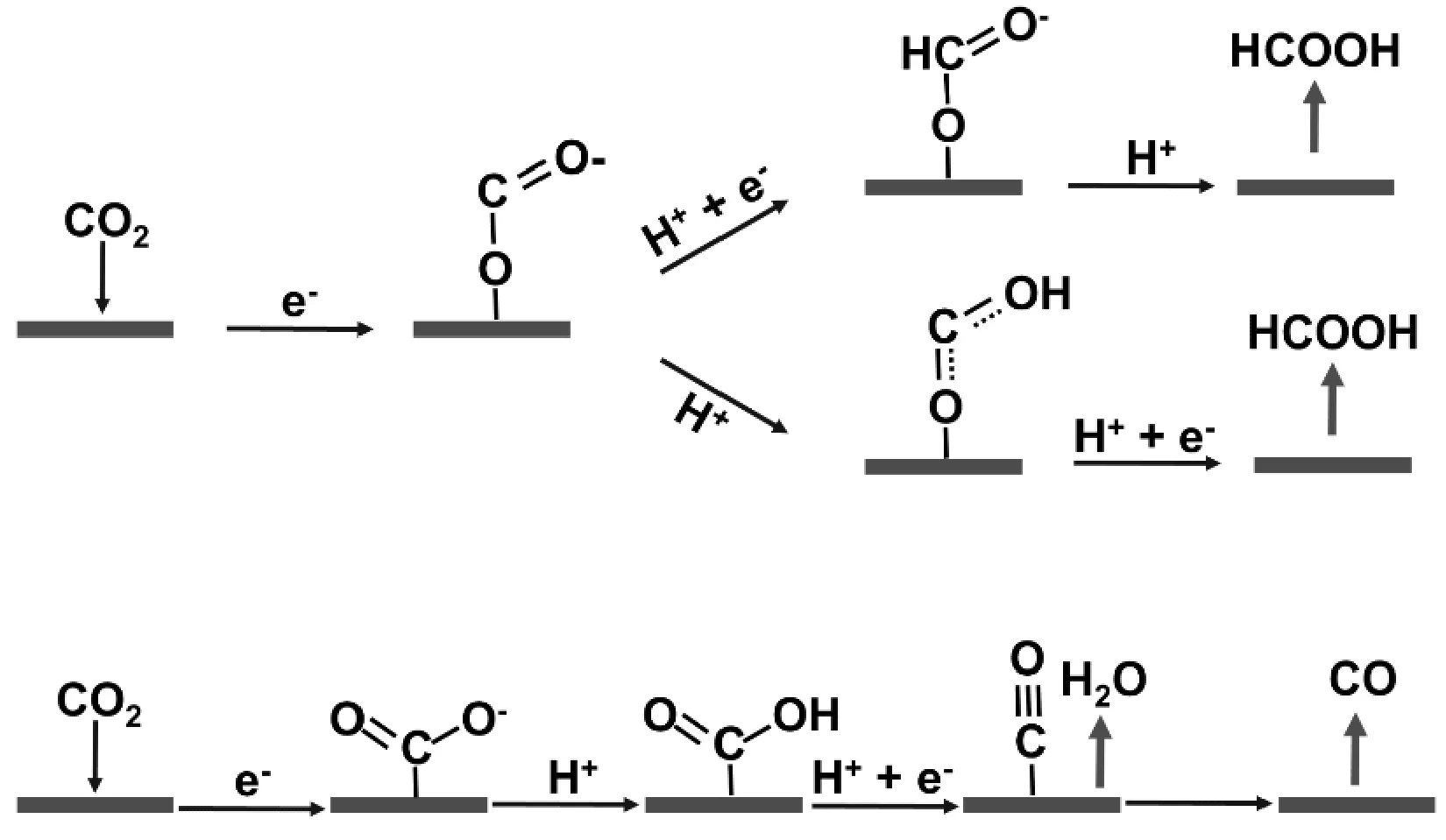
圖4 電子傳遞介導的CO2活化生成CO和HCOOHFig.4 Electron transport-mediated activation of CO2 to CO and HCOOH

(5)

(6)
CO2陰離子加合物一般與催化劑的金屬中心結合,對于金屬卟啉催化劑,如果金屬中心氧化態從M2+改變為M+,電子密度將回流到CO2配體上,則會發生CO2結合,其形式如式(5)和式(6)所示。隨后的質子化或質子-電子協同轉移誘導步驟生成M-COOH或M-COOH-中間體[8]。
在分子催化劑上產生甲酸鹽/甲酸也存在類似的情況。在金屬卟啉中,銠、錫和銦等卟啉對HCOOH有很高的選擇性[9]。密度泛函理論(DFT)計算表明,關鍵中間體是通過式(4)形成的陰離子氫化物[10]。如圖5所示,陰離子氫化物對CO2的碳原子進行親核攻擊,生成HCOO-。同樣,該反應是由金屬中心或配體氧化態的潛在變化引起的,氫化物駐留在金屬或配體上。產物的穩定性對后續的CO或HCOOH/HCOO-的形成至關重要[11-12]。
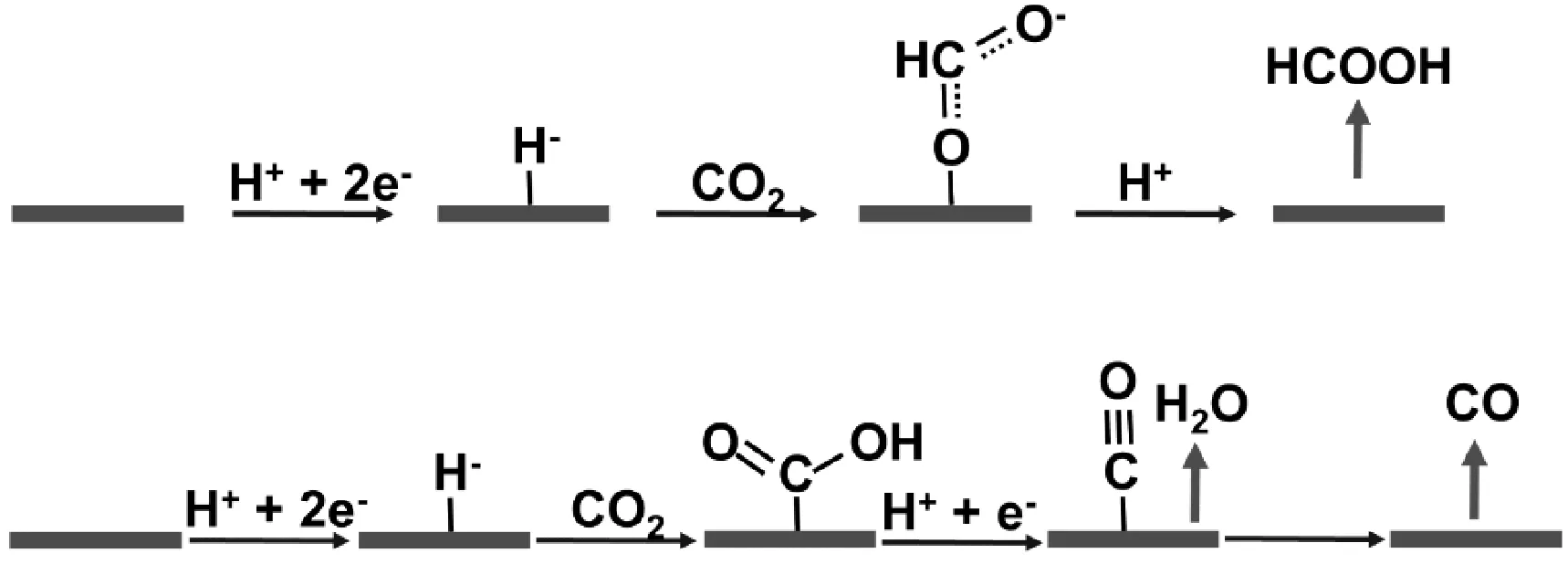
圖5 陰離子氫化物活化CO2生成CO和HCOOHFig.5 Anion hydride activationof CO2 to CO and HCOOH
2 碳碳偶聯
在CO2RR中,最有趣的觀察之一是具有一個或多個碳碳鍵物種的形成,這些碳碳鍵的形成大多發生在銅基催化電極上。除了銅基催化劑外,還有一些其他的催化劑,如NiGa、PdAu、NiP和氮摻雜的碳催化劑,可以產生兩個或多個碳原子的化合物,但其效率不如銅基催化劑[13-16]。近年來,通過調整銅的結構、電解質的組成以及在銅表面涂有機膜等方法,有效提高了C2產物的選擇性,取得了顯著的研究成果。
人們對利用二氧化碳生產更多低碳產品的興趣在于它們具有更高的能量密度和經濟價值。因此,闡明從CO2或CO到C2的產物具有重要的意義,其中乙烯和乙醇是最典型的例子(圖6),已成為若干實驗和理論研究的對象[17-20]。實驗觀察到兩種不同的乙烯生成途徑:一種是高過電位途徑,其中與甲烷途徑共享的中間體主要發生在Cu(111)上,另一種是低過電位途徑,主要發生在Cu(100)上,不產生C1產物。
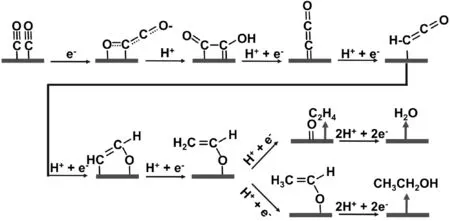
圖6 C2典型產物C2H4和CH3CH2OH的反應路徑Fig.6 The path of typical product of C2 of C2H4 and CH3CH2OH
除了乙烯,銅基上的CO2和CO還原產物還有為乙醛和乙醇。通常認為,這些C2是通過Cu(100)上的共同中間體形成的,氫化導致乙醛和隨后的乙醇,氫化分解導致乙烯。
在銅上也觀察到了C3化合物的形成,在合適的銅催化劑上,其法拉第效率可達20%。C3的主要產物是丙醇和丙醛,含有少量的羥基丙酮、丙酮和烯丙醇。這些C3產物形成的基本步驟尚未得到很好的研究。雖然CO插入型反應步驟似乎可行,但C3烴類的電化學形成方面仍缺乏機制研究。
3 結 語
CO2循環回收能夠作為一種構建高附加值燃料、化學品的碳能源,并且有可能提供一種有效改善氣候問題和解決化石燃料問題的方案。在目前的各種CO2回收循環方法中,CO2電催化還原的方法是一種可能性較高的方法。取決于催化劑的改變,CO2電催化還原生成高附加值碳氫化合物。通過一系列研究,目前開發了多種高活性催化劑,同時反應的機理、反應路徑等受到了廣泛而深入的研究。CO2的分子活化作為電催化還原過程的第一步,其對反應產物的選擇性具有重要影響。本文詳細闡述了與CO2活化有關的氧化還原反應,為深入理解二氧化碳分子在催化劑表面的初始活化對C1產物選擇性及碳碳偶聯生成C2產物的分子機理提供了一定的借鑒。

