集成MRI技術對早產兒腦成熟評估研究
趙彩雯,趙鑫,劉彥超,邢慶娜,張小安
近年來,早產兒嚴重腦白質損傷發生率明顯減少。然而,早產兒大腦不成熟,極易受到圍產期高危因素影響,這些損傷可能與日后認知、語言、社會交流等落后有關[1-3]。因此早期識別高風險患兒及時干預至關重要。已知早產兒在糾正足月齡時MRI表現與長期神經發育結果有關[4-5]。常規MRI 序列定性評估大腦發育,其信號強度不能用于與正常參考值比較或后續研究[6]。集成MRI技術不僅能提供常規影像學診斷所需要的圖像,還可以提供定量值用于早期發現異常成熟和疾病狀況[7-9]。有研究提供了從新生兒到青少年T1、T2、質子密度(proton desity,PD)年齡特異的區域參考值[8]。但關于早產兒的相關研究較少。本研究旨在探討集成MRI技術所獲取的糾正足月齡時弛豫值對早產兒腦成熟評估的可行性和應用價值。
1 資料與方法
1.1 研究對象
選取2020 年5 月到2021 年3 月在鄭州大學第三附屬醫院成功完成常規MRI 和MAGiC 檢查的新生兒,包括早產兒31 例,足月兒40 例。納入標準[10]為:(1)臨床標準:①無缺氧缺血性腦病、先天感染、先天代謝性疾病、顱腦畸形;②在后期隨訪中未出現明顯神經系統癥狀和體征;(2)影像標準:①新生兒腦常規MRI檢查沒有異常;②無明顯運動偽影。31例早產兒出生時胎齡為(29+1~36+6) (34.5±2.2)周,體質量為(1.2~3.7) (2.3±0.6) kg;40 例足月兒出生胎齡為(37+0~41+1) (38.6±1.1)周,出生體質量為(2.5~5.2) (3.4±0.6) kg;兩組核磁檢查時糾正胎齡(postmenstrual age,PMA)為37~45 周,兩組新生兒PMA、性別、5 min Apgar評分及雙胎占比差異無統計學意義(P>0.05)。本研究經醫院倫理委員會批準(批準文號:2021-075-01),監護人均已簽署知情同意書。
1.2 MR圖像采集
為減少頭動以順利完成檢查,在掃描前15~30 min 口服水合氯醛或灌腸(20~30 mg/kg)鎮靜。新生兒入睡后包裹在襁褓中放置在MRI掃描床上,檢查過程中,注意聽力保護及保暖。采用GE SIGNA Pioneer 3.0 T MRI 掃描儀,掃描野包括整個大腦。常規軸位T1WI、T2WI、矢狀位T1WI和彌散加權成像掃描,MAGiC 掃描序列:TR 4266 ms,TE 19.4/97.1 ms,接收帶寬25 Hz/像素,FOV=20 cm×20 cm;矩陣=288×224,層數22,層厚4 mm,層間距1 mm,總掃描時間為4 min 16 s。
1.3 定量值測量
將掃描數據導入后處理軟件SyMRI 8.0(SyntheticMR,Link?ping,Sweden)自動計算得到T1、T2、PD圖,并在ITK-SNAP軟件(3.8.0,Windows自助安裝包,64位)測量。手動勾畫ROI如圖1:①白質:內囊后肢(posterior limb of internal capsule,PLIC);內囊前肢(anterior limb of internal capsule,ALIC);大腦腳(cerebral peduncle,CereP);半卵圓中心中央部(centrum semiovale,CS);胼胝體壓部(splenium of the corpus callosum,SCC);胼胝體膝部(genu of the corpus callosum,GCC);視輻射(optic radiation,PTR);枕葉白質;額葉白質;②深部灰質:丘腦、蒼白球、殼核、尾狀核。ROI 均放置在雙側大腦對稱部位的解剖位置中心,其大小根據不同解剖位置調整(10±2) mm2,每個位置測量3 次取平均值,以上工作由兩名影像科醫生協商完成。
1.4 統計學分析
采用SPSS 26.0 及GraphPad Prism 8.0 對數據進行統計學分析。計量資料采用平均值±標準差表示。早產兒與足月兒T1、T2 值組間差異采用兩獨立樣本Mann-WhitneyU檢驗,按照公式“相對變化量=100%×(早產兒定量值-足月兒定量值)/足月兒定量值”,計算T1、T2弛豫值相對變化量。控制出生孕周,運用偏相關分析分別計算早產兒與足月兒T1、T2、PD值與MR 掃描時PMA 相關性。以P<0.05 為差異有統計學意義。P<0.001 表示差異有非常顯著統計學意義。
2 結果
2.1 不同區域的T1、T2、PD值
早產兒及足月兒各白質區及深部灰質T1、T2、PD值不同。內囊及胼胝體(PLIC、SCC) T1、T2 值后部分別明顯短于前部(ALIC、GCC),位于中央位置的投射纖維(PLIC、CS、CereP)及連合纖維(GCC、SCC)比周圍白質顯示更短的T1、T2 值(P均<0.05)。生后早期深部灰質核團T1、T2值相對白質短,丘腦和蒼白球較靠前外側的殼核和尾狀核T1、T2 值更短(P均<0.05),見表1及圖2、3。
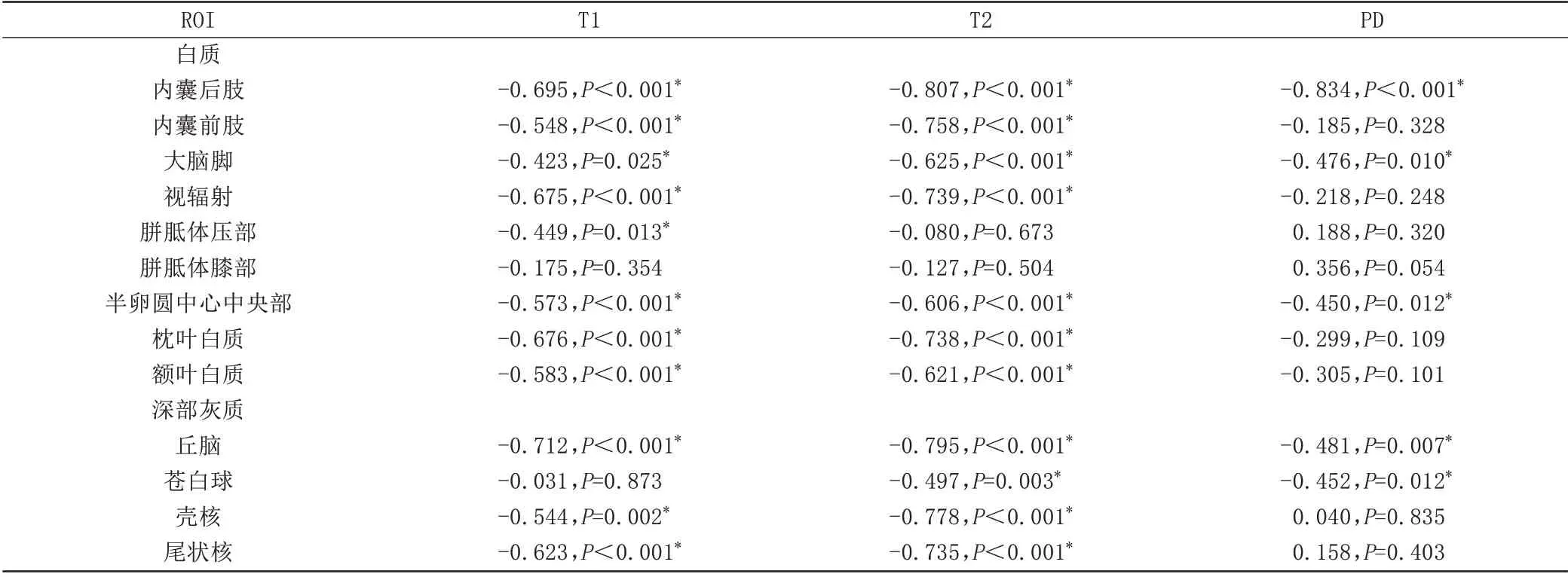
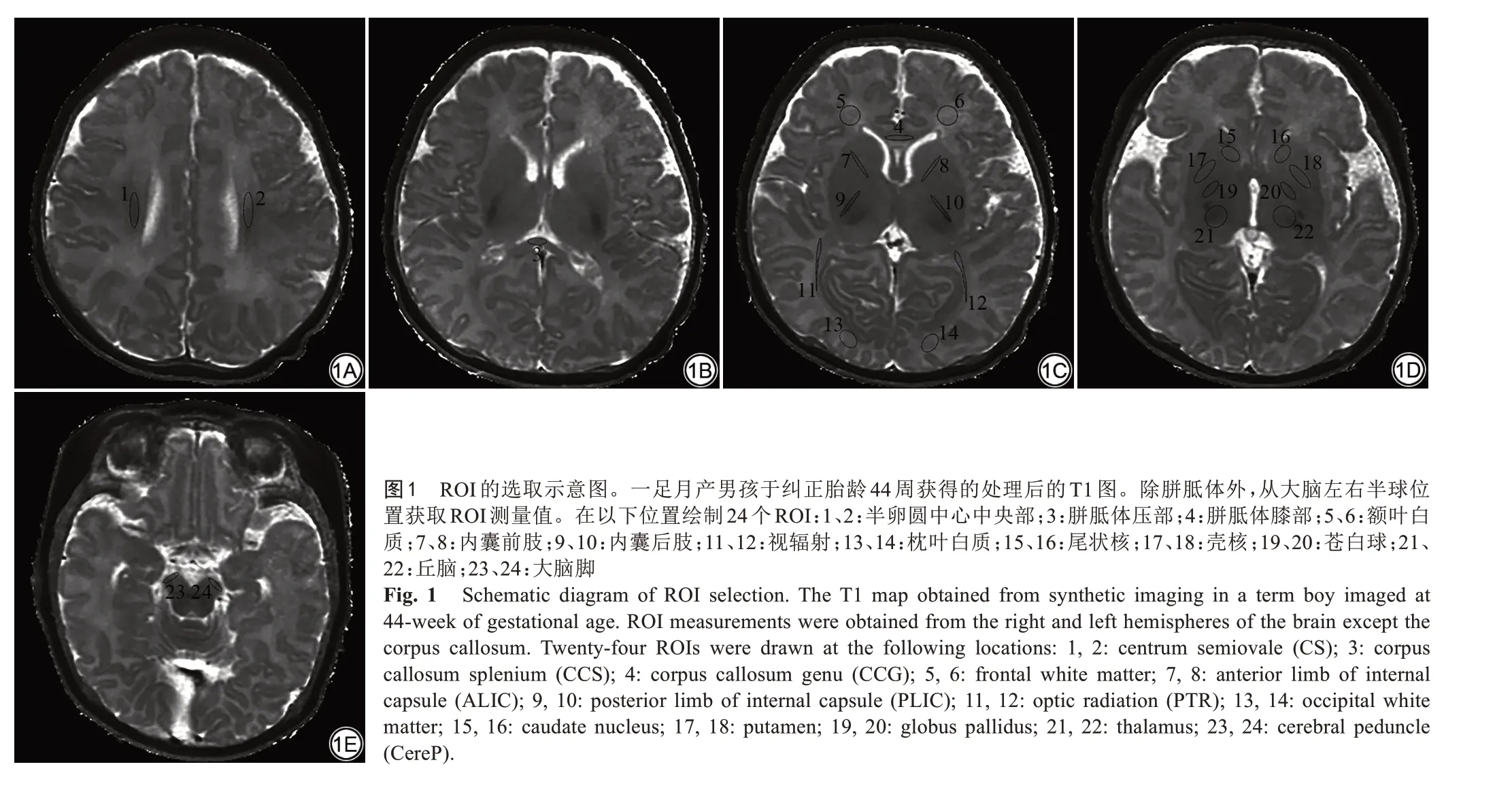
表1 早產兒各ROⅠT1、T2、PD值與PMA偏相關系數(n=31)Tab.1 Partial correlation coefficients between relaxation values and PMA for all selected ROⅠs in the preterm infants(n=31)

圖2 早產兒和足月兒各ROⅠ的T1值比較。注:*:P<0.05,兩組比較差異有統計學意義;**:P<0.001,兩組比較差異有非常顯著統計學意義Fig. 2 Comparison of T1 values between preterm infants and term infants in all ROⅠs.Note:*:P<0.05;**:P<0.001.
2.2 T1、T2、PD值與PMA相關性
早產兒大多數白質區域和深部灰質核團T1、T2弛豫時間隨PMA增加下降。早產兒白質區域,PLIC的T1、T2 值與PMA 相關性最強(r=-0.695,r=-0.807,P均<0.001);早產兒深部灰質,丘腦T1、T2 值與PMA相關性最強(r=-0.712,r=-0.795,P均<0.001)。足月兒存在相似發育趨勢,但與早產兒相比,同一區域相關系數減低。足月兒白質區域,PLIC T1、T2 值與PMA 相關性最強(r=-0.547,r=-0.742,P均<0.001);足月兒深部灰質,丘腦T1、T2 值與PMA 相關性最好(r=-0.256,r=-0.719,P均<0.001),見表2、3。
表2 足月兒各ROⅠT1、T2、PD值與PMA偏相關系數(n=40)Tab.2 Partial correlation coefficients between relaxation values and PMA for all selected ROⅠs in the term infants(n=40)
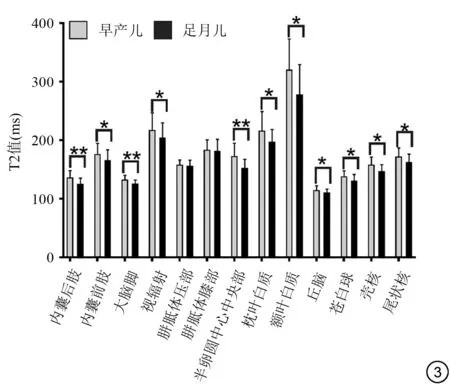
圖3 早產兒和足月兒各ROⅠ的T2值比較。注:*:P<0.05,兩組比較差異有統計學意義;**:P<0.001,兩組比較差異有非常顯著統計學意義Fig.3 Comparison of T2 values between preterm infants and term infants in all ROⅠs.Note:*:P<0.05;**:P<0.001.

表3 早產兒和足月兒各ROⅠT1、T2值比較Tab.3 Comparison of relaxation values between the preterm and term groups
2.3 T1、T2值組間比較
白質區域,早產兒PLIC、ALIC、CST、PTR CS、額葉白質及枕葉白質T1、T2弛豫時間較足月兒延長(P均<0.05)。深部灰質區域,丘腦、蒼白球、殼核、尾狀核T1、T2弛豫值均長于足月兒(P均<0.05)。早產兒與足月兒T1、T2 相對變化量在PLIC (T1△=11.82%,T2△=8.26%,P均<0.001) 及CS (T1△=11.57%,T2 △=13.29%,P均<0.001)最顯著,見表1。
3 討論
本研究應用集成MRI技術對糾正足月齡早產兒和足月兒弛豫參數分析,比較腦內不同部位T1、T2、PD值及與年齡相關性,比較早產兒和足月兒弛豫值差異。結果發現集成MRI技術T1、T2弛豫值可識別區域大腦發育的時-空軌跡,顯示早產兒與足月兒早期腦發育的細微差異,是評估早產兒腦成熟度的有價值指標。
3.1 不同腦區成熟度差異
本研究發現分別在內囊、胼胝體和腦葉,T1、T2弛豫時間從后向前逐漸延長,位于中央的PLIC、CS及靠下的CereP 比周圍白質顯示更短的T1、T2 值。大腦成熟基本規律為從后到前、自下而上、由中央到四周[11,12]。本研究結果與大腦成熟空間規律一致。同時本研究發現位于端腦中央的PLIC 的T1、T2 值最低,處于此時期最高發育水平。既往DTI 研究發現,各向異性分數值在SCC最高,并不是髓鞘發育更加成熟的PLIC[13]。而本研究中PLIC 的T1、T2 值最低,更加符合實際白質發育規律。深部灰質核團T1、T2 值較白質普遍低,反映其在新生兒期較白質更成熟,其中位于中央的丘腦和蒼白球的T1、T2值更低。
3.2 不同腦區發育速度差異
關于極早產新生兒的研究發現,糾正足月齡時大腦成熟與T1 和T2 弛豫時間的線性下降有關[14,15]。本研究也發現早產兒大多數白質區域T1、T2值與PMA呈明顯負相關;足月兒存在相似發育趨勢,但與早產兒相比,同一區域相關系數減低,這可能表明:早產兒由于早期暴露于宮外環境加速了早期腦發育[16]。PLIC T1、T2 值與PMA 的相關性最強,這表明糾正足月齡時期PLIC 正經歷快速發育,可通過弛豫值變化加以量化。T1、T2 值縮短與髓鞘成熟及腦內水分減少有關,然而兩者時間進程不同,可以區分出兩種不同機制:水分子區室化變化及蛋白質和脂質含量增加[17-18]。T1縮短在“預髓鞘化”階段已經發生,T2縮短與髓鞘的化學成熟相關,在大腦成熟的高級階段更明顯[19]。與T1、T2 值相比,PD 對新生兒腦成熟的顯示不太明確。本研究中早產兒PD 值只在發育相對成熟的PLIC、CS及大腦腳發現了相關性,推測與T1、T2 相比,PD 縮短發生的可能更晚、更慢[20]。深部灰質核團中丘腦T1、T2值與PMA相關性最強,推測弛豫時間縮短可能較少地反映了髓鞘化的進程,而與神經細胞發育、突觸及樹突快速增殖和順磁性物質如鐵的積累有關[21]。
3.3 早產兒與足月兒腦成熟差異
本研究發現早產兒PLIC、ALIC、CereP、PTR、CS、額枕葉白質T1、T2 弛豫時間較足月兒延長,差異在PLIC 和CS 最明顯。之前的DTI 研究也發現糾正足月齡時可在早產兒大腦中檢測到髓鞘形成延遲[13,22]。近期有研究表明SyMRI 檢測早產兒髓鞘形成延遲優于常規序列[23]。差異最顯著的PLIC和CS在足月時期已經有部分髓鞘形成,推測這些早期和快速形成的髓鞘在生后早期最容易受到損傷,而對這些形成成熟髓鞘的少突膠質細胞前體的破壞和隨后的成熟障礙可能在真正的髓鞘形成時才變得更加明顯。Vanderhasselt 等[14]的近期研究也發現患有嚴重生后疾病的新生兒局部組織弛豫時間延長,在PLIC 和CS最顯著,且其預測高危狀態的準確性最高。
本研究局限性在于:(1)由于目前只有少數研究評估了SyMRI腦分割算法在新生兒的適用性,本研究未納入腦體積分割結果及髓鞘分數,后期會深入研究;(2)樣本量較小,在后續研究中將進一步擴大樣本量,提高可信度;(3)弛豫定量分析存在其局限性,后期會同時運用其他技術手段(如擴散峰度成像),組合比較這些參數,了解各參數的敏感機制,細化研究腦發育。(4)另一個關鍵后續步驟是研究在糾正足月時存在的早產兒大腦微觀結構差異是否與長期神經發育結果有關。
綜上所述,集成磁共振成像技術獲取的T1、T2弛豫值與髓鞘發育程度密切相關,可以識別區域大腦發育的時-空軌跡,并顯示早產兒與足月兒早期腦發育的細微差異,是評估腦成熟度的有價值指標,可以考慮作為定量影像標記物早期發現異常腦成熟和疾病狀況,指導早期干預以減少神經發育障礙。
作者利益沖突聲明:全體作者均聲明無利益沖突。

