3.0 T 磁共振酰胺質子轉移成像在乳腺疾病中應用價值的初步研究
文潔,王猛,向露,劉周,任雅,楊倩,羅德紅,2*
作者單位:1.國家癌癥中心/國家腫瘤臨床醫學研究中心/中國醫學科學院北京協和醫學院腫瘤醫院深圳醫院,深圳518000;2.國家癌癥中心/國家腫瘤臨床醫學研究中心/中國醫學科學院北京協和醫學院腫瘤醫院,北京100021
2000 年以來,化學交換飽和轉移(chemical exchange saturation transfer,CEST)成像已成為磁共振分子成像領域的重要研究方向[1]。磁共振酰胺質子轉移(amide proton transfer,APT)加權成像是一種無創、無輻射的新型化學交換飽和轉移成像技術,在2003 年由Zhou 等[2]首次提出,距離水峰+3.5 ppm處為酰胺質子峰,在此施加偏共振飽和脈沖后,該處水信號下降,提示酰胺質子和大量水質子之間的交換[3],可以在沒有外源性對比劑的情況下檢測與內源性流動蛋白、胞漿蛋白和肽相關的主鏈酰胺質子[4]。早期關于該成像技術應用的研究主要集中在腦部腫瘤的鑒別診斷、預測預后等[5-7],近年來有該成像技術在7.0 T 高場磁共振下檢測乳腺癌裸鼠模型的研究[8],7.0 T 磁共振下在健康女性志愿者中進行乳腺APT 成像[9,10],證實了7.0 T 磁共振可檢測到健康人類乳腺纖維腺組織的APT 效應。目前3.0 T 磁共振中應用APT 成像已經被應用人體多個系統的良、惡性病變鑒別診斷、療效評估等[11-13],但就3.0 T 磁共振APT 成像在乳腺疾病中的應用,國內外僅有個別報道,相關的研究尚處于起步階段。本研究旨在利用3.0 T磁共振的APT成像,初步探索其在乳腺疾病應用的價值,包括乳腺良、惡性病變、正常組織間APT 值的差異及不同病理組織學特征的乳腺癌APT值的差異。
1 資料與方法
1.1 研究對象
回顧性分析2020 年1 月至2020 年12 月我院進行3.0 T乳腺MR 檢查的患者。本研究經過中國醫學科學院腫瘤醫院深圳醫院醫學倫理委員會批準(批準文號:KYLX2021-41)。納入標準:(1) MR 檢查前未行手術、穿刺或放化療者;(2)患者已掃描APT成像序列;(3)獲得最終病理結果的患者。排除標準:MRI 的APT 成像圖像質量不佳或病灶過小,無法判斷病灶,不能用于分析者。
1.2 MR檢查方法
采用GE公司3.0 T超導磁共振掃描儀,8通道乳腺專用磁共振線圈,患者俯臥位掃描,雙側乳腺自然懸垂于乳腺專用線圈內。掃描序列及相關參數如下:(1)常規MR掃描。軸位T1WI平掃不壓脂序列(TR=537 ms,TE=6.3 ms,矩陣320×256,帶寬=83.33×2,層厚=5 mm, NEX=1)及T2WI 壓脂序列(TR=5230 ms,TE=85 ms,矩陣320×256,帶寬=62.5×2,層厚=5 mm,NEX=1);矢狀位T2 壓脂序列(TR=3259 ms,TE=102 ms,矩陣288×224,帶寬=50×2,層厚=4 mm,NEX=2)。(2)擴散加權成像掃描。軸位:掃描層面同軸位壓脂序列,采用單次激發EPI序列,b 值分別取0、800 s/mm2。(3) 2D APT 掃描。雙側乳腺同時成像,序列SSFSE (TR=3000 ms,TE=Minimum,矩陣128×128,層厚/層數=4 mm/1,自動局部高階勻場,飽和脈沖時間2000 ms,掃描時間4 min 30 s)。
1.3 圖像分析
影像學圖像由兩名經驗豐富的乳腺放射學診斷醫師共同分析,如有爭議協商解決。對乳腺疾病顯示最大層面的腫瘤組織進行APT 序列掃描,將MR 掃描所獲得的圖像傳至后處理工作站,在避開肉眼所見的出血、壞死區時測量病變的APT值,并三次測量取其平均值。
1.4 病理結果
所有患者進行手術或穿刺活檢(其中68 例為手術切除,13 例為穿刺活檢)獲得的最終病理結果。其中所有乳腺癌的患者查閱免疫組化結果:雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)、Her-2 受體、Ki-67 表達情況。ER 和PR 的結果判斷標準如下:陽性腫瘤細胞≥10%為陽性,<10%為陰性。Her-2 的檢驗對免疫組化染色(-)或(+)判斷為陰性,(+++)判斷為陽性;若結果為(++)者,則需進一步進行FISH 試驗,FISH 試驗為Her-2 擴增陽性則判定為Her-2 陽性,相反則為陰性。Ki-67 以20%為界值[14],低于20%為低表達,高于20%為高表達。
1.5 統計學處理
使用SPSS 22.0 統計學軟件進行統計,符合正態分布的計量資料以±s表示,不符合正態分布的計量資量用中位數(四分位間距)表示。采用方差分析比較多組不同病變的組間差異。兩樣本方差齊性好時,兩組間比較采用獨立樣本t檢驗,不符合正態分布時,則采用非參數(Kruskal-Wallis)檢驗。計數資料間比較采用χ2檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 一般資料
一共有81 例患者81 個病灶納入研究,80 例為女性,僅1 例為男性乳腺癌。惡性病變組:56 例均為乳腺癌,病理類型包括:浸潤性乳腺癌非特殊類型32 例,浸潤性乳腺癌非特殊類型伴導管原位癌成分19例,導管原位癌2例,乳腺黏液性癌2 例,乳腺化生性癌1 例。良性病變組:25 例,病理類型包括:纖維腺瘤9例,腺病5例,導管內乳頭狀瘤4例,乳腺炎癥4例,良性葉狀腫瘤1 例,良性腺肌上皮瘤樣改變伴乳頭狀增生1 例,乳腺腺病瘤1 例。發病年齡從25~76 歲,惡性病變發病年齡(48.8±11.8)歲,良性病變發病年齡(37.9±10.1)歲。
2.2 乳腺良、惡性病變與正常腺體組織間的組間差異
惡性病變組56 例,均為乳腺癌,共測量40 例乳腺癌對側乳腺的正常腺體組織的APT 值作為正常對照組,其中16 例乳腺癌對側無可測量的正常腺體組織(如男性乳腺癌、對側僅為脂肪組織、對側圖像質量差等)。良性病變組25 例,共測量24 例對側乳腺的正常腺體組織作為對照(1 例對側腺體組織無法測量)。三組病變組間差異具有統計學意義(P<0.01)(表1)。
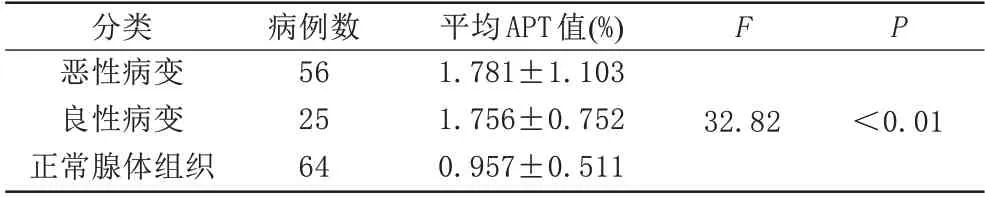
表1 不同乳腺良、惡性病變間APT值間的差異性
2.3 乳腺良、惡性病變與對側正常腺體組平均APT的比較
乳腺惡性病變組均為乳腺癌,乳腺癌平均APT值(1.781±1.103)%高于乳腺癌對側正常腺體組平均APT 值(0.868±0.565)%,兩者差異具有統計學意義(P<0.01) (圖1、表2)。乳腺良性病變平均APT 值(1.756±0.752)%高于其對側正常腺體組平均APT 值(1.101±0.372)%,兩者差異具有統計學意義(P<0.05) (圖2、表2)。乳腺癌平均APT 值(1.781±1.103)%與乳腺良性病變平均APT 值(1.756±0.752)%差異無統計學意義(P>0.05) (表2)。乳腺惡性、良性病變對側正常腺體組織平均APT值差異無統計學意義(P>0.05)(表2)。
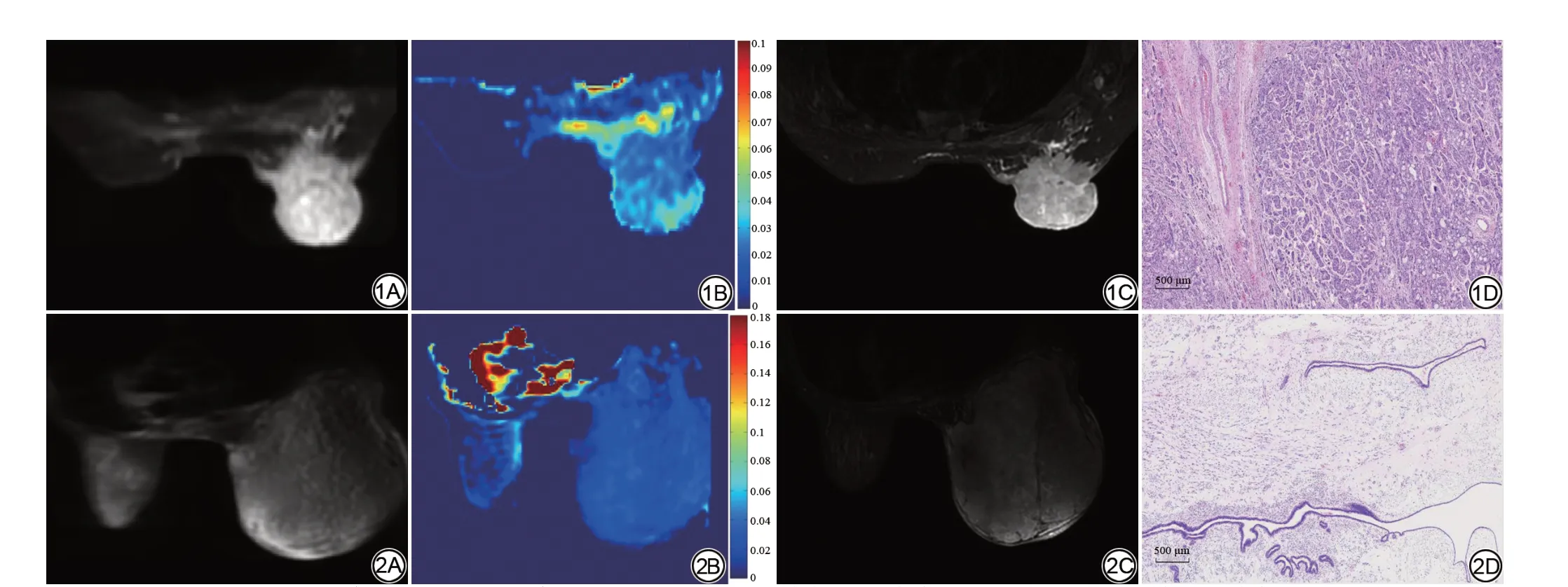
圖1 女,56歲,右側乳腺浸潤性癌,部分呈微乳頭狀癌形態。A為APT原始圖,病變呈不均勻高信號。B為APT偽彩圖像,右側病變APT值為3.477%。該病例對側無可測量的正常腺體組織。C為T2WⅠ圖像。D為H&E染色病理圖(×4) 圖2 女,45歲,右側乳腺良性葉狀腫瘤。A為APT原始圖。B為APT偽彩圖像,右側乳腺病變APT值為2.56%,對側正常腺體組織APT值為0.673%。C為T2WⅠ圖像。D為H&E染色病理圖(×4)
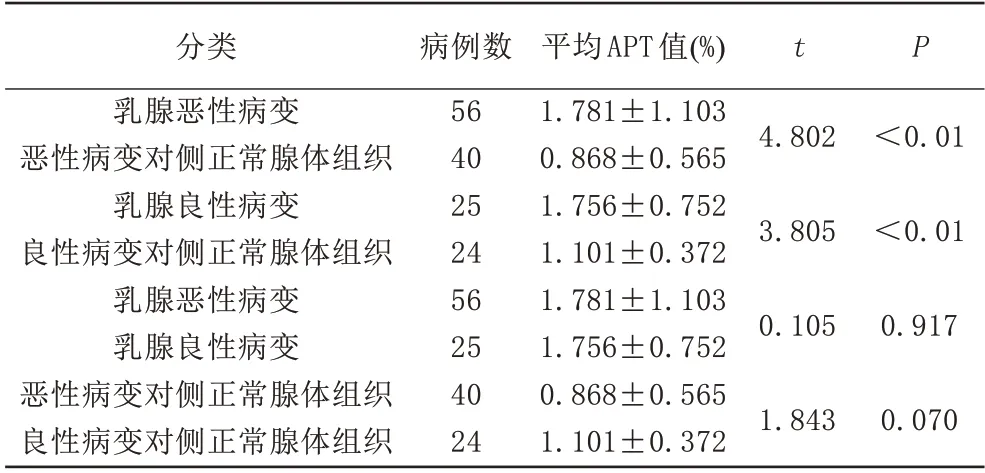
表2 不同乳腺良、惡性病變間APT值間的差異性
2.4 不同組別乳腺癌的APT值的比較
APT 值在乳腺癌淋巴結轉移組/無轉移組、ER 陽性組/陰性組、PR 陽性組/陰性組、Her-2 陽性組/陰性組,差異均無統計學意義(P>0.05) (表3)。Ki-67 高表達與低表達組間的APT值差異有統計學意義(P<0.05)。
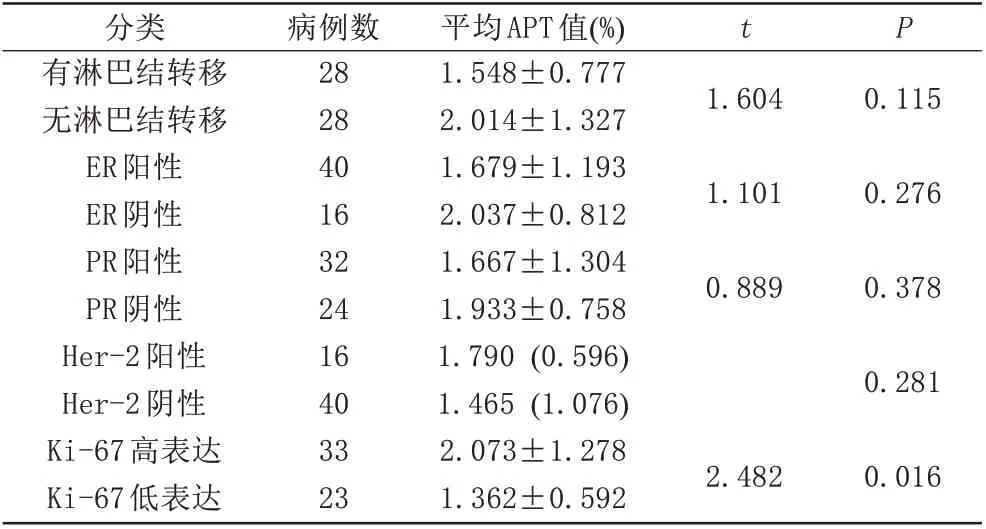
表3 不同組別乳腺癌的APT值比較
56例乳腺癌中有浸潤程度分級的為47例浸潤性乳腺癌,其中Ⅰ級5 例,Ⅱ級18 例,Ⅲ級24 例。因為Ⅰ級病例較少,乳腺癌浸潤程度Ⅰ級與Ⅱ級分為同一組,其APT 值1.163(0.833)%較Ⅲ級病例的APT 值1.675 (0.887)%更低,差異有統計學意義(P<0.05)。
3 討論
APT是一種從細胞分子水平探測體內蛋白質、多肽濃度及酸堿度的成像序列,檢測來自內源性分子的化學交換飽和轉移對比度[15],可反映細胞內胞質中游離蛋白質及多肽質子與水中氫質子交換速率的變化[16],推斷內環境酸堿度及蛋白質和多肽的濃度。國內外對APT 成像在乳腺組織中的應用報道較少,現相關研究處于起步階段。本研究對APT 成像在乳腺組織的臨床應用進行了相關研究,初步探索了該成像技術在乳腺疾病中的應用價值。
3.1 乳腺良性、惡性病變與對側正常腺體組織的APT 值間的差異
本研究中的乳腺癌APT 值及乳腺良性病變APT 值均高于對側正常腺體組織。乳腺癌癌組織分裂增殖較為旺盛,腫瘤細胞聚集區的蛋白質或多肽的含量明顯增加,細胞內蛋白質和(或)多肽的酰胺質子與自由水質子進行能量交換[8],存在相對明顯化學交換飽和轉移效應,而正常組織的此處效應不明顯,證明乳腺癌細胞的氨基質子交換率與正常組織細胞存在不同,因此乳腺癌細胞的APT 信號強度與正常組織存在區別[8]。乳腺良性疾病細胞聚集較密集、豐富,氨基質子交換率高于正常腺體組織,證實了乳腺癌、乳腺良性病變細胞的酰胺質子交換率高于正常組織。
3.2 乳腺良性、惡性病變間APT值的比較
有研究[17]利用APT 成像的參數非對稱性磁化轉移率(magnetization transfer ratio asymmetry,MTRasym)鑒別乳腺良、惡性病變,乳腺良性組MTRasym 為(5.16±1.09)%大于乳腺惡性組的(4.41±0.64)% (P<0.01),其AUC 值為0.729。而本研究中乳腺惡性、良性病變APT 值差異不存在顯著的統計學意義,提示APT 在乳腺良、惡性病變鑒別上意義有限,可能與本研究中乳腺良性病變較少,且病理類型多樣化有關;可能存在良性病變的細胞密度大、細胞蛋白質/多肽含量豐富,與惡性病變間酰胺質子交換率差異性不顯著,今后擬采集更多的數據進行深入研究。
3.3 不同亞組乳腺癌間APT值的比較
本研究中Ki-67高表達組/低表達組的乳腺癌APT值差異有統計學意義,細胞增殖指數Ki-67為高表達的乳腺癌APT值較Ki-67低表達的乳腺癌APT值高,提示細胞增殖活躍的乳腺癌其酰胺質子交換率大。乳腺癌浸潤程度Ⅰ級與Ⅱ級的APT值1.163 (0.833)%較Ⅲ級病例的APT 值1.675 (0.887)%更低,提示乳腺癌浸潤程度高的乳腺癌其組織分裂增殖較為旺盛,腫瘤細胞聚集區的蛋白質或多肽的含量明顯增加,酰胺質子交換率較浸潤級別低的乳腺癌更大,其細胞內蛋白質濃度的變化情況更明顯。有研究[18]肝癌的APT成像中術前APT信號強度與肝癌的組織學分級具有正相關性(r=0.679,P<0.001)。APT顯像用于評估宮頸鱗狀細胞癌的組織學分級[19],發現APT的信號強度與宮頸鱗狀細胞癌分級呈正相關。有研究[20]表明,低級別膠質瘤到高級別膠質瘤,其APT 信號強化逐漸增加,APT信號強化與Ki-67、細胞密度呈正相關。這些研究[18-20]與我們的研究結果相類似,提示APT 成像可能是一種預測腫瘤組織學分級和細胞增殖程度的新的研究方法。
3.4 本研究的不足之處
本文的不足之處:(1)掃描應用2D 的APT 序列,僅獲得病變最大層面的圖像,部分病灶因為病灶較小,而無法正確選擇掃描圖層,或者掃描后無法辨認較小的病灶。(2)因掃描總的病例較少,檢查的總體樣本量不足,良性病例數較少,且病理類型多樣化,今后擬擴大樣本量繼續研究。
綜上所述,APT序列作為分子影像學領域的一種新的成像方式,在乳腺良、惡性病變較正常組織有更高的APT 效應,證實了利用APT 評估乳腺病變的可行性。并且,初步的研究顯示APT 與乳腺癌的預后指標細胞增殖指數Ki-67 的高低及浸潤程度有關,提示APT成像可潛在用于預測乳腺癌的預后。
作者利益沖突聲明:全部作者均聲明無利益沖突。
致謝:感謝GE 公司磁共振科研團隊錢龍博士提供的技術支持。

