炎癥微環境作用下BMPs-ERK5 信號通路對牙周膜干細胞成骨分化的影響
雷曉旭 王春 趙曦
牙周膜干細胞(Periodontal ligament stem cells,PDLSCs)是牙周組織再生修復的重要種子細胞[1]。相關研究表明,牙周組織再生修復能力在慢性牙周炎的侵襲作用下可明顯降低。目前,修復牙周炎導致的牙周組織損傷的研究主要圍繞如何促進牙槽骨再生[2]。骨形態發生蛋白(Bone morphogenetic proteins,BMPs)對干細胞成骨分化具有誘導作用,其較為突出的亞型主要是BMP2、BMP7 和BMP9。李靜等[3]的研究顯示,BMP2、BMP7 和BMP9 的表達可介導永生化成牙本質細胞(Immortalized odontoblasts,iODs)成骨分化。與BMP7 比,BMP2 和BMP9 介導iOD 的成骨分化作用更強。進一步的研究表明,BMPs 誘導干細胞成骨分化的機制與激活絲裂原活化蛋白激酶(Mitogen-actibated protein kinases,MAPKs)通路相關[4],MAPKs 中的細胞外信號調節激酶5(Extracellular signal-regulated kinase 5,ERK5)在血管生成和細胞分化方面均具有一定的作用[5]。Tsioumpekou 等[6]研究證實,ERK5 影響基因表達的機制在于被激活的ERK5 可介導BMPs 的釋放和/或活化,即形成BMPs-ERK5 信號通路。在炎癥微環境作用下,原代人牙周膜干細胞(Human periodontal ligament stem cells,hPDLSCs)的骨分化能力降低,牙周組織再生修復能力降低,BMPs-ERK5信號通路是否參與這個病理過程,目前鮮有研究報道。本文旨在探討炎癥微環境作用下BMPs-ERK5信號通路對hPDLSCs 成骨分化的影響,為牙槽骨再生的研究提供參考。
1 材料和方法
1.1 材料
離體牙樣本源自因治療需要拔除的健康以及慢性牙周炎的病例樣本。于慢性牙周炎患者獲取炎癥牙周膜組織,于因正畸需要拔除健康牙的患者獲取正常牙周膜組織。采用Armitage 推薦的慢性牙周炎診斷標準[7]。納入標準:①X 線片顯示牙槽骨吸收超過2/3;②沒有吸煙史;③近6 個月沒有服用特殊藥物;④所有組織樣本均來源于本院口腔科;⑤所有患者已簽署知情同意書。本實驗已經醫院倫理委員會審批通過。
腺病毒載體Ad-BMP2、Ad-BMP7、Ad-BMP9、綠色熒光蛋白腺病毒載體(Ad-green fluorescent protein,Ad-GFP)均購自美國芝加哥大學分子腫瘤研究室;p-ERK5 抗體(CST 公司,美國);BMPs-ERK5 信號通路特異性抑制劑BIXO2189(Selleck 公司,美國);Ⅰ型膠原酶、維生素C、β-磷酸甘油(Sigma 公司,美國);DMEM/F12 培養基(HyClone公司,美國);角蛋白抗體、波形蛋白抗體和熒光兔二抗(北京中杉金橋生物技術有限公司);胎牛血清(Gibco 公司,美國);堿性磷酸酶(Alkaline phosphorylase,ALP)活性檢測試劑盒、ALP 顯色試劑盒、Western blot 試劑盒、BCA 蛋白濃度測定試劑盒(上海碧云天生物技術有限公司);茜素紅染液(Solarbio 公司,美國);qRT-PCR 試劑盒(天根生化科技有限公司)。
1.2 分離、培養hPDLSCs
準備已預冷并含有雙抗的DMEM/F12 培養基,將上述牙齒拔除后立即放入其中,確認牙周膜組織附著完整后立即轉入實驗室生物安全柜中,使用2×的生理鹽水對牙根進行反復沖洗,手術刀刮取根中1/3 牙周膜組織置于1.5 mL 的離心管中,并加入1 mL Ⅰ型膠原酶,37 ℃水浴30 min,每隔5 min 振蕩1 次。加入1 mL 含10%FBS 的DMEM/F12 培養液,1 200 r/min 離心,棄上清,處理后的樣本移入鋪有一層血清的細胞培養瓶中,加入3 mL DMEM/F12完全培養液并倒置存放,置于37 ℃、5%CO2的培養箱中,第2 天翻轉正置繼續培養,待細胞爬出組織塊,72 h 更換一次培養液,細胞融合達80%~90%時進行消化傳代。
1.3 應用細胞免疫熒光染色鑒定hPDLSCs
于24 孔板內接種第3 代hPDLSCs,當細胞達到80%融合時以PBS 清洗,5 min/次,清洗3 次,在培養箱中培養15 min(0.1% TRriton-100),1%BSA 封閉5 h,滴加抗波形蛋白,4 ℃孵育12 h,PBS 清洗后加入兔二抗,37 ℃孵育60 min,使用DIPA 染核5 min,純凈水終止,抗粹滅劑封片,激光共聚焦顯微鏡下觀察。
1.4 細胞克隆形成
取第3 代hPDLSCs 消化,將400 個細胞接種于培養皿中,置于培養箱中培養,1 個克隆形成單位以50 個細胞為準,觀察細胞的生長情況,10~14 d 后取出培養皿,4%多聚甲醛固定30 min,漂洗3 次,染色30 min,PBS 漂洗終止,倒置顯微鏡下拍照并觀察。
1.5 ALP 染色及ALP 活性檢測
將Ad-GFP、Ad-BMP2、Ad-BMP7 和Ad-BMP9蛋白分別轉染hPDLSCs:取第四代hPDLSCs 接種于24 孔板。將Ad-GFP、Ad-BMP2、Ad-BMP7、Ad-BMP9 分別加入貼壁生長的細胞中,設為Ad-GFP組、Ad-BMP2 組、Ad-BMP7 組、Ad-BMP9 組。熒光轉染率約為50%,8 h 后換液并培養5~7 d,PBS沖洗。
ALP 染色:采用4%多聚甲醛固定30 min,PBS染色,將250 μL BCIP/NBT 染色工作液加入到孔板中,室溫孵育30 min,ddH2O 洗滌、吸棄染液2 次并終止反應,倒置顯微鏡觀察各組ALP 染色情況。ALP 活性檢測:每孔分別加入200 μL 0.2% Triton X-100裂解細胞,于1.5 mL EP 管中置入刮取裂解物,1 200 r/min 離心3 min,取上清液,嚴格按照說明書操作,根據標準曲線與作用時間計算樣本ALP活性值,檢測ALP 活性。每組設6 復孔,3 復孔用以ALP 染色,3 復孔用以檢測ALP 活性。
將活性最高的BMPx 作為研究對象,按以上方法轉染第五代hPDLSCs,并做不同處理。設置5 組:空白組、Ad-GFP 組、Ad-BMPx 組、Ad-BMPx +2.5 μmol/L BIX02189 組及Ad-BMPx +10 μmol/L BIX02189 組,每組設3 復孔。細胞貼壁后,Ad-GFP組加入適量Ad-GFP,Ad-BMPx 組、Ad-BMPx +2.5 μmol/L BIX02189 組及Ad-BMPx +10 μmol/L BIX02189 組加入適量Ad-BMP9,空白組加適量PBS,8 h 后換液,Ad-BMPx+2.5 μmol/L BIX02189組及Ad-BMPx+10 μmol/L BIX02189 組分別加入2.5 μmol/L 和10 μmol/L BIX02189。7 d 后行ALP染色,鏡下觀察各組ALP 染色情況。
1.6 茜素紅染色
分為Ad-GFP 組、Ad-BMP2 組、Ad-BMP7 組、Ad-BMP9 組與空白組、Ad-GFP 組、Ad-BMPx 組、Ad-BMPx +2.5 μmol/L BIX02189 組、Ad-BMPx +10 μmol/L BIX02189 組。當熒光感染率達到30%后8 h 換液(50 mg/L 維生素C+10 mmol/L β-磷酸甘油),21 d 后PBS 沖洗,采用4%多聚甲醛固定30 min,PBS 沖洗,將0.2%茜素紅染色液200 μL 加入到每個孔板中,室溫孵育60 min,ddH2O 洗滌3 次并使顯色反應終止,倒置顯微鏡觀察各組成骨晚期分化指標鈣鹽沉積情況。
1.7 qRT-PCR
分為Ad-GFP 組、Ad-BMP2 組、Ad-BMP7 組、Ad-BMP9 組。培養7 d 后使用PBS 沖洗,使用微量核酸蛋白檢測儀檢測分離的細胞總RNA 純度和濃度。遵循試劑盒的操作說明書,使用Bio-rad CFX實時熒光定量PCR 儀檢測成骨分化相關基因OCN、OPN 的mRNA 表達,成骨分化相關基因的相對表達量通過內參β-actin 與Bio-rad CFX Manager 軟件進行參照分析(表1)。
分為空白組、Ad -GFP 組、Ad -BMPx 組、Ad-BMPx+2.5 μmol/L BIX02189 組、Ad-BMPx +10 μmol/L BIX02189 組。采用qRT-PCR 檢測成骨分化相關基因OCN、OPN、OSX、RUNX2 的mRNA 表達。(表1)
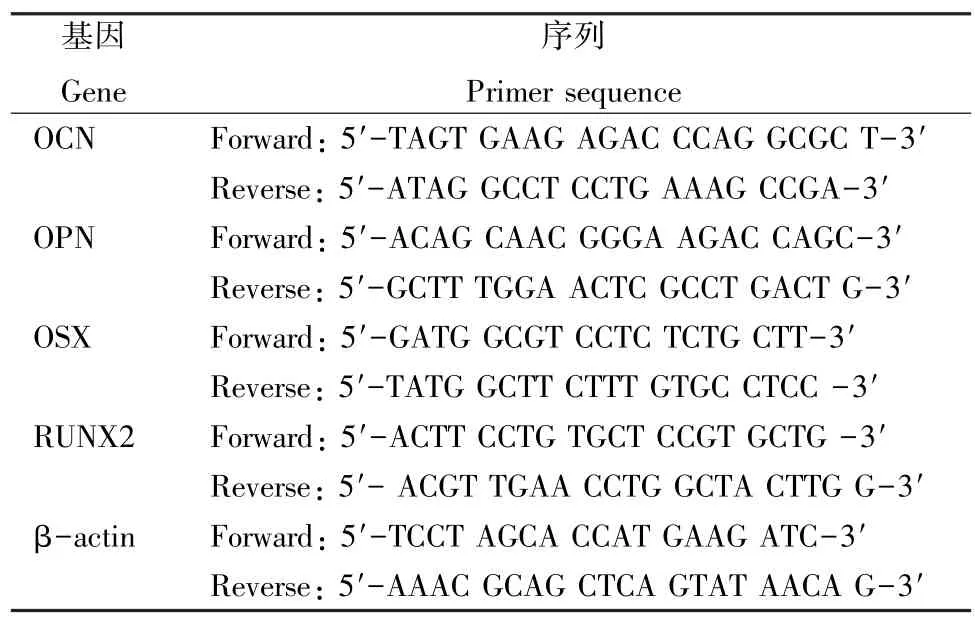
表1 引物序列Table 1 Primer sequence
1.8 Western blot 檢測
分為空白組、Ad -GFP 組、Ad -BMPx 組、Ad-BMPx+2.5 μmol/L BIX02189 組、Ad-BMPx +10 μmol/L BIX02189 組。培養24 h 后提取總蛋白并進行蛋白濃度測定。電泳分離、封閉、轉膜,加入p-ERK5 一抗(1 ∶1 000)及β-actin 一抗(1 ∶5 000),4 ℃孵育12 h,加入HRP 標記的二抗(1 ∶5 000),應用ECL 化學發光法顯色。
1.9 統計學分析
通過EPidata 3.1 軟件雙人錄入收集的研究資料,SPSS 25.0 統計軟件進行數據分析,計數資料以ˉx±s表示,組間比較采用t檢驗,P<0.05 表示差異具有統計學意義。
2 結果
2.1 鑒定和培養hPDLSCs
光學顯微鏡下可見牙周膜組織應用組織塊酶分解后呈長梭狀的纖維細胞,漩渦狀增殖為傳代后表現。細胞熒光染色法顯示波形蛋白呈陽性,角蛋白表達呈陰性,說明培養的hPDLSCs 來源于中胚層間充質細胞,而非來源于上皮細胞。鏡下顯示生長2 周的hPDLSCs 形成克隆,密度較大,呈圓形(圖1)。
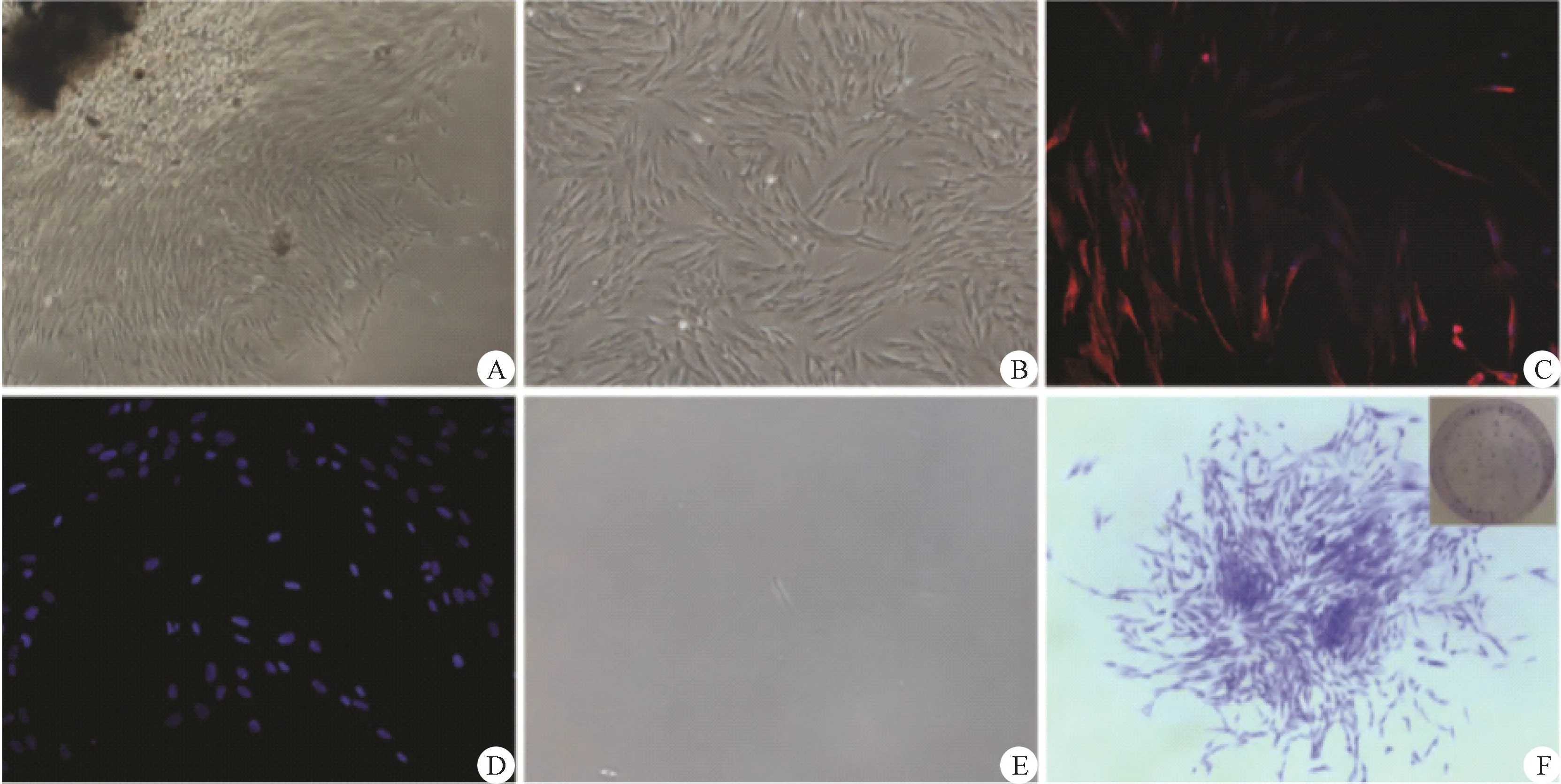
圖1 鑒定和培養hPDLSCsFig.1 Identification and culture of hPDLSCs
2.2 BMPs 促進hPDLSCs 細胞成骨分化
ALP 染色和活性檢測顯示,與Ad-GFP 組比,Ad-BMP2、Ad-BMP7、Ad-BMP9 三組的ALP 表達顯著增加(P<0.05),Ad-BMP9 組早期成骨ALP 的表達最高,其次為Ad-BMP2 和Ad-BMP7(圖2A、2B)。
qRT-PCR 結果顯示,與Ad-GFP 組比,Ad-BMP2、Ad-BMP7、Ad-BMP9 三組的細胞成骨分化相關基因OCN 和OPN mRNA 均顯著增加(P<0.05),Ad-BMP9 組的OCN 和OPN mRNA 最高,其次為Ad-BMP2 和Ad-BMP7(圖2C)。
茜素紅染色結果顯示,與Ad-GFP 組比,Ad-BMP2、Ad-BMP7、Ad-BMP9 三組的鈣鹽結節沉積顯著增加,Ad-BMP9 組晚期成骨誘導最強,其次為Ad-BMP2 和Ad-BMP7(圖2D)。
以上結果表明,相對于Ad-BMP2、Ad-BMP7,Ad-BMP9 具有較強的促hPDLSCs 成骨分化作用。因此,將Ad-BMP9 用于后續實驗,研究BMPs-ERK5 信號通路與hPDLSCs 細胞成骨分化的關系。
2.3 ERK5 信號通路參與BMP9 誘導hPDLSCs 成骨分化
Western-blot 檢測顯示(圖3),與空白組及Ad-GFP 組比,Ad-BMP9 組的ERK5 磷酸化(p-ERK5)表達顯著增加(P<0.05);與Ad-BMP9 組比,Ad-BMP9 +2.5 μmol/L BIX02189 組和Ad-BMP9+10 μmol/L BIX02189 組的p-ERK5 表達顯著 降 低(P<0.05);與Ad -BMP9 +2.5 μmol/L BIX02189 組比,Ad-BMP9+10 μmol/L BIX02189 組的p-ERK5 表達顯著降低(P<0.05)。
ALP 染色和活性檢測顯示(圖4A、4B),與空白組及Ad-GFP 組比,Ad-BMP9 組的ALP 表達顯著增加(P<0.05),與Ad-BMP9 組比,Ad-BMP9 +2.5 μmol/L BIX02189 組 和Ad-BMP9 +10 μmol/L BIX02189 組的ALP 表達顯著降低(P<0.05),與Ad-BMP9 +2.5 μmol/L BIX02189 組 比,Ad-BMP9 +10 μmol/L BIX02189 組的表達顯著降低(P<0.05)。
qRT-PCR 檢測顯示(圖4C),與空白組及Ad-GFP 組比,Ad-BMP9 組的成骨分化相關基因OCN、OPN、OSX、RUNX2 mRNA 表達顯著增加(P<0.05),與Ad -BMP9 組 比,Ad -BMP9 +2.5 μmol/L BIX02189 組和Ad-BMP9+10 μmol/L BIX02189 組的OCN、OPN、OSX、RUNX2 mRNA 表達顯著降低(P<0.05),與Ad-BMP9+2.5 μmol/L BIX02189 組比,Ad-BMP9 +10 μmol/L BIX02189 組的OCN、OPN、OSX、RUNX2 mRNA 表達顯著降低(P<0.05)。茜素紅染色結果顯示(圖4D),與空白組及Ad-GFP組比,Ad-BMP9 組的鈣鹽結節沉積顯著增加,與Ad -BMP9 組 比,Ad -BMP9 +2.5 μmol/LBIX02189 組和Ad-BMP9+10 μmol/L BIX02189 組的鈣鹽結節顯著降低,與Ad-BMP9 +2.5 μmol/L BIX02189 組比,Ad-BMP9+10 μmol/L BIX02189 組的鈣鹽結節顯著降低。
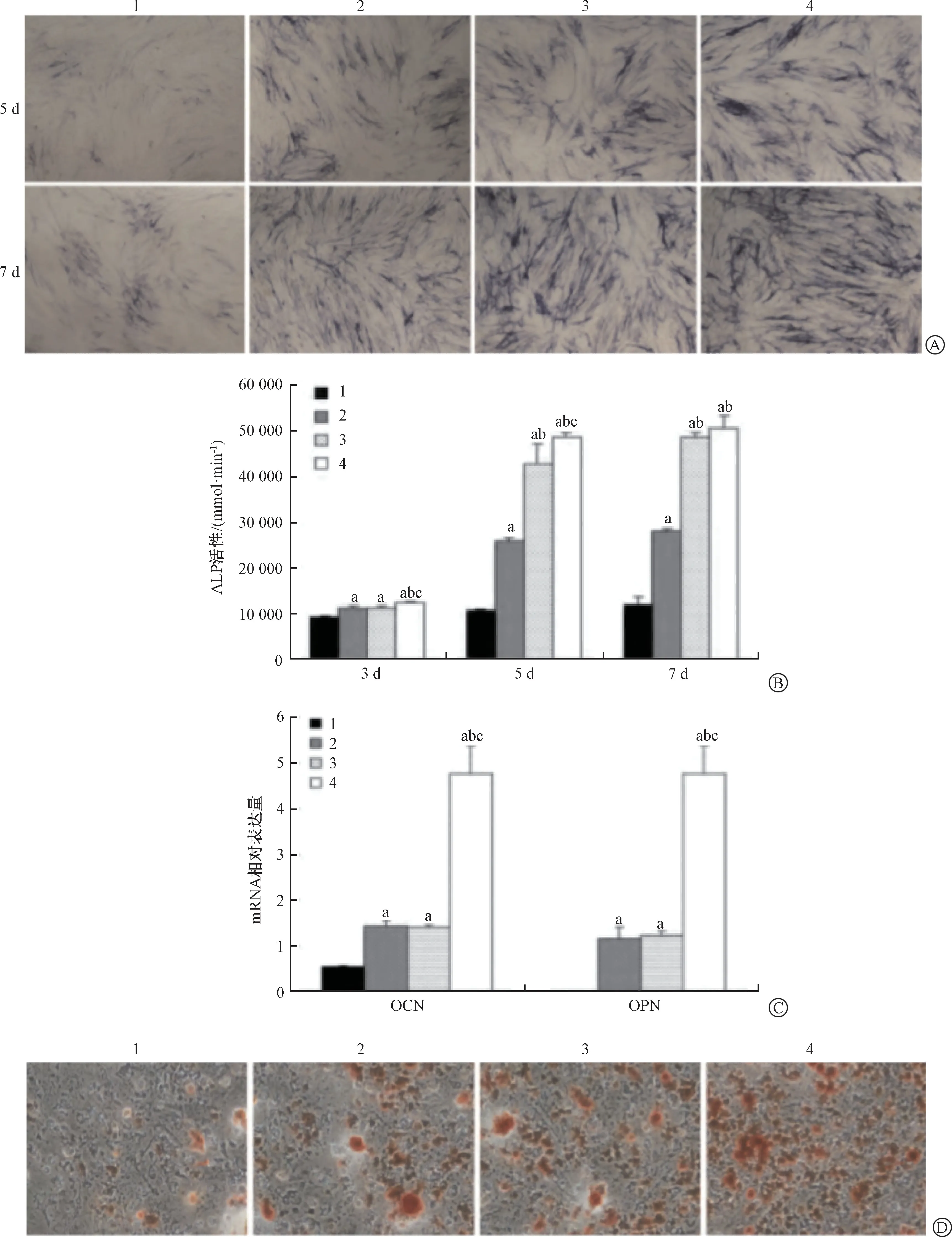
圖2 BMPs 促進hPDLSCs 細胞成骨分化Fig.2 BMPs promoted osteogenic differentiation of HPDLSCs cells
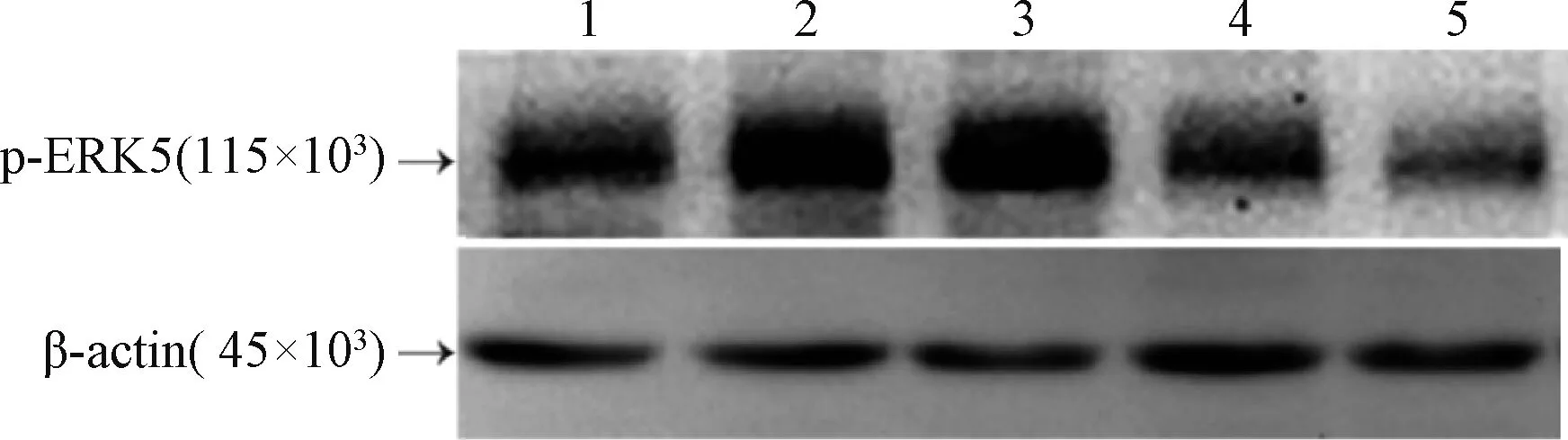
圖3 Western-blot 檢測各組細胞p-ERK5 蛋白表達Fig.3 The expression of p-ERK5 protein in each group detected by Western-blot
以上結果表明,ERK5 信號通路未被抑制時,Ad-BMP9具有較強的促hPDLSCs 成骨分化作用,當ERK5 信號通路被特異性抑制時,Ad-BMP9 的促hPDLSCs 成骨分化作用也被抑制,提示ERK5 信號通路可調節BMP9 誘導的hPDLSCs 細胞的成骨分化作用。
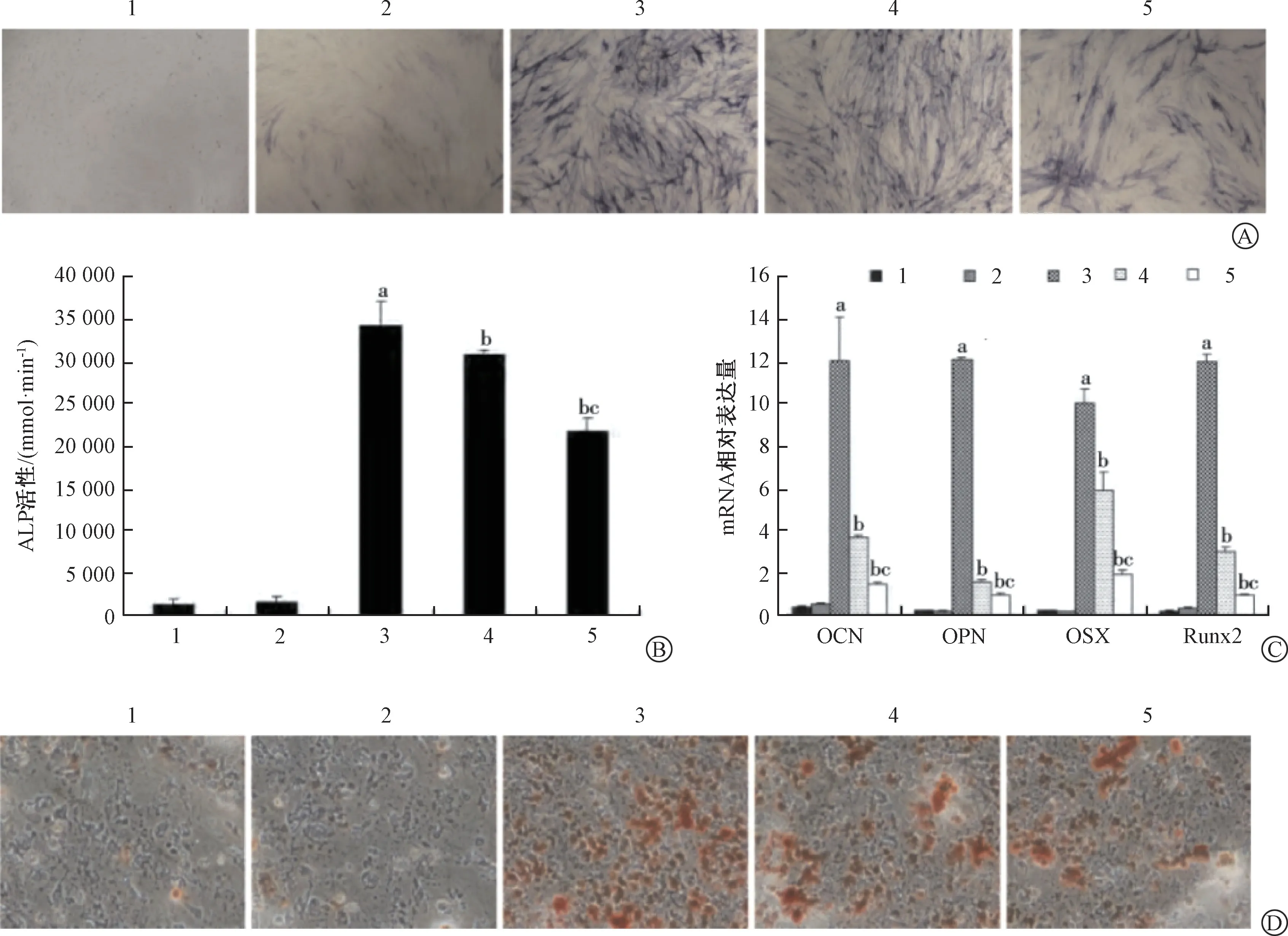
圖4 ERK5 信號通路參與BMP9 誘導的hPDLSCs 成骨分化Fig.4 ERK5 signaling pathway involved in regulating BMP9-induced osteogenic differentiation of hPDLSCs
3 討論
包括牙槽骨、牙骨質和牙周膜的牙周支持組織完全再生是治療牙周病的理想結果[8]。作為治療牙周疾病的新方法,組織工程技術具有巨大潛力,而其中發揮主要作用的就是種子細胞[9]。一般來說,當維持牙周生理性動態平衡的牙槽骨出現失衡時,就會伴隨著病理性過程的發生,間充質干細胞則是參與維持上述動態平衡的細胞[10]。相關研究表明,干細胞的各項功能受到嚴密的分子調控[11]。從干細胞到成骨細胞分化過程中,多種細胞因子、生長因子信號可參與其中,如目前已被證實的GFF、Wnt、BMP 和PI3K/Akt 等,這些信號通路通過影響成骨細胞相關的關鍵轉錄因子參與其中[12]。BMPs 信號通路通過Smad 途徑調控靶基因的轉錄表達,MAPKs 信號途徑則是刺激信號從細胞表面到核內的重要傳遞者[13]。ERK5,屬于絲氨酸蛋白激酶,磷酸化激活后由胞漿釋放到胞核,增強其轉錄活性,通過與轉錄因子MEF 結合,進而調控細胞抗凋亡、分化和血管生成等的生物學行為[14]。
相關研究表明,MERK1/ERK1 和MERK2/ERK2分別對骨生長起到正向和負向調節的作用,但目前BMPs-ERK5 信號通路對hPDLSCs 成骨分化的影響尚不清楚[15]。本研究通過組織塊酶消化法分離獲得hPDLSCs,通過腺病毒載體介導及轉染的方式,使hPDLSCs 高表達BMP9、BMP2 及BMP7 蛋白,對比3種BMPs 對hPDLSCs 成骨分化的作用效果。進一步,將對hPDLSCs 成骨分化影響最強的BMPs 再次轉染hPDLSCs,檢測其p-ERK5 水平,并加入BMPs-ERK5信號通路特異性抑制劑BIXO2189 預處理后,考察對hPDLSCs 成骨分化的影響。早期成骨分化、成骨分化相關基因及晚期成骨分化指標均顯示,Ad-BMP2、Ad-BMP7 及Ad-BMP9具有較強的hPDLSCs 成骨分化作用,Ad-BMP9促進hPDLSCs 成骨分化的作用最強。進一步,在ERK5 信號通路特異性抑制劑BIX02189干擾下,ERK5 表達降低,Ad-BMP9 的hPDLSCs 成骨分化作用也被抑制,且呈BIX02189 劑量依賴性的趨勢,提示ERK5 信號通路可調節BMP9 誘導的hPDLSCs 細胞的成骨分化作用,類似文獻也顯示,BMP9 的成骨分化誘導過程由ERK5 信號通路參與介導[16-17]。
綜上所述,在慢性炎癥微環境下,BMP9 具有可誘導hPDLSCs 成骨分化的作用,ERK5 信號通路可調節BMP9 誘導的hPDLSCs 的成骨分化作用。

