納氏試劑比色法測定水中氨氮含量適宜條件研究
王 醒
(江蘇華夏檢驗股份有限公司,江蘇 張家港 215634 )
1 引言
目前,生態環境的水體污染情況已受到社會各界的廣泛關注,水體的含氮化合物(NH3-N、NO3-N、NO2-N)的濃度標準[2]是評價水環境質量的重要指標之一,準確測定含氮化合物的含量對掌握水生態系統的所受污染程度及推測水體自凈能力有重要意義。
水體中氨氮的常用分析手段有:納氏試劑法[3],中和-滴定法[4]和水楊酸鹽分光光度法[5]。由于納氏試劑法操作簡單、試劑靈敏度高、測試條件易達到,是大多數環境檢測/監控部門常用的方法。但在實際檢測操作過程中,待測液 pH值、靜置顯色時間、環境溫度的偏差,都會影響納氏試劑比色法檢測結果的準確性。因此,本文結合實際工作經驗,通過相關因素實驗,找出納氏試劑比色法測定氨氮含量的最佳條件,為水環境質量監測提供科學的參考依據。
2 實驗部分
2.1 主要儀器和試劑
儀器:可見分光光度計(N2S);電子天平(AL204);pH計(FE20型);純水機(Smart-S15)。
試劑:氨氮標準溶液(有證標準物質,稀釋至10 mg/L);納氏試劑(氯化汞-碘化鉀-氫氧化鉀); 超純水(無氨水)[6]。
2.2 試劑配制
0.5 g/mL酒石酸鉀鈉配制:準確稱取67.14 g KNaC4H4O6· 4H2O(AR)溶于適量超純水中,加熱煮沸冷卻后轉移至100 mL容量瓶中定容。
磷酸鹽體系緩沖液配制: KH2PO4,Na2HPO4·12H2O(AR)配置成pH值為5~10的緩沖溶液。
2% H3BO3吸收液配制:2 gH3BO3(AR)溶于100 mL超純水中。
0.01 mol/L H2SO4吸收液配制:移液槍移取543 μL的濃H2SO4(AR)溶液,超純水稀釋至1000 mL。
2.3 納氏試劑法測定氨氮的原理
水中游離狀態的NH3或NH4-等形式存在的含氮化合物與納氏試劑反應,在適宜的pH值、溫度、靜置顯色時間下,生成淺紅棕色絡合物,于420 nm處測定其吸光度。絡合物的吸光度(A)與含氮化合物濃度成正比。
2.4 標準溶液與標準曲線測定[2]
移液槍準確移取10 mg/L氨氮標準液0、0.50、1.00、2.00、4.00、6.00、8.00、10.00 mL,加入1.00 mL KNaC4H4O6溶液,1.5 mL納氏試劑,超純水定容至50 mL,混合均勻,編號1~8標準溶液,靜置10 min,于420 nm處測定吸光度,超純水為空白樣。水樣中實測吸光度與空白樣品之差,從校正標準曲線上查得氨氮質量(mg),氨氮含量計算公式:
(1)
式(1)中:m為校正標準曲線上的氨氮化合物含量,mg;V為測試水樣體積, mL。
通過不同濃度的氨氮標準液對應的吸光度校正擬合曲線,見圖1。擬合方程
Abs=-0.0012+5.23174m,R2=0.99996。
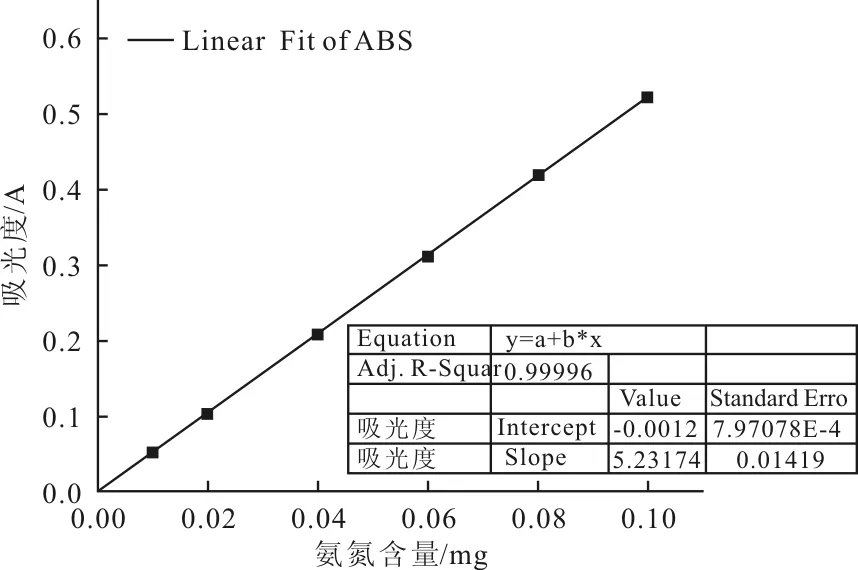
圖1 氨氮含量校正擬合曲線
2.5 實驗方法
2.5.1 pH值
移取適量10 mg/L氨氮標準液,通過磷酸鹽緩沖體系調節溶液體系pH值(5,6,7,8,9,10),每pH值取兩組(取10 mg/L標準溶液5 mL,10 mL)進行對比實驗。步驟同2.4,在相應的pH值下靜置10 min。420 nm處測吸光度,以水為空白,計算得到校正吸光度。
2.5.2 反應時間
移取適量10 mg/L氨氮標準液,調pH值至8,每反應時間取兩組(取10 mg/L標準溶液5 mL,10 mL)進行對比實驗。步驟同2.4,靜置反應時間:5 min、10 min、20 min、25 min、40 min、420 nm處測吸光度,以水為空白,計算得到校正吸光度。
2.5.3 溫度
移取適量10 mg/L氨氮標準液,調pH值至8,通過恒溫水浴調整待測溶液體系的溫度:15 ℃,20 ℃,25 ℃,30 ℃,每溫度區間取兩組(取10 mg/L標準溶液5 mL,10 mL)進行對比實驗。步驟同2.4,在相應反應溫度下,靜置10 min,以水為空白測吸光度,計算得到校正吸光度。
2.5.4 盲樣測試
按照標準方法HJ 535-2009標準步驟6.2對盲樣進行前處理。
3 結果與分析
3.1 pH值對氨氮測試值影響
納氏試劑法測定氨氮時,OH-濃度會影響絡合反應平衡,酸性條件下不利于樣品顯色,吸光度與真實值偏差較大。
由實驗結果可以看出吸光度隨pH值增加而升高,當體系達到弱堿性時(pH值≈8),吸光度達到最大值,此時測試結果趨近與樣品氨氮含量的真實值。若測試樣品呈酸性(pH<7),絡合物生成量受到抑制,吸光度偏小;當pH值繼續增加,pH值>9時,待測液變渾濁,吸光度增大,偏離真實值。因此最佳pH值條件應控制在8左右。不同氨氮含量標準樣品在不同pH值條件下的吸光度,如圖2。
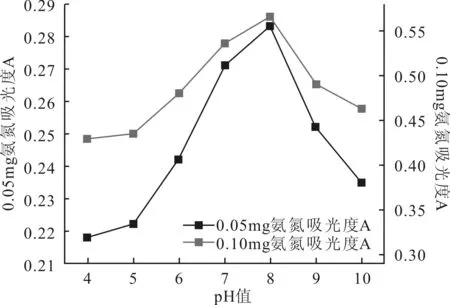
圖2 標準樣品在不同pH值條件下的吸光度
3.2 反應時間對氨氮測試值影響
樣品靜置反應時間會影響顯色效果,進而影響樣品中氨氮的吸光度。在pH=8時,由顯色時間與吸光度間的關系可知,隨靜置時間延長,樣品的吸光度逐步增大,10 min后逐漸穩定。25 min后顯色體系顏色變深,35 min后顏色開始變淺。故顯色時間控制在10~20 min左右最佳,此時間段測定的吸光度與真實值較為接近,不同靜置反應時間所對應的吸光度,如圖3。

圖3 不同靜置反應時間所對應的吸光度
3.3 溫度對氨氮測試值影響
樣品在加入納氏試劑進行顯色反應,體系所處環境溫度會影響絡合物生成速率,進而影響溶液最終顏色。在pH=8,靜置反應時間為10 min的條件下,反應溫度為15 ℃時,吸光度偏低,體系中游離NH3與納氏試劑反應不完全,隨著體系反應溫度升高,吸光度逐漸增加,溫度達到25 ℃時,測定吸光度趨近與真實值,顯色基本完全。溫度高于25 ℃后,吸光度再次降低。所以最佳顯色溫度應控制在25 ℃,反應溫度與吸光度的關系見圖4。
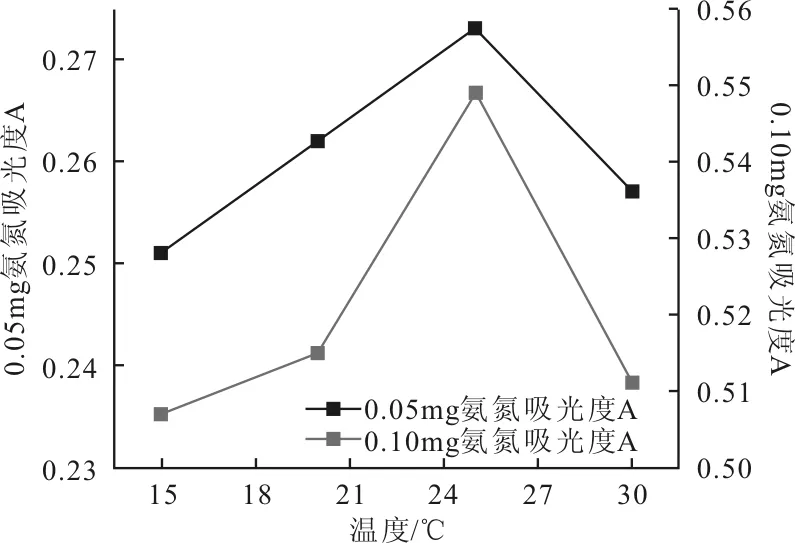
圖4 反應溫度與吸光度的關系曲線
3.4 盲樣測定
依據步驟2.5.4處理好盲樣,調節pH值為8左右,反應溫度為25 ℃,靜置反應時間10 min,以超純水做空白進行測試。氨氮含量見表1,測試值誤差在規定范圍內,該測量過程可信。

表1 待測標準樣氨氮含量
4 結論
本文采用納氏分光光度法測定水體中氨氮污染物的含量,通過配制相關標準溶液,對相關數據進行校正擬合,得到氨氮含量-吸光度線性方程:Abs=-0.0012+5.23174m,R2=0.99996。
針對納氏法測定水中氨氮含量的實驗條件進行比對,考察了不同pH值、靜置顯色時間、反應溫度對氨氮絡合物吸光度的影響,結果表明:測試樣品pH值調整至8左右,反應時間10 min,體系溫度25 ℃為納氏法最佳反應條件。在此條件下測試標準品水樣,其相對誤差≤2%,精密度<5%,符合相關標準規定,該測試方法可信。

