高三尖杉酯堿激活ATM/p53通路抑制人肝癌細胞PLC5增殖
杜玉梅,唐加峰,黃世瑩,張 滔,,盧睿瑾,何 爽,徐 航,,李 靜,冉建華,陳地龍
(重慶醫科大學1.公共衛生與管理學院;2.基礎醫學院干細胞與組織工程研究室,重慶 400016;3.重慶三峽醫藥高等專科學校,重慶 404120;4.重慶醫科大學基礎醫學院神經科學研究中心,重慶 400016)
肝細胞肝癌(hepatocellular carcinoma,HCC)是臨床上最常見的惡性腫瘤之一,具有惡性程度高、死亡率高、預后差等特點[1]。近年來,肝細胞肝癌已成為全球第六大常見癌癥和第四大癌癥相關死亡原因,每年新增病例約84.1萬例,死亡約78.2萬例[2]。因此,肝癌被認為是近年來發病率上升最快、死亡率最高的腫瘤之一。肝癌患者的治療首選是手術切除,但是由于部分患者在診斷時已經處于中晚期,所以不符合手術切除的適應癥[3]。因此,尋找治療肝癌的有效辦法仍迫在眉睫。
高三尖杉酯堿(homoharringtonine,HHT)是一種從不同三尖杉屬植物中提取的植物生物堿,美國FDA已經批準將高三尖杉酯堿用于治療慢性粒細胞白血病[4]。近年來已有研究表明,HHT對胰腺癌[5]、結直腸癌[6]、乳腺癌[7]、黑色素瘤[8]等均有一定的抑制作用,但對肝癌的研究甚少,因此,本研究旨在探討HHT對肝癌細胞增殖的影響及可能的機制。
1 材料與方法
1.1 細胞株人肝癌細胞PLC5由重慶醫科大學干細胞與組織工程研究室提供。
1.2 藥物與試劑高三尖杉酯堿注射液(homoharringtonine injection,1 g·L-1)購自杭州民生藥業有限公司,高糖DMEM細胞培養液購自Hyclone公司,胎牛血清購自Lonsera公司(S711-001S),Cell Counting Kit-8(CCK-8)購自上海東仁化學科技有限公司(CK04),青霉素-鏈霉素(C0222)、胰酶消化液(C0201)、EdU細胞增殖檢測試劑盒(C0071S)、RIPA裂解液(強)(P0013B)、蛋白酶磷酸酶抑制劑混合物(P1048)、BCA蛋白濃度測定試劑盒(P0010S)均購自碧云天生物技術有限公司,PAGE凝膠快速制備試劑盒(PG113)、雙色預染蛋白Marker(WJ103)和無蛋白快速封閉液(PS108)均購自雅酶生物,一抗抗體GAPDH、p21、CDK2、CyclinA、p53、ATM均購自Bimake公司,二抗抗體均購自CST公司。
1.3 主要儀器恒溫孵箱(Thermo),低溫高速離心機(平凡儀器,TGL-185),凝膠成像系統、M450酶標測定儀、SDS-PAGE電泳儀、電轉儀(美國Bio-Rad公司),倒置顯微鏡、倒置熒光顯微鏡(德國Leica公司)。
1.4 細胞培養復蘇PLC5細胞,接種于含有10%胎牛血清和1%青霉素-鏈霉素溶液的高糖DMEM中,置于37 ℃、5%二氧化碳的孵箱中培養,每24-48 h傳代1次。
1.5 CCK-8法檢測細胞增殖能力取對數生長期的PLC5細胞,將細胞濃度調整為2×107個·L-1,接種于96孔板中,每孔100 μL。該實驗分3組,每組5個復孔。空白對照組:不含細胞和HHT,僅含DMEM完全培養基;對照組:含細胞、DMEM完全培養基,但不含HHT;實驗組:含細胞、DMEM完全培養基和HHT(終濃度為5、10、20、40、80 μg·L-1)。分別培養24、48、72 h后,每孔中加入10 μL CCK-8工作液,繼續37 ℃孵育2 h,在450 nm處檢測其吸光度值(A)。計算24、48、72 h細胞生長抑制率,抑制率/% =(A對照組-A實驗組)/(A對照組-A空白對照組)×100%。實驗重復3次。
1.6 EdU檢測細胞增殖能力取對數生長期的PLC5細胞,將細胞濃度調整為2×107個·L-1,接種于24孔板,每孔500 μL。將該實驗分2組,對照組:接種細胞但不加藥處理;實驗組:接種細胞并加藥處理,藥物濃度為12 μg·L-1。將24孔板置于37 ℃、5% CO2的孵箱中培養24 h后,加入EdU(20 μmol·L-1)繼續37 ℃孵育2 h,4%多聚甲醛固定20 min,洗滌3次,通透液孵育15 min,洗滌3次,加入配制好的Click反應液100 μL,避光30 min,洗滌3次,DAPI染核3 min。于熒光顯微鏡下拍照,藍色為細胞核,綠色為EdU陽性細胞,即新增殖的細胞,每組拍5個視野。實驗結果用ImageJ軟件進行計數,綠色熒光數比藍色熒光數求得PLC5細胞中新增殖細胞百分比。實驗重復3次。
1.7 流式細胞儀檢測細胞周期取對數生長期的PLC5細胞,將細胞濃度調整為2×107個·L-1,接種于60 mm培養皿中,每皿3 mL。將該實驗分2組,對照組:接種細胞但不加藥處理;實驗組:接種細胞并加藥處理,藥物濃度為12 μg·L-1。培養24 h后,棄上清,PBS洗2次,胰酶消化,離心收集細胞,用PBS重懸細胞,并緩慢加入預冷的70%乙醇固定過夜。次日,離心洗去乙醇,加入500 μL PI試劑,室溫避光孵育30 min,流式細胞儀檢測細胞周期。實驗重復3次。
1.8 免疫印跡法(Western blot)檢測相關蛋白的表達將該實驗分4組,對照組:接種細胞但不加藥處理;實驗組:接種細胞并加藥處理,藥物濃度分別為3、6、12 μg·L-1。處理24 h后收集細胞,提取細胞總蛋白,用BCA蛋白濃度測定試劑盒檢測總蛋白濃度,加入蛋白質緩沖液高溫變性。將蛋白進行SDS-PAGE電泳,電轉移至硝酸纖維素膜上,使用無蛋白快速封閉液室溫封閉20 min,加入一抗(GAPDH、p21、CDK2、CyclinA、p53、ATM稀釋比例為1 ∶:1 000)置于4 ℃冰箱孵育過夜。用TBST液洗膜3次,加入與之對應的二抗(稀釋比例為1 ∶10 000)室溫孵育1 h,TBST液洗膜3次,使用ECL系統檢測蛋白表達量。實驗重復3次。
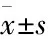
2 結果
2.1 CCK-8檢測HHT對人肝癌細胞PLC5增殖的影響使用不同濃度HHT作用于人肝癌細胞PLC5 24、48、72 h后,采用CCK-8法檢測HHT對PLC5增殖的影響,結果如Fig 1所示,隨著HHT濃度的升高,其對PLC5細胞的抑制率逐漸增加,差異有統計學意義(P<0.01),表明HHT能明顯抑制人肝癌細胞PLC5的增殖,且呈現濃度和時間依賴性。通過計算得24 h的IC50為12.27 μg·L-1,48 h的IC50為6.15 μg·L-1,72 h的IC50為2 μg·L-1。因此選擇最大濃度為12 μg·L-1的HHT處理24 h作為后續實驗的條件。
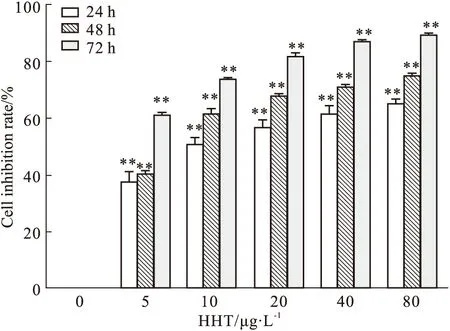
Fig 1 Effect of HHT on proliferation of PLC5 cells by CCK-8 n=3)
2.2 光鏡下觀察細胞形態HHT處理人肝癌細胞PLC5 24 h后,在倒置顯微鏡下觀察細胞狀態,如Fig 2所示,對照組細胞形態規則,呈鵝卵石狀整齊排列,生長旺盛,貼壁生長良好,僅少許細胞脫落,胞質清澈,細胞核大,隱約可見核仁;而HHT處理后的細胞增殖能力明顯降低,細胞形態發生改變,細胞發生皺縮,邊緣不齊,胞質內可見大量顆粒,細胞貼壁能力下降,脫落增多,部分細胞呈懸浮生長。

Fig 2 Cell morphology under light microscope(×20)
2.3 EdU檢測HHT對人肝癌細胞PLC5增殖的影響HHT處理人肝癌細胞PLC5 24 h后,使用碧云天的EdU試劑盒對PLC5進行染色,熒光顯微鏡下拍照。如Fig 3所示,在對照組和實驗組藍色熒光數量差不多的情況下,對照組的綠色熒光數量較多,而HHT處理后綠色熒光明顯少于對照組,差異有統計學意義(P<0.01),提示HHT能抑制人肝癌細胞PLC5的增殖。
2.4 流式細胞術檢測HHT對人肝癌細胞PLC5周期的影響HHT處理人肝癌細胞PLC5 24 h后,用流式細胞儀檢測其對PLC5周期的影響。結果如Fig 4所示,與對照組相比,經HHT處理后G0/G1期細胞數量減少,S期細胞數量增加,G2/M期細胞數量減少,差異有統計學意義(P<0.01)。提示HHT將PLC5細胞阻滯在S期。
2.5 Western blot檢測HHT對人肝癌細胞PLC5周期相關蛋白的影響用不同濃度的HHT(0、3、6、12 μg·L-1)作用于PLC5細胞24 h后,Western blot結果如Fig 5所示,經HHT處理后的PLC5細胞中 CDK2、cyclinA蛋白表達明顯降低,而p21蛋白表達顯著升高,差異有統計學意義(P<0.01)。提示HHT促使PLC5細胞周期阻滯在S期。
2.6 Western blot檢測ATM/P53通路相關蛋白用不同濃度的HHT(0、3、6、12 μg·L-1)作用于PLC5細胞24 h后,Western blot結果如Fig 6所示,經HHT處理后的PLC5細胞中 ATM和p53蛋白表達明顯升高,差異有統計學意義(P<0.01)。提示HHT誘導PLC5細胞發生DNA損傷,激活ATM/p53信號通路。

Fig 3 Effect of HHT on proliferation of PLC5 cells by EdU assay n=3)
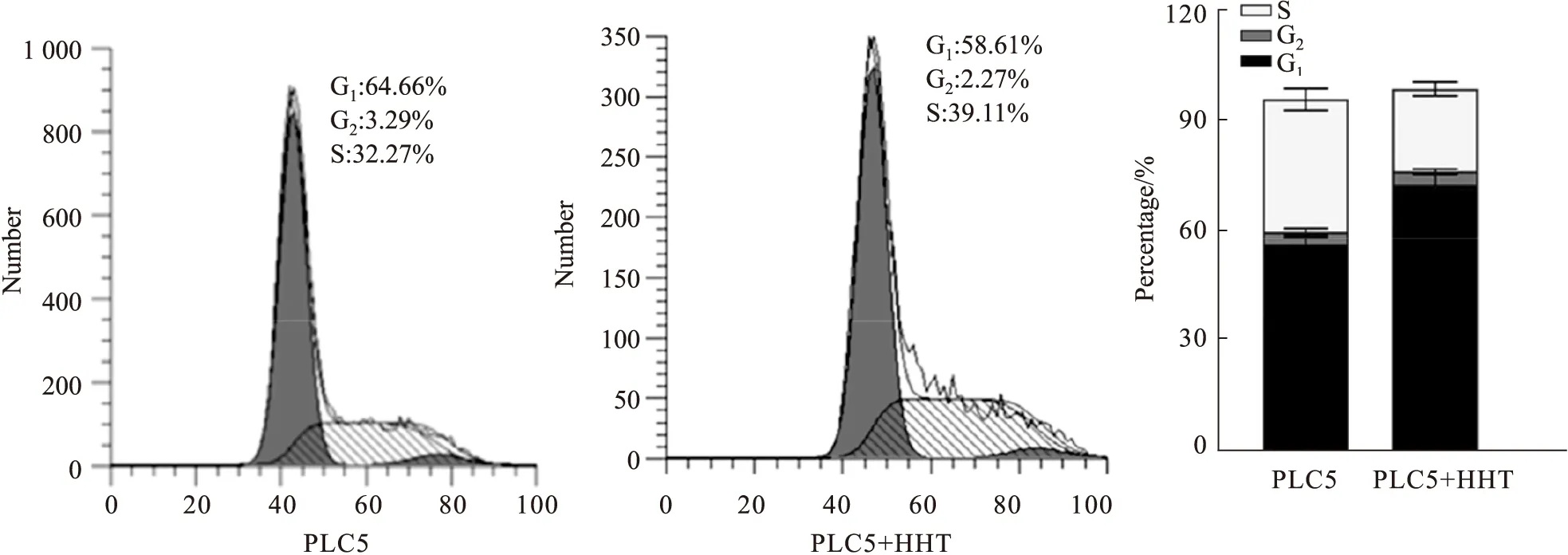
Fig 4 Effect of HHT on cell cycle distribution of PLC5 cells by FCM n=3)

Fig 5 Effect of HHT on expression of CDK2, CyclinA, p21 protein in PLC5 cells n=3)
3 討論
肝細胞肝癌(HCC)是全球第六大常見惡性腫瘤,是與癌癥相關的第四大死亡原因,也是最常見的原發性肝臟惡性腫瘤,占所有病例的75%-80%[9]。肝癌患者的傳統治療方法是手術切除和原位肝移植,但是,在最近一項病例研究發現,只有不到10%的患者符合手術切除的標準[10]。并且原位肝移植對患者造成的多種副作用使患者難以承受。因此,尋找適合絕大多數患者治療的方式變得格外重要。
近年來,中草藥抗腫瘤的作用逐漸被研究人員關注,目前已有多個抗腫瘤天然小分子藥物被批準上市。高三尖杉酯堿是一種來源于三尖杉屬植物 (cephalotaxus) 中的有效抗癌成分,已被證明具有較強的抗腫瘤活性[11]。其作用機制主要是抑制蛋白質表達,誘導細胞凋亡和分化,從而抑制腫瘤細胞增殖。有研究表明,HHT可通過激活胰腺癌細胞MEK1/ERK1/2信號通路,誘導胰腺癌細胞凋亡[5]。HHT還可以通過阻斷mTOR信號通路抑制HT29人結直腸癌細胞增殖并誘導其凋亡[12]。然而,HHT在肝細胞肝癌中的作用少有報道。本文旨在研究HHT作用于肝細胞肝癌的機制。
本研究通過CCK-8實驗和EdU實驗檢測了HHT對PLC5細胞增殖的影響,結果表明HHT對PLC5細胞的增殖有顯著的抑制作用,并呈現濃度和時間依賴性。顯微鏡下觀察發現HHT處理后的PLC5細胞數量明顯減少,細胞形態發生了改變,細胞皺縮,邊緣不齊,胞質內可見大量顆粒,細胞貼壁能力下降,脫落增多,部分細胞呈懸浮生長。進一步通過流式細胞術檢測HHT對PLC5細胞周期的影響,結果表明HHT可誘導PLC5細胞阻滯在S期。

Fig 6 Effect of HHT on expression of ATM, p53 protein
細胞周期異常是惡性腫瘤的特性之一,可導致腫瘤無限制地增殖。在細胞分裂增殖的過程中,周期蛋白Cyclins和周期蛋白依賴性激酶CDK起著重要的調控作用[13],其中cyclinA與CDK2結合在促進細胞由S期進入G2期特別是在DNA合成過程中起到了非常重要的作用。p21作為一種腫瘤抑制因子,在腫瘤細胞中處于低表達狀態,當受到藥物刺激后,其表達量會升高。當DNA受損時,p21能夠與CyclinA/CDK2復合物結合從而抑制其活性,使細胞周期阻滯在S期。而S期阻滯在大多數癌癥發病機制中發揮了重要的作用,在S期阻滯過程中,一些相關的信號通路被激活,從而引發細胞的增殖抑制。本研究中,Western blot 結果顯示,被HHT處理后的PLC5細胞內,p21表達水平的升高,而周期相關蛋白cyclinA以及CDK2的表達水平則降低,這可能與HHT將PLC5細胞阻滯在S期有關。
腫瘤抑制因子p53是一種短暫的核轉錄因子,在DNA損傷、氧化應激、癌基因激活、營養饑餓和缺氧等多種細胞應激反應中穩定并激活[14],p53的升高與腫瘤的發生、發展、轉移等密切相關[15]。共濟失調毛細血管擴張突變基因(ataxia telangiectasia-mutated gene,ATM)是一類廣泛存在于各種生物中,并廣泛表達的大型磷酸化蛋白激酶家族[16],ATM通過調控相關信號通路、維持細胞氧化還原穩態、促進細胞代謝和協同調節增殖相關信號通路活性以調控細胞正常增殖[17]。有研究表明,在DNA損傷條件下,ATM的激活會導致p53的激活,驅動細胞的衰老和凋亡,而p53的激活也使得細胞周期檢查點p21的表達升高,從而抑制細胞周期[18]。在本實驗中,用不同濃度HHT處理肝癌細胞PLC5,實驗組與對照組相比,p53和ATM蛋白水平均升高。
綜上所述,HHT對肝癌細胞PLC5有明顯的抗腫瘤活性,其作用機制可能是誘導PLC5細胞發生DNA損傷,激活DNA損傷修復信號通路,阻滯細胞于S期,從而抑制細胞增殖。本研究為HHT 抗肝細胞肝癌的深入研究及臨床應用提供了理論依據。

